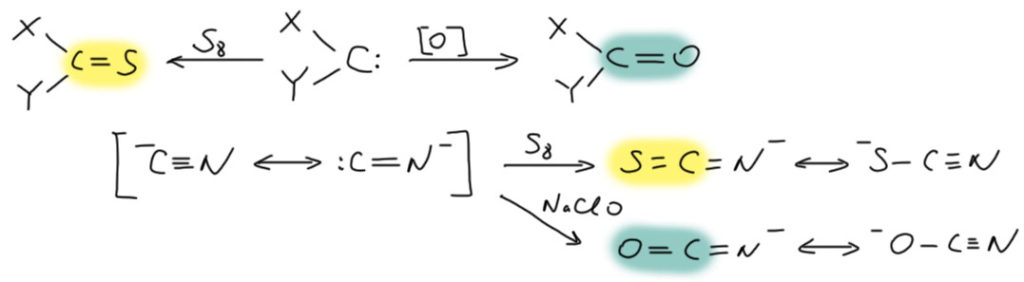в синтезе каких органических соединений может применяться карбен
Карбены и комплексы карбенов
Мы хорошо (так ли это?) знаем, что такое карбены, из обычной органической химии. Там это полезный реакционноспособный интермедиат, участвующий во многих важных реакциях, но точно уступающий по влиянию и встречаемости карбокатионам, карбанионам, радикалам. В химии переходных металлов карбены играют очень важную роль. Долгое время, впрочем, это была забавная экзотика, которой занимались немногие. С открытием и развитием метатезиса, карбены переместились на передний план и стали интересовать многих. В последние 10-15 лет карбены в химии переходных металлов стали, пожалуй, самым модным типом структуры. Их обнаруживают везде, даже там, где никто этого и не ожидал. Карбеновые лиганды наступают с неотвратимостью коронавируса, но никто не объявляет карантин, ни даже самоизоляцию, поэтому они неотвратимо и очень скоро захватят всю химию, мы перепишем все механизмы и каталитические циклы, включив в них карбены.
Пока что мы в начально стадии этой эпидемии (может, эпихимии?). Они наступают. Разберёмся немного, чтобы встретить с достоинством обречённых эти назойливые частицы.
Стабилизированные карбены
Поэтому мы гораздо чаще увидим карбены с +M-заместителями, чем с акцепторами обоих типов. Акцепторы стабилизируют пару, а ей и так неплохо, но дополнительно дестабилизируют вакантную орбиталь. Получим нечто очень нестабильное и бешено реакционноспособное.
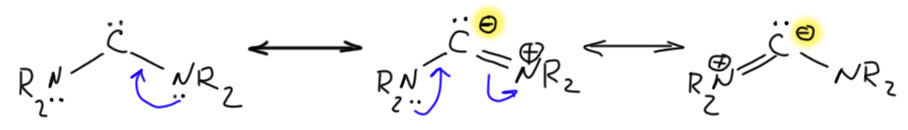
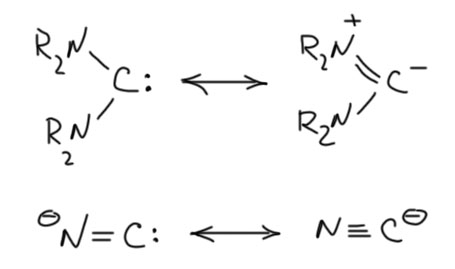
Если мы повесим на углерод один, а лучше два гораздо более сильных +М-заместителя, а ничего лучше азота с неподелённой парой и придумать невозможно – мы получим мощную стабилизацию вакантной орбитали, которая фактически перестанет быть вакантной. Карбен фактически превратится в карбанион, нуклеофил, основание Бренстеда-Лоури.
А почему мы называем это карбеном? Потому что самый надёжный формальный признак карбена – двухвалентность углерода, понимаемая как в 19 веке, когда это понятие и было придумано – число ближайших атомов, с которыми можно предположить наличие химической связи. В те времена не было никаких мезомерных эффектов, электронов и прочей дребедени, были только атомы, и некоторое представление, что они как-то связаны друг с другом. Когда мезомерные эффекты появились, мы получили возможность нарисовать граничные структуры, и сказать, что среди них есть карбеновые, а есть, например, как в этом случае – карбанионные.
Одну вещь важно понимать очень хорошо – не существует какого-то определённого свойства или типа реакционной способности, которое выдаёт в частице карбен. Вот карбанион мы распознаём по нукелофильности и основности. А карбокатион по электрофильности и кислотности Льюиса. А карбен может быть и тем, и другим, сразу или по отдельности, а может и не быть. Более хамелеонистой частицы, чем карбен, в химии нет. Поэтому мы их и узнаём то там, то сям, в самых разных ситуациях, и поэтому же до некоторого момента их не распознавали нигде – старая химия была более определённой и любила твёрдо ассоциировать конкретные свойства и типы реакционной способности с конкретными интермедиатами и типами реакционноспосбоных частиц. А новая приобрела свойство видеть всё во всём и везде, отчего её так понравились карбены и она тут же стала их узнавать, как добрых приятелей.
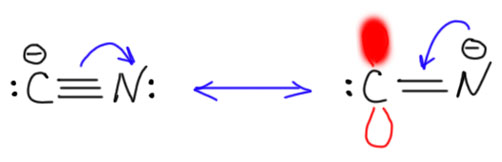
Прототипом карбена с двумя +М-заместителями является такая фундаментально простая частица, как цианид-ион. Цианид-ион – это карбанион, нуклеофил (довольно слабый) и основание (тоже не очень сильное, приблизительно равное обычным алифатическим аминам). Но мы знаем кроме цианида ещё изоцианид. Но отдельного изоцианид-иона не бывает. Цианид и изоцианид это одно и то же, когда мы говорим про анионы. Это просто две граничные структуры одной и той же частицы, которую обычно принято называть цианидом, но можно с тем же успехом называть изоцианидом. Изоцианид – карбеновая форма, цианид – карбанионная. И ещё раз взываю не путать граничные структуры и мезомерию с настоящим равновесием. К какой форме ближе реальный цианид-ион? К цианидной, карбанионной, конечно. В карбеновой, изоцианидной форме рядом находятся вакантная p-орбиталь на углероде и заполненная на азоте – понятно, что такая полностью поляризованная форма не очень выгодна, хотя в ней электроны и смещены на более электроотрицательный атом. Но некоторый вклад в структуру цианида карбеновая форма даёт.
Проявляется ли как-нибудь карбеновая природа цианид-иона? Как мы уже выяснили, трудно определить какое-то одно свойство или реакцию, свойственную всем карбенам. Один очень простой тест есть – реакция с электрофильным кислородом или серой даёт карбонильную или тиокарбонильную группу. Электрофильный кислород – это например, перекиси или гипохлорит. Электрофильная сера – просто сера. И да, и та, и та реакции есть, и в простой химии, и в биохимии. Образуется цианат и тиоцианат-ионы. Так, например, обезвреживают цианиды.
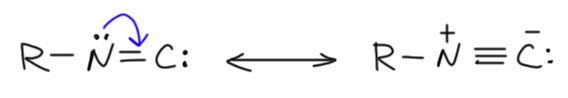
Карбеновую изоцианидную форму легко зафиксировать, превратив анион в изоцианиды – стабильные и фантастически зловонные вещества. Не будем здесь вспоминать всю эту химию амбидентного нуклеофила цианид-иона, просто признаем, что как-то получить изоцианиды можно. Изоцианиды – типичные стабильные карбены. Граничные структуры у изоцианида имеют такую же природу, но несложно заметить, что в этом случае карбеновая структура выглядит не хуже карбанионной с разделением зарядов, хотя именно вторая структура отвечает за нуклеофильность изоцианидов, например, в реакциях Уго и Пассерини, в которых изоцианид присоединяется к карбонильным группам.
Цианид-ион очень хорошо моделирует карбены с двумя сильными донорами типа амино-групп. Это видно даже просто сравнением структур.
Карбеновая форма с двухвалентным углеродом – две связи к азоту. Карбанионная форма с обычным углеродом – три связи к азоту. По карбанионной форме отлично видим, что речь идёт о производных муравьиной кислоты, нитриле и амидинах. И об общей структурной особенности таких соединений – тот протон, который есть на углероде муравьиной кислоты, в таких производных муравьиной кислоты может быть оторван основаниями, а получающиеся карбанионы имеют карбеновую граничную структуру и некоторые особые свойства, присущие карбенам. Одна проблема – мы не очень хорошо понимаем какие.
Гетероциклические карбены (NHC)
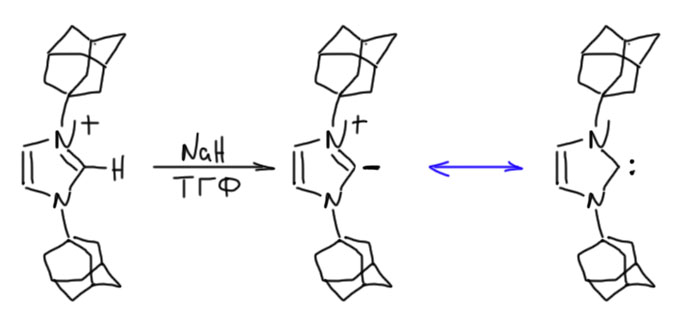
Но – проблема повисла и надолго. Всем показалось, что это экзотика, и к настоящей, большой химии отношения не имеет. Так, игрушка для любителей помучится, получить что-нибудь этакое, накропать красивую статейку, и прославиться. В большой же химии люди ищут серьезные способы синтеза и применяют их к важным, полезным молекулам. Никто к этим карбенам серьёзно не возвращался ло 1990-х, пока за дело не взялся американский химик Энтони Ардуэнго Третий. Ардуэнго с сотрудниками изучили работы Ванцлика, поняли, что он подошёл к решению проблемы вплотную, но немного не допёр, что нужно взять на азоте заместитель побольше чтобы помешать карбену димеризоваться в равновесии Ванцлика. Мелочиться не стали, взяли сразу адамантил. И получили, что хотели – стабильное кристаллическое вещество (Arduengo, A. J., III; Harlow, R. L.; Kline, M. A Stable
Crystalline Carbene. J. Am. Chem. Soc. 1991, 113, 361), даже не требующее никаких особенных предосторожностей в работе кроме одного – оно не любит влаги. Воздух – пожалуйста, если сухой. И – отдельный признак очень стабильных, прямо таки дубовых веществ – высокая температура плавления без разложения (240ºС).
Ардуэнго привёл доказательства, что полученное им соединение – именно карбен. И это понятно, кому интересен ещё один карбанион, их к этому времени были известны многие тысячи. А вот стабильный карбен – это сенсация. Строго говоря, несколько стабильных карбенов до этого уже успели получить, но это были не самые простые соединения, да и стабильность их была не такой осязаемой, как у этого. Поскольку никаких реакций типических для карбенов с этим карбеном не получается, упирать пришлось на структуру. Самым важным и действительно поразительным свойством новой структуры было полное отсутствие признаков ароматичности. Исходный имидазолий – вполне ароматическая молекула с выровненными, насколько это возможно, длинами связей, максимально приближенная по форме к правильному пятиугольнику. А то, что получилось, было демонстративно уродливо – кольцо, конечно, оставалось плоским, но передний углерода выдвинулся вперёд, образовав валентный угол даже меньший, чем в sp3-гибридном состоянии. Меньший – это значит, что на этих связях увеличился p-характер, а поскольку, если в одном месте прибыло, то в другом должно убыть, а следовательно, орбиталь с неподелённой парой стала очень-очень похожа на почти чистую s-орбиталь, конечно, с небольшой примесью p, то есть, оставшись гибридной, стала очень компактной и низкой по энергии.
Посмотрим на эту ситуацию ещё раз, потому что она довольно необычна и в некотором смысле даже поразительна. Большинство из нас, если не вообще все без исключения живут с очень простой мыслью: ароматичность – это самое лучшее, что может случиться с молекулой. Если бы у молекул был рай, то там обитали бы исключительно ароматические молекулы, летали бы там в райском вакууме вместе со сферическими конями и пели осанну Творцу. Добровольно отказаться от ароматичности – нет, немыслимо! похоже на грехопадение, это карается изгнанием из рая, ну и так далее. Поэтому, когда нам рисуют молекулу, в которой можно, правильно расположив связи и правильно посчитав электроны, увидеть ароматичность, мы без колебаний так и поступим. Всегда, конечно, нужно правильно посчитать электроны, но в ароматичности, как и в выборах, всегда действует правило, – кто считает, тот и прав. Конечно, мы уже научились мириться с мыслью, что это касается только не очень больших циклов, и что, начиная с 8-членных циклов начинаются всякие капризы. Но уж для 5- и 6-членных циклов отказаться от ароматичности – немыслимое дело, сатанинские стихи.
Но вот если мы поверим Ардуэнго Третьему, то у него так и получается. Был ведь вполне ароматический имидазолий, и всё, что с ним сделали – просто оторвали протон из плоскости кольца – и получилась неароматическая частица. Вспомните опять обычную органическую химию – мы там много разбирали случаев, когда у ароматической молекулы что-то происходит в плоскости кольца, и всегда утверждали, что это никак не отражается на π-системе и её ароматическому характеру. Это так или мы что-то упустили?
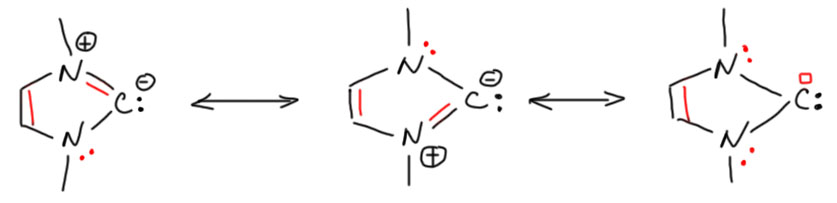
На самом деле, и так, и не так. Подробнее здесь не будем, это долгий разговор, но ароматичность нельзя понимать как абсолютное благо. Это действительно благо (приводит к стабилизации молекулы), но относительное. В любой молекуле множество самых разных взаимодействий, стабилизирующих и дестабилизирующих, и реальная структура молекулы получается в результате нахождения компромисса, баланса между разными взаимодействиями. Ароматичность – только одно из них, хотя и очень весомое, но только в совершенно симметричных молекулах, с циклами, состоящими из одинаковых атомов (углерода чаще всего), это взаимодействие действительно имеет такой стабилизирующий вклад, что всё остальное почтительно расступается. В гетероциклах на это накладываются споры между атомами разной электроотрицательности, которым не очень хочется делить всё поровну, как и предполагает ароматическая делокализация. Мы отлично знаем, что, например, фуран имеет только эфемерные признаки ароматичности как раз потому что кислород не желает делиться парой электронов. Вот и в случае депротонированного имидазолия ситуация очень похожа. Посмотрим на граничные структуры этой молекулы. Их три, две одинаковые, соответствующие нашим представлениям от карбанионе из имидазолия. Мы считаем эти структуры ароматическими только потому, что они получена удалением протона из плоскости кольца изначально безусловно ароматического катиона имидазолия. Красным я показал пары и связи, участвующие в ароматической стабилизации. И третья структура – карбеновая. Мы в ней видим тоже непрерывный сопряжённый контур, где опять красным выделены участвующие в циклическом сопряжении (π-сопряжении) орбитали, но здесь это не только π-связь и пары, но и вакантная орбиталь на углероде (в химии нет общеупотребительного символа для пустой орбитали, как бы сказали в физике, дырки, поэтому используем просто пустой квадратик). Видим те же шесть электронов в цикле. Вывод простой – никто не лишает нас условий для ароматической делокализации ни в одной из этих структур. Вопрос только в том, насколько эта ароматическая делокализация важна для результирующей структуры. Ответ очевиден – не очень важна. Ароматическая стабилизация старается макксимально выровнять структуру – сделать максимально близкими по длине все связи, а цикл – максимально похожим на правильный пятиугольник. Другие факторы этому противостоят. Углерод предпочитает регибридизацию с тем, чтобы максимально понизить энергию орбитали, на которой находится пара. Его легко понять. Регибридизация неотвратимо приводит к увеличению длины связей C-N, а значит и с уменьшению эффективности взаимодействия на этом участке π-сопряжения, и к общему уменьшению стабилизации за счёт циклической делокализации. Азоты в этом случае тоже получают свой бонус – как более электроотрицательные атомы они получают свои пары в большее распоряжение (мы просто не должны забывать, что у структурах мы рисуем дискретные пары и связи, а в реальной молекуле каждый атом располагает своей, в общем случае нецелой частью электронной плоности), что снижает положительный заряд на этих атомах. В таком балансе взаимодействий и получается результирующая структура.
Подведём некоторые итоги. Можем ли мы считать, что карбеновая структура наилучшим образом отражает реальную структуру “карбена Ардуэнго”? Можем, но при условии того, что мы признаём и значительный вклад двух других структур. Является ли “карбен Ардуэнго” неароматическим? Да, но только в том смысле, что ароматическая делокализация, которая в этой молекуле обязательно есть (все три структуры имеют π-делокализацию и правильное число электронов в цикле) не даёт достаточного выигрыша энергии, чтобы обусловить образование максимально выровненной структуры, и стабилизация за счёт регибридизации, приводящая к частичному искажению геометрии кольца, выигрывает в балансе взаимодействий. Но баланс этот количественный (столько-то одного и столько-то другого), а не качественный (ароматическая – да или нет? а варианта “затрудняюсь ответить” нет). Из этого неоднозначного вывода следуют несколько важных вещей.
“Насыщенные” и “ненасыщенные” гетероциклические карбены
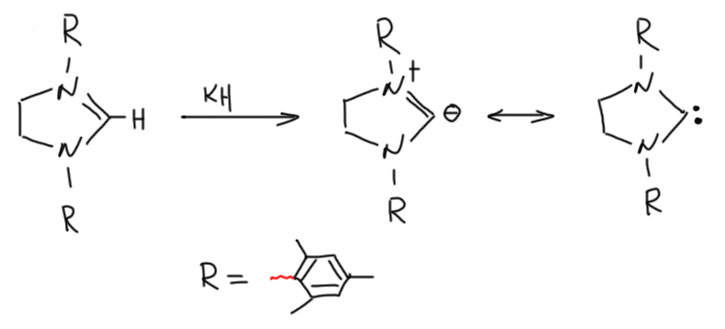
Так как Ардуэнго пришёл к выводу, что полученные им карбены – это именно карбены, большой необходимости в том, чтобы иметь ароматическое исходное, имидазолиевую соль, нет. И можно взять неароматическое исходное, имидазолин (имидазолин – это дигидроимидазол, с одной двойной связью, а совсем насыщенный называется имидазолидин, но он бесполезен для получения карбена), тоже кватернизованный, отнять у него протон и получить стабильный карбен. Эта гипотеза вполне сработала. Первый такой карбен имел два объёмистых мезитильных заместителя на азотах.
Итак, карбен получился такой же, но не совсем. Стабильный, но не настолько, как такой же, но из имидазолия. Но это мелочи. Важнее то, что он ещё более донорный, и как лиганд, и как основание. Причина этого проста – мы всё же не можем в имидазолиевом карбене игнорировать ароматическую делокализацию, частично оттягивающую электронную плотность от карбенового углерода. В “насыщенном” аналоге этого эффекта нет.
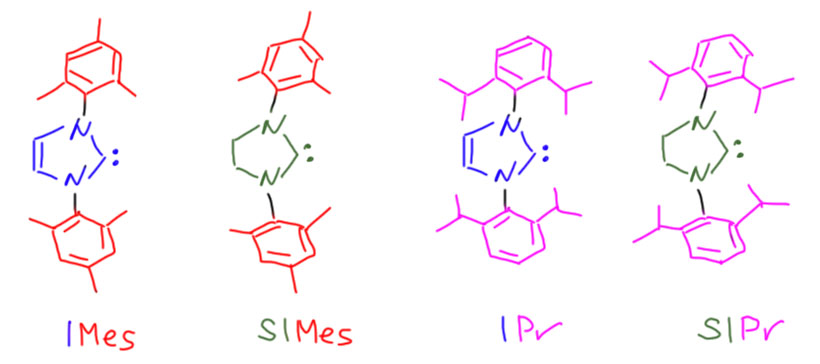
Набор из четырёх самых популярных NHC состоит из двух пар. На азоте используют два заметителя – объёмистый мезитил и ещё более объёмистый 2,6-диизопропилфенил. И каждая пара состоит из имидазолиевого и имидазолинового карбена. Получаем множество, в котором можем увеличивать стерический объём и донорность. Называют их очень просто – имидазольный остов сокращают в I, насыщенный в SI. И добавляют заместитель. Вот эта священная четвёрка, с которой вы будете в современной химии сталкиваться гораздо чаще, чем с трифенилфосфином.
Иногда, редко, но бывает так, что требуется ещё больший стерический объём. Тогда вспоминают про самый первый карбен, полученный Ардуэнго, называя его по той же схеме IAd. И к нему тоже есть пара SIAd.
МЕТИЛЕН (КАРБЕН)
Карбены – нестабильные соединения двухвалентного углерода – являются в органической химии наряду с ионами и свободными радикалами одним из основных классов высокореакционных промежуточных частиц (интермедиатов), которые определяют направление протекания химических реакций и характер образующихся продуктов.
Карбены и их аналоги участвуют во многих химических реакциях и практически важных процессах, причем круг таких реакций по мере совершенствования методов синтеза и исследования механизмов реакций постоянно расширяется. С участием карбенов связаны многие пиролитические процессы (например, получение тетрафторэтилена и гексафторпропилена, пиролиз углеводородов); по мере повышения температуры пиролиза роль карбеноподобных интермедиатов в этих процессах возрастает. Кремниевые и германиевые аналоги карбенов участвуют в таких важных промышленных процессах, как «прямой синтез» кремнийорганических соединений, получение высокочистых кремния и германия. Широкие перспективы открывают карбеновые методы в тонком органическом синтезе, в том числе в промышленном.
ИСТОРИЯ ОТКРЫТИЯ КАРБЕНОВ
На первых порах развитие это не было бурным, и лишь 50-е годы после установления карбенного механизма щелочного гидролиза галоформов и обнаружения препаративной значимости данной реакции интерес к химии карбенов заметно возрос. Последующие годы характеризовались расширением именно препаративных аспектов химии карбенов. Здесь в первую очередь следует отметить разработку удобных карбенных методов синтеза циклопропановых углеводородов и их производных из олефинов – получение циклопропанов по Симмонсу – Смиту, галогенциклопропанирование олефинов с помощью галогензамещенных карбенов (прежде всего дигалогенкарбенов), синтез производных циклопропанкарбоновой кислоты термокаталитическими реакциями этилдиазоацетата, а также широкое исследование химических превращений циклопропанов, получаемых с участием карбенов. Таким образом, в 50-60-е годы XX века карбенные методы прочно вошли в синтетическую практику органической химии, хотя строгого обоснования и доказательств реального участия карбенов в большинстве случаев не было. Тем не менее уже в эти годы с целью оценки возможности участия в исследуемых реакциях карбенов и их мультиплетности были предложены и широко использовались качественные и полуколичественные тесты и подходы типа постулатов Скелла и метода конкурирующих реакций [1].
Проблема существования метилена и его ближайших гомологов занимала ученых еще в XIX веке. В нашей стране (Бутлеров, 1861 г.) и за рубежом (Дюма, 1835 г.) делались неоднократные попытки получить такие соединения с помощью реакций-элиминирования. При существовавшем тогда уровне экспериментальной техники эти попытки закончились неудачно. Позднее (Неф, 1897 г.) была выдвинута гипотеза о промежуточном образовании частиц с двухвалентным атомом углерода в ходе некоторых химических реакций. Эта гипотеза получила первое подтверждение в работах Штаудингера (1912 г.) и Райса и Глейзбрука (1933 г.), доказавших образование метилена при пиролизе диазометана и кетена. Хайн (1950 г.), изучая кинетику гидролиза галоформов, пришел к заключению о возникновении в этой реакции дигалокарбенов, а Деринг и Гофман (1954 г.) продемонстрировали способность этих частиц присоединяться к олефинам с образованием производных 1,1-дигалоциклопропана. Пионером химии карбенов в СССР был И.А. Дьяконов, который в 1949 г. показал, что при каталитическом разложении диазоуксусного эфира образуется этоксикарбонилкарбен, и в последующие годы (1951-1968 гг.) описал многие свойства этой частицы. В настоящее время получены данные, свидетельствующие о промежуточном образовании карбенов и во многих других реакциях.
Относительно недавно удалось получить карбены в метастабильном состоянии при низких температурах: первым в 1962 г. был получен дифторкарбен при температуре 77 К в стекле из замороженного аргона (так называемый метод матричной изоляции). Позднее были получены в матрицах многие другие карбены – метилен, гало-, дигало-, фенил- и дифенилкарбены. Их строение подтверждено методами ИК, УФ, ЭПР и масс-спектрометрии. Совпадение экспериментальных данных о строении этих частиц с результатами квантово-химических расчетов делает достоверным реальное существование карбенов.
Несмотря на то, что метилен был предсказан ещё в 30-х годах XX века, его существование было доказано лишь в 1959 году спектральными методами исследований [2].
В данном реферате будет рассказано о главном простейшем представителе ряда карбенов – метилене (:.
СТРОЕНИЕ
В изданном Международным союзом теоретической и прикладной химии (IUPAC) «Глоссарии терминов, используемых в физической органической химии» дано следующее определение карбенов: «родовое название частиц : и их замещенных производных, содержащих электрически нейтральный двухвалентный атом углерода с двумя несвязывающими электронами».
Для них характерны следующие структурные (электронные) и химические признаки: наличие у центрального атома не менее одной пары несвязывающих s- или p-электронов и не менее одной вакантной p-орбитали (или двух электронов на двух p-орбиталях); отсутствие свободных d-уровней с меньшим главным квантовым числом, чем у валентных p-электронов и p-уровней; способность к образованию одной () или двух () новых ковалентных связей.
Кроме того, исключительно важной особенностью карбенов и их аналогов является склонность к комплексообразованию, определяемая наличием как вакантной p-орбитали, так и свободной электронной пары.
В отличие от радикалов и ионов карбены могут характеризоваться различной мультиплетностью и в зависимости от спинового состояния двух несвязывающих электронов могут обладать структурными элементами,типичными как для анионов и катионов (синглетные карбены), так и для свободных радикалов (триплетные карбены) [1].
Рисунок 1 – Синглетный и триплетный метилен
Рисунок 2 – Реакции синглетного метилена
с органическими соединениями
а – по связям углерод-углерод; б – по связям углерод-водород;
в – по кратным связям
Триплетный метилен реагирует более избирательно.
Таким образом, карбен в синглетном состоянии напоминает по своему строению карбокатион и обычно проявляет электрофильные свойства [4].
СПОСОБЫ ПОЛУЧЕНИЯ
Метилен : при фотолизе диазометана образуется в менее стабильной синглетной форме. Синглетный метилен в условиях реакции в результате столкновений с молекулами диазометана или азота быстро теряет энергию и превращается в более стабильный триплетный метилен. Поэтому процессы с участием триплетного метилена целесообразно изучать в газовой фазе в атмосфере инертного газа при малых концентрациях субстрата. Фотолиз диазосоединений удобен для генерации самого метилена, но мало употребим для генерации других карбенов вследствие малой доступности высших диазоалканов.
Метилен также образуется при фотолизе кетена (Норриш, 1933 г):
Триплетный метилен является свободным радикалом, в действительности дирадикалом. Вследствие различной электронной конфигурации два типа молекул отличаются по форме и химическим свойствам. Синглетный метилен менее стабилен и часто, хотя и не всегда, образуется в первую очередь при фотолизе. Поскольку свет, поглощаемый диазометаном или кетеном при фотолизе, обладает большей энергией, чем необходимо для фотолиза, образовавшийся метилен является «горячим», т.е. эти молекулы метилена имеют большую энергию, чем они должны были бы обладать при данной температуре.
Как промежуточное соединение он возникает при каталитическом восстановлении окиси углерода и в ряде других случаев (несмотря на малую продолжительность жизни, этот бирадикал играет важную роль во многих реакциях, например в реакции Фишера-Тропша) [5]:
ХИМИЧЕСКИЕ СВОЙСТВА
Карбены – очень реакционноспособные промежуточные частицы, принимающие участие в различных процессах. Для препаративной органической химии представляют интерес следующие реакции:
Присоединение карбенов по кратным связям с образованием трехчленных циклов, например:
Внедрение карбенов в простые связи с образованием гомолога исходного соединения или его производного, например:
Перегруппировки карбенов, ведущие к образованию циклопропанов, олефинов, кетенов, алленов и т.д., например [5]:
Химические свойства метилена зависят от условий синтеза: реагента, из которого образуется метилен; длины волны используемого свет; проводится ли реакция в жидкой или газовой фазе, и если в газовой фазе, то в присутствии инертного газа (азота, аргона и двуокиси углерода) или не такого уж инертного газа, кислорода. Ситуация очень сложная и не всегда соответствует точной интерпретации фактов. В общем можно представить два типа метилена: состояние с высокой энергией, высокой реакционной способностью и низкой селективностью; состояние с низкой энергией, более низкой реакционной способностью и большей селективностью. Согласно одной точке зрения (той, которая более принята), два типа метиленов являются просто синглетным и триплетным метиленом соответственно; согласно другой точке зрения, свойства метилена определяются не его спиновым состоянием, а тем, насколько он «горячий».
Доказано, что внедрение метилена может протекать по двум различным механизмам:
а) прямое внедрение, когда метилен каким-то образом вклинивается между связями:
б) отщепление – присоединение, когда метилен отрывает водород с образованием двух свободных радикалов, которые затем соединяются:
Предположим, что синглетный метилен реагирует по первому типу (прямое внедрение), а триплетный метилен (дирадикал) – по второму (свободнорадикальное отщепление и затем присоединение).
В реакциях метилена с алканами можно увидеть следующие довольно простые закономерности:
Рисунок 3 – Закономерности реакций метилена с алканами
Реакция внедрения может протекать с участием любой из форм метилена – синглетной или триплетной, причем каждая из форм реагирует по различному механизму и с разной степенью селективности: а) в жидкой фазе в реакцию вступает синглетный метилен, и реакция происходит по механизму прямого внедрения и неселективно; б) в газовой фазе в реакцию вступает триплетный метилен, и реакция происходит селективно по механизму отрыва водорода и присоединения, причем она ингибируется кислородом и идет лучше в присутствии инертного газа [5].
Реакции циклоприсоединения и внедрения
Установлено, что присоединение синглетных карбенов к кратной связи олефина происходит по согласованному механизму, т.е. через одно переходное состояние (это переходное состояние имеет частично ионный характер). Следствием согласованного механизма реакции 1,1-циклоприсоединения синглетных карбенов к олефинам является цис-стереоспецифичность этой реакции: замыкание трехчленного кольца происходит без изменения взаимного пространственного расположения заместителей при двойной связи исходного олефина, и из цис-олефина образуется цис-дизамещенный циклопропан, а из транс-олефина – транс-дизамещенный циклопропан (Деринг и Хофман, 1954 г; Скелл, 1956 г):
Сказанное относится как к свободным, так и к связанным карбенам [2].
Наиболее удивительной особенностью этой реакции является то, что возможны две разные стереохимические схемы; это указывает на осуществление двух различных механизмов. Характер зависимости стереохимии от условий реакции – газовая или жидкая фаза, присутствие или отсутствие инертного газа или кислорода – показывает, что каждый из способов присоединения соответствует определенному способу реакции внедрения и связан с определенной формой метилена.
Кажется вероятным (как предположил П. Скелл), что в реакцию одностадийного стереоспецифического присоединения вступает синглетный метилен:
В то же время триплетный метилен (дирадикал) вступает в аналогичную свободнорадикальную реакцию двухстадийного нестереоспецифического присоединения, т.е. реакцию по схеме «присоединение – сочетание» [5]:
В этой реакции наиболее отчетливо проявляется различие в реакционной способности синглетной и триплетной формы карбенов. Карбен в трипленом состоянии является бирадикалом и следует ожидать, что триплетный карбен должен обладать такой же реакционной способностью и селективностью в реакциях с алкенами, как и другие бирадикальные частицы. Синглетный карбен с пустой р-орбиталью и неподеленной парой электронов должен быть «бифильным» реагентом, т. e. одновременно и электрофильным и нуклеофильным агентом. Синглетный карбен может участвовать в синхронном одностадийном циклоприсоединении к двойной связи, тогда как триплетный карбен должен присоединяться в две последовательные стадии.
Для синглетного карбена характерно синхронное присоединение к двойной связи алкена с полным сохранением геометрии при двойной связи (реакция [2+1]-циклоприсоединения), разрешенное по симметрии. Присоединение синглетной формы карбена по двойной связи происходит, таким образом, строго стереоспецифично. Хорошей моделью переходного состояния в этом случае является активированный комплекс [3]:
Фотохимическое присоединение карбенов протекает через триплетное возбужденное состояние с промежуточным образованием бирадикалов, а потому, как правило, не стереоселективно из-за вращения вокруг-связи на стадии бирадикала.
Таким образом, стереоселективность реакции может служить подтверждением протекания ее по согласованному механизму.
Этилен образуется не путем сочетания двух молекул карбена, а в результате сложного ряда реакций, которому приблизительно соответствует следующее уравнение:
Одной из характерных и необычных реакций карбена, который в высшей степени неустойчив, является атака связи C-H с образованием C-, называемая реакцией внедрения. Реакционная способность синглетного метилена настолько велика, что внедрение его по связи С-Н не избирательно. Связи С-Н для первичного, вторичного и третичного атома углерода подвергаются атаке синглетного :CH2 примерно с одинаковыми скоростями. При внедрении самого метилена по связи C-H в растворе фактически не обнаруживается различий между первичными, вторичными и третичными связями (в газофазных реакциях такие различия не слишком велики). Так, карбен, получающийся из кетена, реагирует в газовой фазе с пропаном, образуя н-бутан и изобутан в соотношении 7:4 (однако из-за неселективности этот путь непригоден в синтетических целях, так как приводит к смеси изомеров):
Если бы взаимодействие в этом случае подчинялось закону вероятности, то н-бутан и изобутан должны были бы получиться в соотношении 6:2. Следовательно, подобно радикалу хлора при фотохимическом хлорировании, карбен легче реагирует со связями C-H вторичных атомов углерода, чем первичных. Меервейн нашел (1942 г.), что карбен, образующийся при пиролизе или облучении диазометана в присутствии диэтилового эфира внедряется в молекулу эфира двумя путями [6]:
Реакция с н-пентаном в жидкой фазе представляет интерес по следующей причине: соотношение продуктов реакции соответствует произвольной атаке реагентом. Полное отсутствие селективности в данном случае объясняется тем, что метилен, который является атакующей частицей, находится не только в синглетном состоянии, но еще и «горячий», поэтому каждое столкновение с первичной или вторичной связью имеет достаточно энергии для реакции (так, как если бы реакция проводилась при очень высокой температуре):
Реакции внедрения характерны только для активных синглетных карбенов. Для триплетных карбенов характерны не реакции внедрения по связи С-Н, а отщепление от алканов атома водорода с образованием свободных радикалов:
Далее образующиеся свободные радикалы претерпевают характерные для них химические превращения (рекомбинация, диспропорционирование, реакция с кислородом воздуха и т. д.) [3].
В отсутствие других реакционноспособных веществ метилен димеризуется в этилен или полимеризуется в твердые полиметилены.
Если разложение диазосоединения проводится в присутствии алкена, то карбен присоединяется к двойной связи с образованием соответствующего циклопропана [7]:
Реакции с ароматическими соединениями
Углерод-углеродные связи бензольных колец значительно менее активны по отношению к карбенам, чем кратные связи олефинов и ацетиленов. Это позволяет проводить реакцию с карбеном избирательно, только с участием кратных связей боковых цепей, не затрагивая ароматического кольца. При отсутствии ненасыщенности боковых цепей карбены могут присоединяться и к ароматическим ядрам. Одноядерные ароматические углеводороды образуют производные циклопропана при взаимодействии лишь с немногими карбенами, фотолиз диазометана в бензоле дает циклогептатриен путем валентной изомеризации промежуточно возникающего бицикло[4,1,0]гепта-2,4-диена (12). Побочно в этой реакции образуется продукт внедрения – толуол (до 9%):
Удобный препаративный метод получения замещенных циклогептатриенов состоит в действии на бензол и его гомологи диазометаном в присутствии солей одновалентной меди. Выходы алкилциклогептатриенов достигает при этом 80%:
Если при фотолизе диазометана в среде ароматического углеводорода циклогептатриен всегда получается в смеси с продуктами внедрения метилена по связи C-H исходного углеводорода, то при каталитическом методе генерирования карбена таких побочных продуктов не образуется.
На взаимодействии карбенов, в частности метилена, с ароматическим ядром индана и его гомологов основан распространенный метод синтеза азуленов. Метод состоит в расширении бензольного кольца индана до семичленного и последующем дегидрировании аддукта [2]:
В заключение хочется сказать, что во многих конкретных (экспериментальных) исследованиях синтетические и физико-химические аспекты химии карбенов рассматриваются раздельно, все больше начинает показываться объединение синтетических, кинетических, инструментальных и расчетных аспектов химии карбенов и их аналогов в единое научное направление. Этому в большей мере способствует повышение качества и расширение границ применения расчетных методов и появление новых экспериментальных возможностей регистрации карбенов и подобных им интермедиатов с помощью пико- и наносекундной лазерной спектроскопии. Это позволяет, в частности, следить за генерированием и исчезновением карбенных центров в реальных многокомпонентных жидкофазных системах, определять спектральные, кинетические и термодинамические параметры карбенов и реакций с их участием. Появляются и совершенствуются другие инструментальные методы прямого наблюдения и изучения карбеноподобных интермедиатов (пиролитическая масс-спектрометрия, газовая электронография в сочетании с масс-спектрометрией, фотоэлектронная спектроскопия и др.).
В свою очередь разработка новых и усовершенствование известных методов инициирования химических реакций, таких, как электрохимия, фотолиз, адиабатическое сжатие, механохимия, воздействие ультразвука и высоких давлений со сдвигом, не только содействует расширению применения карбенов и их аналогов в синтезе, но и открывает новые возможности для изучения кинетических и структурных аспектов реакций с участием этих частиц.
Все это позволяет высоко оценить современное состояние химии карбенов и их аналогов и ожидать по-прежнему интенсивного развития этой области химии в ближайшем будущем.
Нефедов О.М. Химия карбенов [Текст]: монография / О.М. Нефедов [и др.]. – М.: Химия, 1990. – 304 с.
Мандельштам Т.В. Современные методы органического синтеза [Текст]: книга для химических факультетов университетов / Т.В. Мандельштам [и др.]. – 2-е изд.. – Л.: Изд-во Ленинградского университета, 1980. – 232 с.
Реутов О.А. Органическая химия [Текст]: книга для университетов. В 4-х частях. Часть 1 / О.А. Реутов [и др.] – М.: БИНОМ. Лаборатория знаний, 2004. – 567 с.
Шабаров Ю.С. Органическая химия [Текст]: книга для университетов. В 2-х кн. Часть 1: Нециклические соединения / Ю.С. Шабаров. – М.: Химия, 1994. – 848 с.
Физер Л. Органическая химия. Углубленный курс [Текст]: книга для химических спец-ей. В 2-х т. Том 2. Перевод с английского / под ред. Н.С. Вульфсона / Л. Физер [и др.] – М.: Химия, 1966. – 783 с.
Тюкавкина Н.А. Органическая химия [Текст]: книга для университетов. В 2-х кн. Часть 1: Основной курс / Н.А. Тюкавкина [и др.]. – 2-е изд., стереотипное. – М.: Дрофа, 2003. – 640 с.