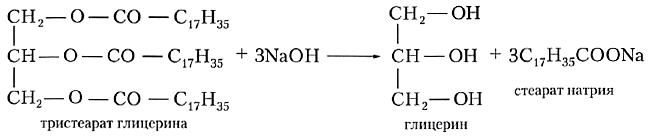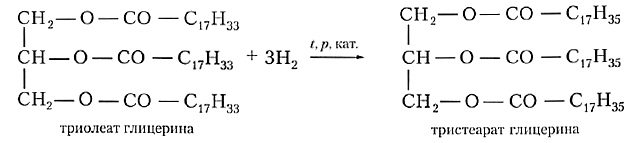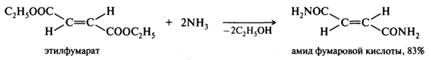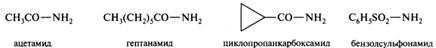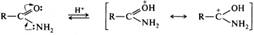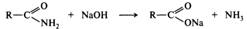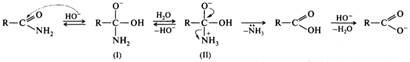в случае какого гидролиза сложные эфиры омыляются необратимо
В случае какого гидролиза сложные эфиры омыляются необратимо
Функциональные производные карбоновых кислот
Сложные эфиры представляют собой продукты замены кислотного гидроксила алкокси- или арилоксигруппой. Получение сложных эфиров сводится либо к ацилированию спиртов хлорангидридами, ангидридами, нитрилами и собственно кислотами (реакция этерификации), либо к алкилированию карбоксила. Второй путь подразумевает реакцию карбоксилат-аниона с алкилгалогенидами или самих кислот с диазометаном (в случае получения метиловых эфиров).
Свойства сложных эфиров
В кислой среде сложные эфиры гидролизуются до соответствующих карбоновой кислоты и спирта. Все стадии этой реакции обратимы, устойчивость эфира и кислоты, равно как нуклеофильность спирта и воды сравнимы, поэтому соотношение компонентов реакционной смеси зависит от условий реакции. Присутствие водоотнимающего агента способствует образованию эфира (реакция этерификации), напротив, избыток воды и отгонка спирта – гидролизу.
Гидролиз сложных эфиров в щелочной среде необратим (его можно назвать расщеплением). Это связано с тем, что в щелочной среде карбоновая кислота существует в виде аниона, который практически не обладает ацилирующими свойствами и обратная реакция становится невозможной.
Сложные эфиры способны к ацилированию большого числа различных активных нуклеофилов, таких как амины, гидразины, спирты, тиолы и т.д.
Схема приведенных реакций практически не отличается от механизма аналогичных превращений хлорангидридов и ангидридов, хотя активность эфиров заметно ниже. Это обстоятельство делает синтезы с участием сложных эфиров более контролируемыми. Например, для получения кетонов и спиртов широко практикуется их взаимодействие с металлоорганическими соединениями.
Сложные эфиры, как и другие производные карбоновых кислот, могут быть восстановлены. Так, действие на эфиры металлическим натрием (восстановление по Буво-Блану) в спиртовом растворе является одним из старых способов восстановления сложных эфиров.
Другая важная реакция восстановления, характерная именно для сложных эфиров – ацилоиновая конденсация, протекающая при нагревании сложного эфира с натриевой пылью в ксилоле. Согласно предполагаемому механизму этого превращения, ключевой стадией является димеризация анион-радикала, возникающего в результате одноэлектронного восстановления молекулы сложного эфира.
Реакции α-углеродного атома
В главе Альдегиды и кетоны было показано, что альдегиды и кетоны, имеющие α-водородные атомы, способны к образованию енолов и енолят-ионов. Это же явление имеет место в химии производных карбоновых кислот с той лишь разницей, что их СН-кислотность и равновесная концентрация енола ниже. Активность α-метиленового звена снижается примерно в той же последовательности, что и ацилирующая способность: чем меньше положительный заряд на карбонильном углероде, тем в меньшей степени поляризованы связи С-Н. Тем не менее, для производных карбоновых кислот известны некоторые важные реакции, протекающие благодаря их способности к депротонированию и енолизации.
Ангидриды кислот способны к конденсации с ароматическими альдегидами в присутствии ацетат-иона в качестве слабого основания (реакция Перкина)
Наконец, енолят-анион, генерируемый из сложного эфира под действием сильных оснований (чаще всего используют этилат натрия или магния), является ответственным интермедиатом сложноэфирной конденсации (конденсация Кляйзена). На второй стадии реакции происходит С-ацилирование аниона нейтральной молекулой сложного эфира.
Это превращение имеет важное значение, т.к. позволяет получить β-кетоэфиры – ценные полупродукты для органического синтеза. Одним из интересных соединений этого класса является этиловый эфир ацетоуксусной кислоты, чаще называемый ацетоуксусный эфир.
В случае какого гидролиза сложные эфиры омыляются необратимо
Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением
Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:
Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Реакции этерификации обратимы. В присутствии кислот сложные эфиры разлагаются водой — гидролизуются, что можно рассматривать как реакцию, обратную их получению:
В присутствии щелочей гидролиз сложных эфиров необратим, так как образующаяся кислота связывается щёлочью с образованием соли, неспособной вступать в реакцию со спиртом:
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.
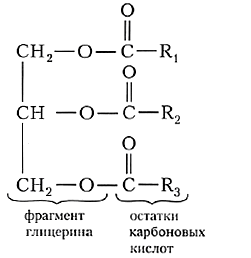
| Жиры представляют собой сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот. |
Общую формулу жиров можно представить в следующем виде:
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.
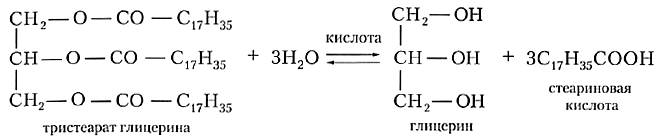
Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:
Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом:
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.
Гидролиз жиров в присутствии щелочей называют щелочным гидролизом:
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.
Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания:
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.
Справочная таблица «Сложные эфиры»
Конспект урока по химии «Сложные эфиры. Жиры». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Химические свойства сложных эфиров – формулы
Сложные эфиры являются производными карбоновых или неорганических кислот, в молекуле которых атом водорода в гидроксильной группе замещён радикалом. Такое строение обуславливает химические свойства сложных эфиров.
Сложные эфиры карбоновых кислот делятся на три общие группы:
Рис. 1. Строение молекул жиров.
Привычные в быту масла – смеси, состоящие из глицерина и остатков различных жирных кислот.
Получение
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Химические свойства
Реакция
Описание
Уравнение
Обратная реакция этерификации – расщепление в водной среде на спирт и кислоту. При нагревании с водой в кислой среде разлагаются на кислоту и спирт. Эфиры «омыляются» под действием раствора щёлочи, образуя органическую соль и спирт. В этом случае реакция необратима
При присоединении водорода сложные спирты восстанавливаются до спиртов
СН3-СОО-CH2-CH3 (этилацетат) + 2H2 → 2C2H5OH (этанол)
Реакция возможна при наличии в молекуле двойных связей. Атомы галогенов присоединяются к местам разрыва связей
СН3СООСН=СН2 (виниловый эфир уксусной кислоты) + Br2 → Br-CH2-C H(Br)-COOH-CH2
CH3-COO-CH3 (метилацетат) + NH3 → CH3-C(NH2)=O (амид уксусной кислоты) + CH3-OH (метанол)
При полном сгорании образуется углекислый газ и вода
2CH3-COO-CH3 + 7O2 → 6CO2 + 6H2O
Рис. 2. Схема омыления жиров.
Сложные эфиры применяются в качестве ароматизаторов в медицине, парфюмерии, пищевой промышленности. Они входят в состав ягод, фруктов, пчелиного воска.
Рис. 3. Эфирные масла.
Что мы узнали?
Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
Сложными эфирами называются функциональные производные карбоновых кислот обшей формулы RC(О)ОR’.
Сложные эфиры карбоновых кислот (а также сульфоновых кислот) называют аналогично солям, только вместо названия катиона употребляют название соответствующего алкила или арила, которое помещается перед названием аниона и пишется с ним слитно. Наличие сложноэфирной группы —COOR также можно отразить описательным способом, например, «R-овый эфир (такой-то) кислоты» (такой способ менее предпочтителен ввиду его громоздкости):
Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости, с приятным запахом, плохо растворимые в воде и хорошо — в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов, благодаря чему в пищевой промышленности из них готовят эссенции, имитирующие фруктовые запахи. Повышенную летучесть сложных эфиров используют в аналитических целях.
Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
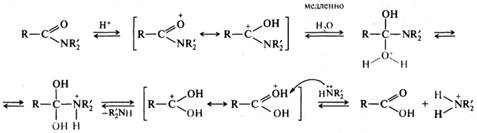
Реакция осуществляется как в кислой, так и в щелочной среде. Кислотно-катализируемый гидролиз сложных эфиров — реакция, обратная этерификации, протекает по тому же самому механизму ААС2:
Нуклеофилом в этой реакции является вода. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды.
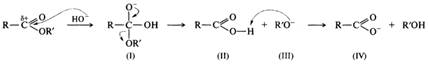
Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т. е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Гидролиз сложных эфиров в щелочной среде протекает по бимолекулярному ацильному механизму ВАС2 через стадию образования тетраэдрического интермедиата (I). Необратимость щелочного гидролиза обеспечивается практически необратимым кислотно-основным взаимодействием карбоновой кислоты (II) и алкоксид-иона (III). Образовавшийся анион карбоновой кислоты (IV) сам является довольно сильным нуклеофилом и потому не подвергается нуклеофильной атаке.
Аммонолиз сложных эфиров. Амиды получают с помощью аммонолиза сложных эфиров. Например, при действии водного аммиака на диэтилфумарат образуется полный амид фумаровой кислоты:
При аммонолизе сложных эфиров аминами с низкой нуклеофильностью последние предварительно превращают в амиды щелочных или щелочно-земельных металлов:
Амиды карбоновых кислот: номенклатура; строение амидной группы; кислотно–основные свойства; кислотный и щелочной гидролиз; расщепление гипобромитами и азотистой кислотой; дегидратация в нитрилы; химическая идентификация.
Амидами называются функциональные производные карбоновых кислот обшей формулы R—С(О)—NH2-nR’n, где п = 0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, в N-замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N,N-замещенных — двумя.
В названиях N-замещенных первичных амидов RCO—NHR’ и RCO—NR’R» (а также подобных сульфонамидов) названия радикалов R’ и R» указывают перед названием амида с символом N-:
Амиды такого типа часто называют вторичными и третичными амидами, что ИЮПАК не рекомендуется.
Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из них в качестве производных для идентификации карбоновых кислот. В редких случаях являются жидкостями, например, амиды муравьиной кислоты — формамид и N,N-диметилформамид — известные диполярные апротонные растворители. Низшие амиды хорошо растворимы в воде.
Амиды являются одними из самых устойчивых к гидролизу функциональных производных карбоновых кислот, благодаря чему широко распространены в природе. Многие амиды применяются в качестве лекарственных средств. Уже около века используются в медицинской практике парацетамол и фенацетин, являющиеся замещенными амидами уксусной кислоты.
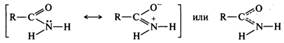
Строение амидов. Электронное строение амидной группы в значительной степени сходно со строением карбоксильной группы. Амидная группа является p,π-сопряженной системой, в которой неподеленная пара электронов атома азота сопряжена с электронами π-связи С=O. Делокализация электронной плотности в амидной группе может быть представлена двумя резонансными структурами:
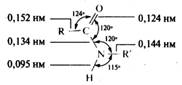
За счет сопряжения связь С—N в амидах имеет частичнодвоесвязанный характер, длина ее существенно меньше длины одинарной связи в аминах, тогда как связь С=O несколько длиннее, чем связь С=O в альдегидах и кетонах. Амидная группа из-за сопряжения имеет плоскую конфигурацию. Ниже приведены геометрические параметры молекулы N-замещенного амида, установленные с помощью рентгеноструктурного анализа:
Важным следствием частично двоесвязанного характера связи С—N является довольно высокий энергетический барьер вращения вокруг этой связи, например, для диметилформамида он составляет 88 кДж/моль. По этой причине амиды, имеющие у атома азота разные заместители, могут существовать в виде π-диастереомеров. N-Замещенные амиды существуют преимущественно в виде Z-изомеров:
В случае N,N-дизамещенных амидов соотношение Е- и Z-изомеров зависит от объема радикалов, соединенных с атомом азота. Стереоизомеры амидов конфигурационно неустойчивы, их существование доказано в основном физико-химическими методами, в индивидуальном виде они выделялись лишь в отдельных случаях. Это связано с тем, что барьер вращения для амидов все-таки не такой высокий, как у алкенов, у которых он составляет 165 кДж/моль.
Незамещенные и N-замещенные амиды проявляют слабые NH-кислотные свойства, сравнимые с кислотностью спиртов и отщепляют протон только в реакциях с сильными основаниями.
Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров. Преобладание того или иного типа определяется строением амида. Например, N-метилацетамид, для которого предпочтительна Z-конфигурация, образует линейный ассоциат, а лактамы, имеющие жестко зафиксированную E-конфигурацию, образуют димеры:
N, N-Дизамещенные амиды образуют димеры за счет диполь-дипольного взаимодействия 2х полярных молекул:
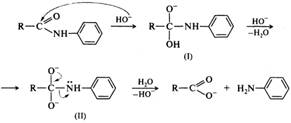
Кислотный гидролиз амидов — необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
В большинстве случаев кислотный гидролиз амидов протекает по механизму бимолекулярного кислотного ацилирования ААС2, т. е. похож на механизм кислотного гидролиза сложных эфиров. Необратимость реакции обусловлена тем, что аммиак или амин в кислой среде превращаются в ион аммония, не обладающий нуклеофильными свойствами:
Щелочной гидролиз тоже необратимая реакция; в результате ее образуются соль карбоновой кислоты и аммиак или амин:
Для анилидов и других амидов с электроноакцепторными заместителями у атома азота распад тетраэдрического интермедиата (I) может проходить через образование дианиона (II):
Расщепление азотистой кислотой. При взаимодействии с азотистой кислотой и другими нитрозирующими агентами амиды превращаются в соответствующие карбоновые кислоты с выходами до 90%:
Дегидратация. Незамещенные амиды под действием оксида фосфора(V) и некоторых других реагентов (РОС13, РС15, SOCl2) превращаются в нитрилы:
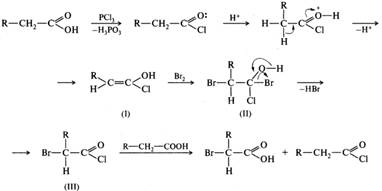
47. Карбоновые кислоты: галогенирование по Геллю-Фольгарду-Зелинскому, использование реакции для синтезаa-гидрокси иa-аминокислот.
Галогенирование алифатических карбоновых кислот.
Алифатические карбоновые кислоты галогенируются в α-положение хлором или бромом в присутствии каталитических количеств красного фосфора или галогенидов фосфора (реакция Гелля-Фольгарда-Зелинского). Например, при бромировании гексановой кислоты в присутствии красного фосфора или хлорида фосфора(III) с высоким выходом образуется 2-бромогексановая кислота, например:
Бромированию подвергается не сама карбоновая кислота, а образующийся из нее in situ хлорангидрид. Хлорангидрид обладает более сильными, чем карбоновая кислота, СН-кислотными свойствами и легче образует енольную форму.
Енол (I) присоединяет бром с образованием галогенопроизводного (II), которое в дальнейшем отщепляет галогеноводород и превращается в α-галогенозамещенный галогенангидрид (III). На последнем этапе происходит регенерирование галогенангидрида незамещенной карбоновой кислоты.
Из образующихся α-галогенозамещенных кислот с помощью реакций нуклеофильного замещения синтезируют другие гетерофункциональные кислоты.