в течение какого периода времени происходит процесс ремоделирования костной ткани
Что такое ремоделирование и как этот процесс влияет на приживление имплантов
Ремоделирование кости — это образование новой костной ткани, обновление её губчатого слоя, которое протекает как после повреждений, так и самопроизвольно с некоторой периодичностью.
В имплантологии этот процесс неразрывно связан с условиями установки конструкций и прикладываемой после их приживления нагрузкой. Процесс ремоделирования можно считать одним из механизмов приспособления тканей организма к нагрузкам.
Как происходит ремоделирование кости
Процесс ремоделирования кости являет собой последовательную резорбцию (уменьшение объёма, растворение) костной ткани с образованием новой прочной костной матрицы на месте пустот. Активация действия остеокластов при отсутствии воспалений, генетических, эндокринных и других патологий происходит за счёт действия специфических веществ, которые запускают процесс обновления костной ткани с такой периодичностью, чтобы в год заменялось 4–6% всей массы скелета организма.
При удалении зуба, а также при вживлении инородного тела в губчатую или кортикальную кость процессы моделирования запускаются воспалением, которое стимулирует расщепление костной ткани.
После удаления зуба скорость резорбции альвеолярного гребня значительно превышает скорость образования новой опорной ткани за счёт работы остеобластов. С целью ускорения процесса ремоделирования и сохранения объёма кости многие стоматологи рекомендуют заполнять образовавшуюся лунку специальным остеогенным биоматериалом.
Имплантация после удаления зуба и влияние ремоделирования
При необходимости удаления зуба с последующей имплантацией существует два варианта распределения сроков операций: с отсроченным вживлением опорного импланта или одномоментным проведением удаления и установки искусственных корней. Каждый из вариантов имеет свои показания к применению, преимущества и недостатки.
К примеру, при немедленной имплантации высока вероятность успешного приживления, т. к. процесс ремоделирования активнее проходит под действием прикладываемой нагрузки. Однако далеко не всегда возможно одновременное проведение этих двух операций: обострение периодонтита и наличие очага инфекции, которые и обуславливают необходимость удаления жевательной единицы, резко повышают риски отторжения имплантов или формирования хрупкой и рыхлой кости вокруг металлической конструкции.
С другой стороны, отсроченная имплантация практически гарантирует ускоренную атрофию челюстной кости, которая протекает не только из-за отсутствия нагрузок и скудного кровоснабжения участка, но и из-за активного действия остеокластов, которые реагируют на воспаление лунки.
В значительной мере на процесс ремоделирования костной ткани после вживления (вне зависимости от протокола проведения) влияет конфигурация имплантов, качество и активность их поверхности. Распределение плотности образованной новой кости более равномерно при коротком искусственном корне, а на соотношение скорости роста и убыли ткани зависит от формы и, непосредственно, от площади поверхности контакта имплантат-кость.
Стоматологи клиники доктора Кизима проводят как одномоментные, так и отсроченные имплантации, минимизируя риски для пациентов благодаря использованию современных имплантов, тщательной санации очагов инфекции и аккуратной работе при вживлении конструкций. Опыт работы в сфере базальной имплантации, регулярное повышение квалификации и использование новейшего оборудования позволяет предоставлять клиентам медицинские услуги на уровне европейских клиник.
В течение какого периода времени происходит процесс ремоделирования костной ткани
РЕМОДЕЛИРОВАНИЕ КОСТНОЙ ТКАНИ
Ремоделирование — это сопряженные во времени процессы локальной резорбции и формирования кости в небольших блоках посредством базисной мультиклеточной единицы, функцией которой является поддержание скелетного баланса.
Сопряжение во времени процессов ремоделирования достигается за счет механизма, в основе которого лежит взаимное влияние всех клеток посредством локальных сигналов факторов роста и других цитокинов.
Ремоделирование компактного и губчатого вещества кости рассматривается с позиции функционирования базисных многоклеточных единиц (БМЕ, Basic Multicellular Unit (BMU)) или костных ремоделирующих единиц (Bone Remodeling Unit (BRU)). БМЕ формируются в локусе перестройки костной ткани и представляют собой группу из согласованно функционирующих клеток, которые называют также «преобразующими блоками» или «обособленными ремоделирующими пакетами».
В организме взрослого человека одновременно функционируют 100 000-10000 000 БМЕ. Ремоделирование костной ткани осуществляется в соответствии с действующими на кость нагрузками. Ежегодно обновляется около 4-10% общего объема костной массы. Этот процесс регулируется количеством и активностью костных клеток (табл.1)
Таблица.1. Типы костных клеток и их участие в процессе ремоделирования
| Тип клеток | Функция |
| Покровные клетки | Активация, покой |
| Остеокласты | Резорбция |
| Остеобласты | Формирование |
| Остеоциты | Формирование (минерализация), покой |
Процесс ремоделирования костной ткани происходит в несколько фаз [активации, резорбции, реверсии, формирования (остеогенеза)], в каждую из которых ведущую роль выполняют те или иные клетки. Остеокласты и остеобласты вовлечены в процесс ремоделирования кости, остеоциты и покровные клетки участвуют в обменных процессах, обеспечивая питание кости и сохранение кальциевого гомеостаза.
В последующем наступает реверсионная фаза, когда возникшие лакуны заполняются предшественниками, дифференцирующимися в остеобласты («клетки-строители»). Начинается синтез костных протеинов, формирование органического матрикса кости, после чего минерализация, в соответствии с новыми условиями статической и динамической нагрузки на кость, завершает цикл ремоделирования. Остеобласты остаются внутри костного матрикса, превращаясь в остеоциты. Остеобласты, оставшиеся на поверхности вновь сформированной кости, дифференцируются в покровные клетки.
Такие циклы возникают примерно 1 раз в 2-3 года в каждой единице костного ремоделирования (остеоне) как трабекулярных, так и кортикальных костей и длятся соответственно около 100 и 200 дней.
Факторы, влияющие на ремоделирование костной ткани
Системные, локальные и другие факторы могут оказывать как стимулирующее, так и ингибирующее влияние на остеобласты и остеокласты.
Все локальные факторы, за исключением простагландина, имеют белковую природу и синтезированы различными типами клеток, имеющими мезенхимное происхождение. Они могут осуществлять местное воздействие на костную ткань, выступая в качестве аутокринных и/или паракринных регуляторов.
Таким образом, ремоделирование костной ткани — это сложный, сопряженный, интегральный процесс поддержания баланса между резорбцией и образованием. Сопряженность процесса предполагает, что количество резорбированной костной массы замещается эквивалентным количеством новой ткани.
Рассогласование в процессах ремоделирования происходит с возрастом и характеризуется постепенным преобладанием процессов резорбции над процессами образования костной ткани, что рассматривается как естественный процесс у женщин в возрасте около 40 лет. Отрицательный баланс кости составляет 0,5-1% ежегодно и носит название «связанной с возрастом остеопении». С наступлением менопаузы в течение 5-7 лет потеря костной массы возрастает.
По интенсивности обменных процессов в костной ткани различают остеопороз с высоким, низким или нормальным уровнем интенсивности ремоделирования.
Соответственно различают женщин, «нормально», «быстро» или «медленно» теряющих костную массу в постменопаузе. Женщины, «нормально» теряющие костную массу, составляют около 75%, у них потеря костного вещества составляет 1-2% в год. Группу «быстро» теряющих составляют около 25% женщин, у них потеря костного вещества может быть до 6% в год. К этой группе относится большинство молодых женщин после овариэктомии.
В течение какого периода времени происходит процесс ремоделирования костной ткани
Особенности метаболизма, клинико-молекулярные механизмы ремоделирования костной ткани и регуляция этих процессов в последние годы привлекает пристальное внимание. Это связано с тем, что остеопороз в начале ХХІ столетия стал одним из наиболее распространенных заболеваний, наряду с онкологическими процессами, сахарным диабетом и сердечно-сосудистой патологией, занимает ведущее место в структуре заболеваемости и смертности населения [17]. В Германии (82 млн. жителей) остеопорозом (ОП) страдает до 7,8 млн. жителей страны старше 50-ти лет [16]. В России количество больных ОП составляет около 14 млн. человек [22]. Частота выявления ОП в Европе у женщин достигает 36 %, у мужчин – 26,4 % [14]. Клиническими последствиями остеопороза являются переломы позвонков, трубчатых костей, ребер. В России каждые 5 минут происходит перелом шейки бедра, вызванный ОП, а в течение года в стране происходит 9 млн. переломов периферического скелета и более 3 млн. переломов позвонков [5]. Перелом проксимального отдела бедра является причиной смерти 14-49 % пациентов в течение первого года после травмы, и этот показатель значительно выше у мужчин, чем у женщин [2,14]. Половина больных, выживших после перелома бедра, нуждается в постоянном длительном уходе из-за снижения качества жизни. Важной медицинской проблемой является остеопенический синдром, развивающийся вследствие других заболеваний: эндокринных, ревматологических, онкологических, болезней органов пищеварения, почек, легких, как осложнения при приеме некоторых медикаментозных средств: иммунодепрессантов, глюкокортикостероидов, тиреоидных гормонов и др. [7]. Значительное распространение ОП и остеопоротических переломов среди населения, тяжесть исходов, существенные затраты на лечение и реабилитацию больных отражают высокую социальную значимость заболевания.
Кость – специализированная соединительная ткань, содержащая минерализованную внеклеточную фазу, которая позволяет выполнять опорные и метаболические функции. Основными клетками костной ткани являются остеоциты, остеобласты и остеокласты. Клетки костной ткани характеризуются высокой метаболической активностью и имеют четкое разделение функций. Особенностью метаболизма костной ткани является ее перестройка на протяжении всей жизни, поскольку в отличие от других тканей кость обновляется не только заменой «старых» макромолекул вновь синтезируемыми, но реформируется и на морфологическом уровне. Перестройка костной ткани характеризуется двумя понятиями: моделированием и ремоделированием.
Моделирование определяет характерную форму микроструктуры кости в процессе ее роста, восстанавливает кость при переломах, перестраивая костную мозоль и адаптируя ее при заживлении. Активация процессов моделирования осуществляется под влиянием метаболических и механических факторов и сводится к пространственной координации процессов резорбции и формирования кости, происходящих одновременно в различных участках ткани.
Процесс ремоделирования заключается в полном разрушении точечных участков кости (резорбции) и заполнении возникающих дефектов новообразованной костью (костеобразование). Оба эти процесса тесно взаимосвязаны и являются результатом клеточного взаимодействия остеокластов (ОК) и остеобластов (ОБ). В детском и юношеском возрасте превалирует остеогенез и костная масса возрастает на 8 % в год. После 40 лет процесс резорбции начинает преобладать над костеобразованием, в результате масса и прочность кости постепенно снижаются. У взрослого человека результаты ремоделирования сбалансированы и это позволяет сохранять постоянство массы кости. В кортикальной кости костный обмен протекает в более медленном темпе, в трабекулярной кости – более интенсивно. В трубчатых костях ремоделирование осуществляется на трех поверхностях: периостальной, эндоостальной, к которой относится и поверхность губчатого вещества и в системе гаверсовых каналов, а в теле позвонка – только на периостальной и эндостальной. На поверхности периоста в течение всей жизни сохраняется положительный баланс перестройки, на поверхности гаверсовых каналов перестройка уравновешена, а на эндостальной поверхности доминирует отрицательный баланс. Это обуславливает истончение кортикального слоя и рарефекацию губчатой кости.
В процессе ремоделирования участвуют ОК, ОБ, остеоциты, активные мезенхимальные клетки. ОБ – берут начало от мезенхимальных стволовых клеток, ОК – от макрофагально-моноцитарных клеток костного мозга. ОБ – мононуклеарная клетка, обеспечивающая процесс остеогенеза, характеризуется развитыми субклеточными структурами, отвечающими за биосинтетические процессы, и обилием митохондрий. По мере образования компонентов остеоида и минерализации вокруг себя ОБ снижают биосинтетические процессы и трансформируются в остеоциты. ОК – гигантская многоядерная клетка, осуществляющая резорбцию, т.е. рассасывание костной ткани, действуя только на минерализованную кость. ОК отличаются высокой концентрацией лизосом, содержащих набор кислых гидролаз, участвующих в расщеплении макромолекул остеоида, характеризуются высокой активностью Н+-АТФ-азы, карбоангидразы, а также способностью выделять в среду изофермент кислой фосфатазы, не ингибирующейся при действии тартрата. Остеоциты, ОБ, преостеобласты продуцируют молекулы внеклеточного матрикса; адгезивные молекулы на поверхности клеток, обеспечивающие контакты межклеточные и с молекулами внеклеточного матрикса; ростовые факторы и их антагонисты, регулирующие обновление и дифференцировку клеток.
Внеклеточный матрикс кости по белковому составу близок к собственно соединительной ткани. Его фибриллярные структуры примерно на 90 % состоят из коллагена І типа, содержит минорные коллагены V и XII типов. Коллагены придают прочность, эластичность костной ткани, поддерживают адгезию, пролиферацию и дифференциацию клеток с остеобластным фенотипом, участвуют в процессах минерализации и др. Коллаген V типа связывается с протеогликанами (особенно гепарансульфатными), а также молекулами тромбоспондина и других белков межклеточного матрикса. Коллаген XII типа также ассоциируется с протеогликанами (особенно хондротинсульфатными), имеет участки подобия к фибронектину, содержит несколько центров связывания с клетками (последовательность Арг-Гли—Асп), участвует в функционально-структурном единении межклеточных структур с клеточными элементами кости, опосредуя прикрепление клеток к волокнам коллагенов типа І и V, и взаимодействует с неколлагеновыми протеинами [6].
Костный матрикс содержит большое разнообразие неколлагеновых белков, представленные гликопротеинами, фосфопротеинами и протеогликанами. Среди них остеокальцин, фибронектин, остеопонтин, ламинин, виментин, костный сиалопротеин II, матриксный Gla-протеин, остеопонтин, декорин, диглан и др. Одни из них являются адгезивными белками (фибронектин, ламинин, остеонектин), другие выполняют специфические функции: остеокальцин – кальций связывающий и кальций транспортирующий белок, прочно связанный с гидроксиопатитом и участвующий в реализации кальциевых эффектов Д-гормона; костный сиалопротеин II, остеопонтин – основные нуклеаторы в процессе минерализации внеклеточного матрикса; остеонектин и матриксный Gla-протеин-регуляторы минерализации костного матрикса [6].
Дифференцированный ОК занимает определенное положение на поверхности клетки и конструирует специализированный цитоскелет, позволяющий ему создать изолированную полость резорбции – микросреду между костью и ОК. При активации ОК экспрессируются avb интегрины – адгезивные трансмембранные рецепторы клеточной поверхности, вступающие во взаимодействие с коллагеном І типа, остеопонтином, сиалопротеином и другими белками внеклеточного матрикса, содержащими центр связывания с клетками (Арг-Гли-Асп последовательности). При этом интегриновый рецептор индуцирует в цитоплазме ОК повышение уровня Са2+ и рН, а также фосфорилирование ряда протеинов по тирозину, которые контролируют контакт ОК с внеклеточным матриксом. Особую роль среди них играет тирозиновая протеинкиназа, сопряженная с цитоплазматическим доменом β-субъединицы интегрина. Последующее фосфорилирование по тирозину ряда цитоплазматических белков ОК включает цепь последовательной передачи сигналов другим молекулам: G-протеинам, цитоплазматическим протеинкиназам и транскрипционным факторам клеточного ядра с экспрессией генов ОК, ответственным за продукцию компонентов резорбирующей активности клетки [8].
Для дифференциации преостеобластов в зрелые ОБ необходимо участие транскрипционного фактора Osterix/Sp7, так же как и RUNX-2. Osterix/Sp7 вызывает экспрессию генов коллагена типа І, костного сиалопротеина, остеопонтина, остеонектина, остеокальцина. Osterix/Sp7 экспрессируется под влиянием гена Dlx 5, активируемого ВМР-2. Dlx 5 может также активировать и экспрессию RUNX-2. Dlx 5 является ключевым белком созревания ОБ [12].
Остеогенную дифференциацию снижают транскрипционные факторы Twist, способные угнетать связывание с ДНК и активацию гена RUNX-2 в предшественниках ОБ [18]. NF-kB регулируют большую группу генов, участвующих в клеточном росте и клеточной адгезии. При остеогенезе транскрипционный фактор NF-kB снижает дифференциацию ОБ, контролируя kB участки промотора гена RUNX-2 [3].
В формировании костного скелета, в регуляции остеобластогенеза и функции ОБ важную роль играет канонический винглес-бета-катенин (Wnt/β-catenin) сигнальный путь [1,21]. Во время остеогенной дифференцировки в клетках резко увеличивается ряд лигандов Wnt (Wnt-2,4,5,11,16) с тропным к ним Frizzled-рецепторным комплексом (трансмембранный белок Frizzled) и сопряженные с ним ко-рецепторы липопротеиннов низкой плотности (LRP 5 и 6). Активация Wnt рецепторного комплекса приводит к усилению функции белка Disheveled, который ингибирует связанные с ним протеины GSK-3, APC и AXIN. Снижение активности киназы гликогенсинтетазы-3 (GSK-3) стабилизирует β-катенин, способствует его накоплению в цитоплазме и транслокации в ядро клетки, где β-катенин вступает во взаимодействие с транскрипционными факторами TCF/LEF/RUNX 2 (TCF – фактор внутриядерной транскрипции генов, LEF – лимфоидный фактор, повышающий процесс связывания внутриядерных компонентов) и регулирует экспрессию генов, ответственных за стимуляцию регенерации костной ткани, включая синтез циклина Д1, обеспечивающего продвижение клетки по клеточному циклу. Без активации Wnt корецепторов LRP 5 и LRP 6 β-катенин быстро разрушается. Wnt-лиганды взаимодействуют с TCF-β, потенцируют остеогенные эффекты ВМР-2. Экспрессию TGF-β и ВМР-2 в остеобластах, усиливают действие фактора роста фибробластов-2,-9, вызывая синергичный эффект [3].
При интенсивном образовании кости наблюдается увеличение в плазме крови паратиреоидного (ПТГ), соматропного (СТГ) гормонов и кальцитриола. СТГ активирует синтез инсулиноподобного фактора роста (IGP-1), протеогликанов и коллагенов в костной ткани, кальцийтриол – ее минерализацию [11]. Синтез IGP-1 в ОБ контролирует также ПТГ, который уменьшает старение и апоптоз ОБ, индуцирует угнетение экспрессии белков-ингибиторов циклин – зависимых киназ – Р21 и Р16, поддерживает дифференциацию остеогенных клеток [10].
Механическая активация остеогенных клеток связана с напряжением физической связи β1-интегринов преостеобластов, ОБ с белками внеклеточного матрикса (коллаген, ламинин, фибронектин и др.), восприятием напряжения внутриклеточными актином и миозином, с включением сигнальной передачи к ядру клетки, вызывая экспрессию транскрипционного фактора с –Fos и рост продукции IGP-1, интерлейкина – 8, простагландинов, стимулирующих остеогенез [3].
Стадия формирования кости связана с биосинтетической функцией ОБ, секретирующие во внеклеточное пространство коллагены, неколлагеновые белки, ферменты и формирующие остеоид, который через 10-15 суток при активном участии ОБ начинает минерализовываться [6]. Каждый ОБ синтезирует и наращивает вокруг себя новый костный матрикс, минерализует его и превращается в остеоцит с отростками в системе канальцев, связывающим его с соседними клетками. Совокупность остеоцитов, отростки которых по костным каналам проникают в окружающие их костные пластинки, образует единую сеть в кости. Каждый остеоцит контактирует с соседними клетками и неактивными ОБ. Благодаря этому, поверхность обмена кости очень велика – 10 см3 кости имеет поверхность до 330 м2 [6].
Длительность цикла ремоделирования колеблется от 6 до 9 месяцев. Скорость обмена скелета в год составляет около 10 %, при этом скорость обмена кортикальной кости (85 % скелета) – 4 %, трабекулярной кости (15 % скелета) – 28 % в год [4]. Ремоделирование, во-первых, позволяет изменить объем, форму и плотность кости, максимально соответствуя существующим нагрузкам, поддерживая, корректируя и обновляя микроархитектонику ткани; во-вторых, является частью системы, обеспечивающей кругооборот некоторых важнейших минеральных соединений – Ca, Mg, P и др. в организме и сохранения их оптимальной концентрации в биологических средах.
Заключая обзор, можно резюмировать, что формирование, рост, развитие, ремоделирование, функционирование и метаболизм костной ткани осуществляется сложным взаимодействием костных клеток и нескольких групп регуляторов, включающих локальные факторы, в том числе продуцирующие самими костными клетками: TGF- β, простагландины, интерлейкины, ВМР и др.; системные ростовые факторы: макрофагальный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, инсулиноподобные факторы роста, фибробластный фактор роста и др.; кальций регулирующие гормоны – ПТГ, кальцитонин, кальцитриол; другие системные гормоны: СТГ, инсулин, глюкокортикоиды, йодированные тиронины, глюкокортикоиды, половые. Факторы роста, цитокины, молекулы адгезии, синтезируемые в костном мозге и костных клетках, обеспечивают взаимодействие между клетками и матриксом кости, между самими клетками, опосредуют эффекты механических сдвигов, эффекты системных гормонов.
Рецензенты:
Бутолин Е.Г., д.м.н., профессор, заведующий кафедрой биологической химии ГБОУ ВПО «Ижевская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Ижевск;
Лунева С.Н., д.б.н., профессор, руководитель научно-клинического диагностического отдела ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. ак. Г.А. Илизарова» МЗ РФ, г. Курган.
Остеоконденсация: биологическое обоснование и клиническое применение
Остеоциты и мезенхимальные клетки кости (МКК) играют ключевую роль в процессе костного ремоделирования. По своей функции остеоциты являются клетками, которые являются чувствительными к механическим стимулам, и которые принимают участие в формировании костной ткани наряду с остеобластами и остеокластами. При этом остеобласты развиваются из мезенхимальных клеток и отвечают за синтез костного матрикса, а остеокласты дифференцируют из многоядерных клеток моноцитарно-макрофагальной линии. Мезенхимальные, или как еще их называют выстилающие клетки костной ткани отвечают за формирование костной ткани на новых костных поверхностях, и характеризуются плоскостной внешней архитектурой.
Результаты проведенных исследований указывают на то, что индукция процесса пролиферации мезенхимальных клеток костной ткани перед началом ее непосредственного формирования осуществляется за счет влияния факторов роста, цитокинов и других остеогенных «сигналов». К последним можно отнести действие паратиреоидного гормона, костного морфогенетического протеина, фактора роста фибробластов-2, а также непосредственную механическую нагрузку. В ходе влияния всех вышеперечисленных факторов МКК выходят из состояния покоя и вступают в активную функциональную фазу. Гистологически подтверждение присутствия МКК на поверхности костной ткани или костного заменителя указывает на выраженный остеогенный потенциал и может служить критерием прогноза интеграции используемого в структуре кости материала.
Нагрузка и резорбция костной ткани
Остеоциты и МКК вместе формируют рабочую коммуникационную систему, которая принимает участие в регулировании механорецептивной функции. Остеоциты, «чувствуя» небольшое увеличение со стороны поступающих механически индуцированных сигналов (которые формируются при нагрузке на участок костной ткани), сигнализируют МКК о необходимости увеличения образования кости и ингибирования процесса ее резорбции. И наоборот, при дефиците необходимой механической нагрузки, в кости наблюдается феномен отсутствия необходимого функционального напряжения, что, в свою очередь, провоцирует потерю костной ткани. В случаях чрезмерного уровня приложенной нагрузки или при микроразрушениях структуры кости отмечается более выраженный апоптоз остеоцитов. Как правило, данный феномен наблюдается вблизи поверхности кортикального слоя, на который действует высокое механическое напряжение, поскольку именно данная часть кости является более чувствительной к механическим перенагрузкам по сравнению с трабекулярной составляющей. Понимание данной теории является крайне важным для клинической практики, учитывая, что процесс остеоконденсанции (остеоденсификация, уплотнения костной ткани) предусматривает развитие крайне высоких напряжений именно в кортикальном слое, что, в свою очередь, может спровоцировать апоптоз остеоцитов и последующую потерю костной ткани.
Ремоделирование кости вокруг дентальных имплантатов
После установки дентальных имплантатов вскоре вокруг них начинает развиваться имунно-воспалительная реакция, предусматривающая реализацию ангиогенных и остеогенных процессов. Элементы данной реакции зависят от характеристик поверхности самого имплантатов (топографии, химической составляющей и структуры материала), которые могут способствовать или же ингибировать адсорбцию соответствующих белков. Тромбин и фибриноген, адсорбируясь на поверхности внутрикостной опоры, играют ключевую роль в достижении гомеостаза периимплантатной области, после чего выделение соответствующих цитокинов и факторов роста стимулирует депозицию коллагенового матрикса вокруг слоя титана оксида, находящегося на поверхности винта. Все это в конце концов приводит к формированию новой костной ткани (обычно происходит на протяжении 5 дней). В течение 8-12 недель пластинчатая кость инициирует развитие такого феномена как биологическая стабильность, что также именуется остеоинтеграцией.
Впоследствии, как и в случае естественного зубного ряда, имплантаты подвергаются ремоделированию мягких и твердых тканей с формированием параметра биологической ширины на уровне 3,5 мм. Многие исследования при этом указывают на то, что наличие микрозазора между двумя компонентами имплантологической системы провоцирует более выраженную потерю костной ткани. Интерфейс соединения между абатментом и имплантатом характеризуется наличием микропространства в диапазоне от 10 до 50 микрон, что приводит к развитию эффекта помпы. Под действием последнего интерфейс соединения контаминируется жидкостью полости рта, содержащей как грамположительные, так и грамотрицательные бактерии. Именно из-за этого внутреннее соединение в структуре имплантологической системы является более предпочтительным, чем внешнее. Кроме того, особый интерес представляет собой принцип переключения платформ, который позволяет корригировать параметры биологической ширины.
Значительное количество исследований было посвящено аспектам оптимизации дизайна имплантата для улучшения его стабильности и/или качества остеоинтеграции, а также для минимизации уровня потери маргинальной костной ткани. Однако при этом совсем мало внимания уделялось возможностям оптимизации самой области имплантации в процессе выполнения остеотомии. В данной статье мы рассмотрим аспекты влияния исходной плотности костной ткани на первичную стабильность имплантата, а также хирургические концепции приема остеоконденсации как метода, позволяющего улучшить первичную стабильность имплантата путем уплотнения доступной аутогенной костной ткани.
Влияние исходного качества кости на параметры остеоинтеграции и торка имплантата
Торк имплантата (ТИ) в диапазоне от 25 Нсм до 45 Нсм рассматривается как идеальное значение в ходе его установки для профилактики развития микродвижений внутрикостной конструкции, которые могут привести к формированию фиброзной капсулы вокруг опоры. При этом, однако, слишком высокие показатели ТИ были ассоциированы с критическим давлением на костную ткань, что может привести к развитию микропереломов и некрозу костной ткани. На изучаемых животных моделях уже неоднократно было доказано, что высокие показатели ТИ провоцируют комплексное микроразрушение кости и запускают процесс комплексного ремоделирования. Следует заметить, что резорбция кортикальной костной ткани развивается более часто, чем трабекулярной, что может быть связано с ее низкой васкуляризацией. Данные результаты исследования полностью коррелируют с теми, что были получены в ходе изучения влияния показателей торка больше 50 Н*см на костную ткань челюстей у человека: в таких условиях отмечается более выраженная потеря периимплантатной костной ткани еще на ранних стадиях ее заживления. Недавно проведенный комплексный анализ также позволил обнаружить, что «недопрепарирование» участка остеотомии для достижения более высоких показателей исходного торка провоцирует апоптоз двойного слоя остеоцитов по сравнению с ситуациями, в которых исходный ТИ был значительно ниже.
Таким образом, можно резюмировать, что дефицит первичной стабильности имплантата в целом может компрометировать процесс остеоинтеграции, однако слишком высокие показатели ТИ негативно влияют на поддержку необходимого уровня периимплантатной костной ткани. Не менее важным фактором, который влияет на исход установки имплантата, является исходная плотность альвеолярной кости и ее связь с показателями первичной стабильности. В своих ранних работах Misch классифицировал все возможные варианты альвеолярного костного гребня на 4 типа. Согласно этой классификации, более плотная костная ткань локализируется в переднем участке нижней челюсти, в то время как наиболее пористая – в дистальных участках верхней челюсти. Логично, что чем больший слой кортикальной кости, тем более сильную поддержку имплантата она обеспечивает, что, в свою очередь, позволяет достичь более высоких показателей первичной стабильности. Однако, кортикальная составляющая кости также характеризуется и меньшим уровнем васкуляризации, что, в свою очередь, снижает ее ангиогенный потенциал и снижает возможности для миграции остеогенных клеток в область имплантации. В конечном счете, все это может привести к более выраженной потере уровня костной ткани в периимплантатной области.
Simons и соавторы провели исследование, в котором изучили влияние исходного соотношения кортикальной и губчатой костной ткани на характер потери кости в периимплантатной области. Они обнаружили, что при наличии 50-60% губчатой кости удаётся минимизировать раннюю редукцию уровня периимплантатного костного гребня до 0,6-0,7 мм, в то же время превалирование кортикальной кости в области имплантации провоцирует убыль уровня окружающего костного гребня до 1,5 мм. По этой причине при выраженно толстом слое кортикальной кости исходные параметры ТИ все же лучше минимизировать. Также для того, чтобы свести показатели редукции костного гребня к минимальным, авторы рекомендуют проводить конденсацию участка остеотомии при наличии толстой кортикальной пластинки, таким образом, обеспечивая редукцию исходных параметров торка.
Таким образом, можно резюмировать, что кортикальная кость характеризуется наличием определенных недостатков по сравнению с трабекулярной, что выражается в ограниченном кровоснабжении и сниженном количестве присутствующих остеопрогениторных клеток. Кроме того, кортикальная кость также характеризуется повышенной чувствительностью к высоким напряжениям, иными словами – она является более механически чувствительной. Исходя из этого, становиться понятным почему апоптоз остеоцитов более часто регистрируется именно в области кортикального слоя в случаях микроразрушений кости и действия на нее высоких функциональных напряжений. Понимая влияние данных факторов, врач должен учитывать исходное состояние качества костной ткани в области остеотомии, для того чтобы обеспечить профилактику потенциально возможных имплантат-ассоциированных осложнений.
Немедленная имплантация с достижением высоких и низких показателей торка
Ряд клинических исследований долгое время изучали гипотезу о том, что более высокие показатели первичной стабильности ассоциированы с лучшими параметрами остеоинтеграции. В случаях немедленной имплантации достижение высоких параметров торка, превышающих 32 Нсм, является обязательным. При этом показатели торка, превышающие 50 Нсм при немедленной установке имплантатов, провоцировали более выраженную потерю костного гребня, особенно с вестибулярной стороны, а также развитие рецессий в области имплантации. При экстремально высоком торке (более 70 Нсм) потеря окружающей костной ткани была клинически выраженной и часто негативно влияла на конечный исход реабилитации. С другой стороны, слишком низкие показатели торка также были связаны с повышением частоты неудач после установки внутрикостных титановых опор. Таким образом, полученные результаты указывают на наличие прямой связи между исходными показателями торка и уровнем потери периимплантатной костной ткани.
Процедура конденсации костной ткани с помощью остеотомической техники, позволяющая улучшить первичную стабильность имплантатов и костное заживление в области вмешательства, была впервые описана Summers уже около 20 лет назад. Büchter и Stavropoulos, однако, отметили, что к данной технике следует относится с огромной осторожностью, поскольку данный подход при неадекватном использовании может привести к развитию микропереломов в структуре костной ткани, окружающей имплантат. На протяжении многих лет исследователи старались сгруппировать все возможные варианты реализации техники остеоконденсации в определенные практические рекомендации. Так, например, появилась концепция установки имплантата более широкого диаметра, чем последнее используемое остеотомическое сверло, что позволяет повысить исходные показатели торка. В подобных случаях врачам удаётся добиться адекватной вторичной стабильности и плотного контакта имплантата с окружающей костью, хотя сам процесс заживления кости происходил более медленно, учитывая развитие очагов микронекроза. Другие исследователи показали, что установка имплантатов с торком равным 0, позволяет добиться таких же успешных отдаленных результатов через 4 месяца, как и при установке имплантатов с торком в 30 Нсм или 70 Нсм. Учитывая разнообразность, полученных в ходе разных исследований данных, можно только резюмировать, что роль высоких показателей ТИ на уровень резорбции костной ткани в периимплантатной области остается не до конца изученной.
Остеоконденсация
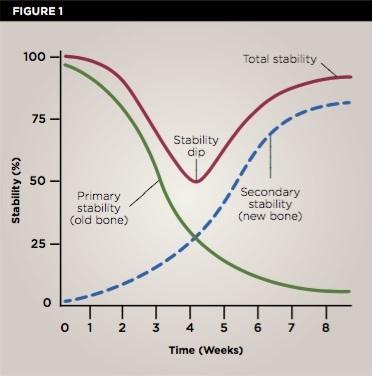
Биомеханическая стабильность имплантатов обычно зависит от нескольких факторов. Во-первых, от макро- и микродизайна самих интраоссальных конструкций, а также от качества и количества костной ткани в области вмешательства – все эти факторы непосредственно влияют на первичную стабильность имплантатов (фото 1).
Фото 1. Классическая диаграмма графиков стабильности имплантатов. Самые высокие показатели первичной стабильности регистрируются на первой неделе после установки имплантатов, далее на 4 неделе отмечается снижение стабильности, после чего начинает развиваться механизм вторичной стабильности. Многие клиницисты стараются оптимизировать показатели стабильности в особенно критический период 4 недель за счет модификации протоколов установки имплантатов, их поверхностей, изменения макро- и микродизайна.
Протоколы, направленные на повышение параметров первичной стабильности имплантатов, предусматривают возможную реализацию следующих принципов:
Костная ткань человека характеризуется способностью поглощать энергию, то есть она является гибкой, но при этом она также может изменять свою форму в процессе деформации без сколов или переломов. Также кость может противостоять компрессии, несколько расширяясь под ее действием и удлиняясь во время напряжения.
Традиционно перед установкой имплантатов проводиться препарирование костной ткани. В ходе вращения сверла вектор сопротивления «нарезки» постоянно меняется, что приводит к тому, что направление сверла может несколько изменяется от предварительно запланированной позиции (фото 2-4).
Фото 2. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
Фото 3. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
Фото 4. В определенных случаях процедура классической остеотомии может привести к потере костной ткани в периимплантатной области, что чревато дальнейшим обнажением витков интраоссальной опоры.
Поскольку свежая гидратированная губчатая кость является пластичным материалом, она обладает хорошей способностью к пластической деформации. Остеоконденсация первично представляет собой процесс своеобразной «полировки» кости, в ходе которой происходит ее перераспределение по поверхности остеотомического участка посредством пластической деформации. Ротация боров для остеоконденсации происходит против часовой стрелки, что заставляет их скользить по поверхности костной ткани, провоцируя развитие низкопластичной деформации. При этом сила компрессии заметно меньше, чем предельная прочность кости. Боры для остеоконденсации сконструированы таким образом, что вместо того, чтобы удалять кость, они обеспечивают ее уплотнение, таким образом, не редуцируя исходный объем, повышая исходную плотность и позволяя добиться лучшей степени контакта с имплантатом. Все это также оптимизирует процесс костного заживления. Кроме того, конденсация кости провоцирует развитие определенных напряжений, которые, в свою очередь, повышают остеогенную активность. Остеоконденсация способствует тому, что врачу удается достичь как более высоких показателей ТИ, так и более высоких показателей коэффициента стабильности имплантатов (КСИ).
Сверла для остеоконденсации также оснащены датчиком реального времени, который показывает, стоит ли хирургу увеличить или ослабить усилие в зависимости от исходной плотности костной ткани. Ввиду своего движения против часовой стрелки, боры для остеоконденсации не режут, а наоборот – уплотняют кость со скоростью движения 800-1200 оборотов в минуту (фото 5). Логично, что для того, чтобы не перегреть кость, врач должен обеспечить надлежащий уровень ирригации. Движения боров против часовой стрелки индуцируют развитие компрессионных волн во внешнем направлении, а поскольку бор окружен костной тканью – то именно в ее структуре. Это и называется уплотнение аутографта, или остеоконденсация. Грубо говоря, ошурки костной ткани перераспределяются по канавкам бора и вдавливаются в трабекулярные стенки имплантологического ложа. Таким образом повышается плотность костной ткани в периферических участках остеотомии.
Фото 5. Бор для проведения остеоконденсации, который, в отличие от классических сверл, не режет костную ткань, но уплотняет ее во внешнем направлении. Данные инструменты позволяют провести пластическую деформацию костной ткани, не провоцируя ее экскавацию.
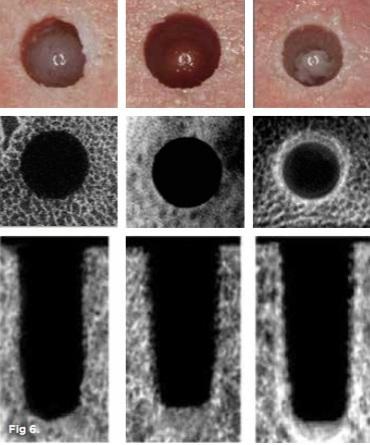
Trisi и коллеги, изучая методики остеоконденсации на животных моделях, установили, что последняя позволяет добиться повышения параметров контакта имплантата с окружающей костью даже при установке титановых опор в участки с низким качеством кости. Таким образом, по мнению авторов, удается повысить стабильность имплантатов, снижая параметры их микродвижений. Huwais и Meyer также сообщили, что уплотнение аутографта в периферических участках остеотомии позволяет добиться лучшей первичной стабильности имплантата (фото 6). При этом авторы указали на то, что для реализации данного подхода требуется наличие достаточного объема костной ткани определённого исходного уровня плотности (фото 6).
Фото 6. Результаты доклинических исследований. В верхнем ряду: вид участков стандартной остеотомии, экстракционного препарирования и остеоконденсации. В нижнем ряду: результаты микрокомпьютерной томографии, на которых можно увидеть, как отличается качество костной ткани по периферии имплантологического ложа во всех трех случаях.
При этом исследователям не удалось зарегистрировать каких-то значительных повышений в температуре при реализации остеокондесанции, которые могли бы спровоцировать ятрогенную травму костной ткани. Наоборот, полученные результаты свидетельствуют об оптимизации процесса костного заживления за счет наличия своей же кости по периферии остеотомии, но только лучшего качества.
Таким образом, предварительно проведенные исследования на животных позволили резюмировать несколько ключевых моментов остеоконденсации. Данная процедура позволяет увеличить минеральную плотность костной ткани в периферических участках остеотомии, таким образом, повышая первичную стабильность имплантатов и параметры их торка при установке. С точки зрения клинической безопасности, манипуляция остеоконденсации также приемлема в качестве процедуры классической остеотомии при условии адекватного контроля скорости сверла и обеспечения надлежащей ирригации. Уплотнение имплантационного ложа позволяет распределить имеющуюся костную ткань во всех направлениях с повышением параметров ее качества на всю глубину, особенно в области дна лунки. Все это повышает качество контакта костной ткани с поверхностью имплантата в среднем в три раза по сравнению с обычной процедурой препарирования области вмешательства.
Выводы
Остеоконденсация позволяет сохранить необходимый объем костной ткани за счет двух подходов: посредством компрессии губчатой кости в ходе ее вязкоупругой и пластической деформации, а также за счет уплотнения частиц аутографта по всей длине и глубине остеотомии. Разные подходы к конденсации аутотрансплантата используются врачами на протяжении уже более 20 лет в разных отраслях медицины (например, в ортопедической хирургии для улучшения стабильности протеза при замене тазобедренного сустава). Концепция остеоконденсации отличается от принципов классической остеотомии тем, что она не предполагает удаления кости, а наоборот обеспечивает улучшение параметров качества кости за счет ее перераспределения по периферии имплантологического ложа.
Авторы: Michael A. Pikos, DDS; and Richard J. Miron, DDS, PhD