вакцина спутник v в каких дозах выпускается
О Спутник V
О Спутник V
«Спутник V» — первая в мире зарегистрированная вакцина на основе хорошо изученной платформы вектора аденовируса человека. Она одобрена в 71 стране с общим населением 4 млрд человек.
Вакцина названа в честь первого советского космического спутника. Запуск «Спутника-1» в 1957 году дал новый импульс космическим исследованиям во всем мире, создав так называемый «момент Спутника» для мирового сообщества.
Эффективность вакцины составляет 97,6% по результатам анализа данных о заболеваемости коронавирусом среди россиян, привитых обоими компонентами препарата в период с 5 декабря 2020 года по 31 марта 2021 года.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Итоги третьей фазы клинических испытаний в России опубликованы в журнале Lancet 2 февраля 2021 года. Клинические испытания третьей фазы «Спутник V» также успешно проходят в ОАЭ, Индии, Венесуэле и Беларуси.
Вакцина «Спутник V» создана на проверенной и хорошо изученной платформе аденовирусных векторов человека, которые вызывают обычную простуду и с которыми человечество сталкивалось на протяжении тысячелетий.
В вакцине «Спутник V» впервые среди вакцин против коронавируса был применен подход гетерогенного бустирования, в основе которого лежит применение двух разных векторов для двух уколов в процессе вакцинации. Такой подход формирует более стойкий иммунитет по сравнению с вакцинами, которые используют одинаковый механизм доставки для обоих уколов.
Безопасность, эффективность и отсутствие долгосрочных негативных последствий у аденовирусных вакцин доказаны в более чем 250 клинических исследованиях на протяжении двух десятилетий.
«Спутник V» не вызывает сильной аллергии.
Температура хранения на уровне +2+8 градусов Цельсия позволяет хранить вакцину в обычном холодильнике без необходимости инвестиций в дополнительную инфраструктуру холодовой цепи.
Как работают вакцины на основе аденовирусного вектора
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
Преимущества прайм-буст иммунизации

Безопасность и эффективность
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Эффективность против новых штаммов
Вакцинация препаратом вырабатывает защитные нейтрализующие титры антител против новых штаммов, включая Alpha B.1.1.7 (впервые выявлен в Великобритании), Beta B.1.351 (впервые выявлен в ЮАР), Gamma P.1 (впервые выявлен в Бразилии), Delta B.1.617.2 и B.1.617.3 (впервые выявлены в Индии) и выявленных в Москве вариантов B.1.1.141 и B.1.1.317 с мутациями в рецептор-связывающем домене (RBD).Методология исследования основана на оценке вируснейтрализующей активности (ВНА) с применением живого вируса, что позволяет получить наиболее достоверные данные и является «золотым» стандартом. В ходе исследования сравнивалась ВНА сыворотки крови людей после вакцинации препаратом «Спутник V» на образцах штаммов, имеющих международное распространение, с ВНА против исходного штамма B.1.1.1. Сыворотка крови была собрана у лиц, иммунизированных обоими компонентами «Спутника V».
Полученные данные демонстрируют, что «Спутник V» сохраняет защитные свойства против новых штаммов. Снижение уровня вируснейтрализующей активности у препарата «Спутник V» к ряду штаммов оказалось значительно меньшим по сравнению с данными, опубликованными производителями других вакцин, которые ранее подтвердили эффективность своих препаратов против новых мутаций коронавирусной инфекции.
О вакцине «Гам-КОВИД-Вак» («Спутник V»)
Вакцина «Спутник V» – продукт совместной разработки ФГБУ “48-й ЦНИИ” Министерства обороны РФ и ФГБУ “НИЦЭМ” им. Н.Ф. Гамалеи.
«Спутник V» — первая в мире зарегистрированная вакцина на основе хорошо изученной платформы вектора аденовируса человека. В настоящее время она входит в десятку лучших вакцин-кандидатов в списке Всемирной организации здравоохранения (ВОЗ).
Вакцина от коронавируса «Спутник V» – векторная двухкомпонентная вакцина. Первый компонент – рекобинантный репликативно-дефектный вектор на основе аденовируса человека 26 серотипа, несущий ген S-белка вируса SARS-CoV-2; второй компонент – рекобинантный репликативно-дефектный вектор на основе аденовируса человека 5 серотипа, несущий ген S-белка вируса SARS-CoV-2.
Технология использования аденовирусных векторов в качестве векторных вакцин развивается с 80-х годов прошлого века, является безопасной и эффективной, что подтверждается в многочисленных исследованиях.
Вакцинация проводится гражданам России, не болевшим Covid-19 и не имеющим антител к SARS-Cov-2 (по результатам лабораторных исследований).
Как работает вакцина от коронавируса Спутник V
Использование вакцины в два этапа (два вектора) является уникальной технологией на основе аденовирусных векторов. Разработана в Центре имени Н. Ф. Гамалеи.
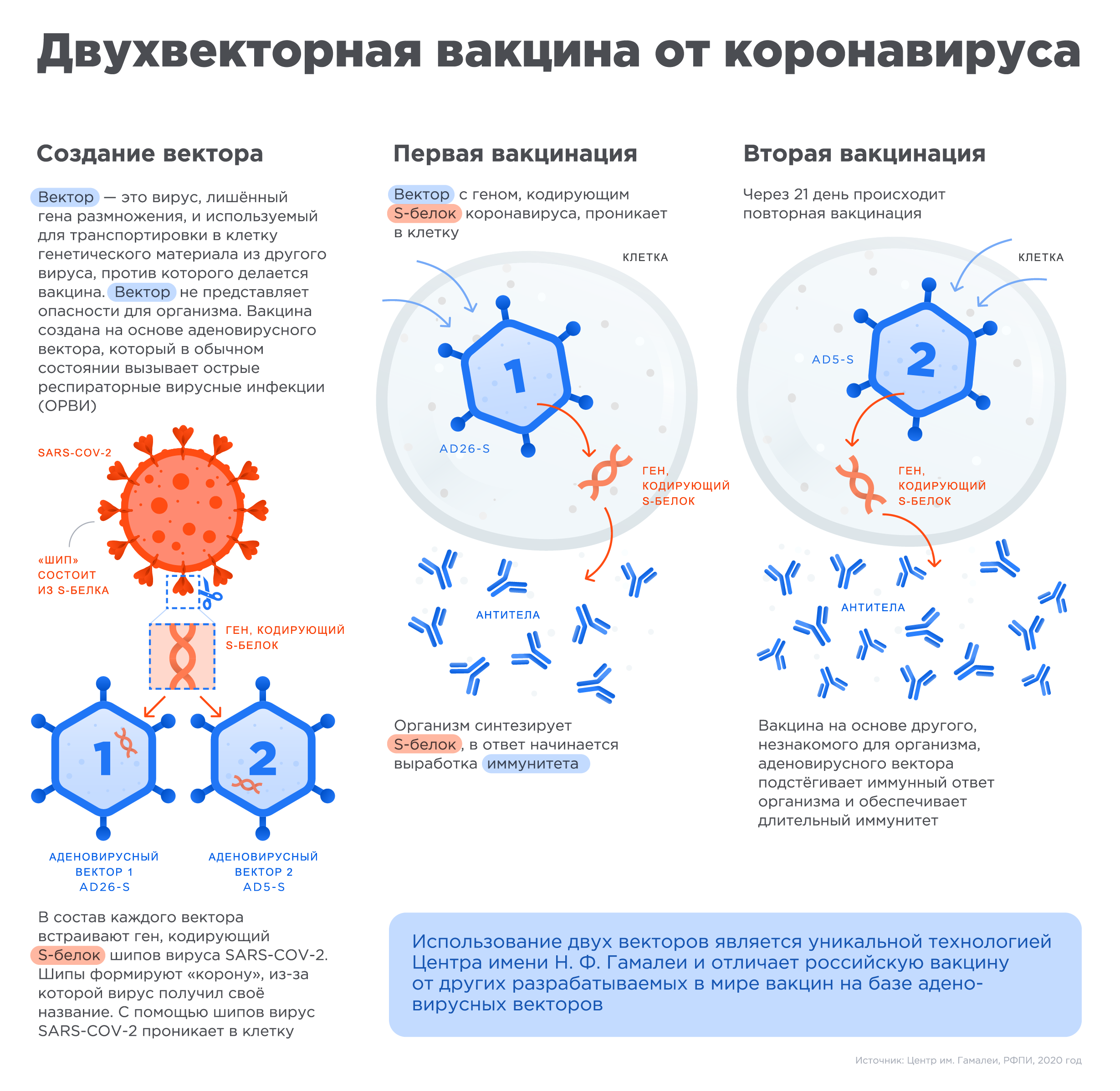
Создание вектора
Вектор — это вирус с отсутствующим геном размножения. Он используется для транспортировки генетического материала в клетку из другого вируса, против которого создана вакцина. В основе вакцины, используются аденовирусные векторы, которые в обычном состоянии вызывают ОРВИ. В каждый вектор встраивают ген, кодирующий S-белок шипов коронавируса.

Первая вакцинация
Вектор с встроенным геном, кодирующем S-белок коронавируса, проникает в клетку. В ответной реакции организм синтезирует S-белок. Начинается выработка иммунитета.
Вторая вакцинация
Вторая вакцинация производится через 21 день после первого этапа. Вакцина на основе другого, незнакомого для организма, аденовирусного вектора подстёгивает иммунный ответ организма и обеспечивает длительный иммунитет.
ВАЖНО! Иммунитет формируется полностью после 2-й дозы вакцины.
В этот период человек недостаточно защищен, поэтому необходимо соблюдать все меры профилактики защиты (ношение масок, перчаток и соблюдение дистанции).
Общая информация
В настоящее время в мире разрабатывается около 165 различных вакцин против коронавируса. Основные типы вакцин включают: вирусные векторные вакцины, вакцины на основе вирусов, нуклеиновых кислот и белков. Российская вакцина на основе аденовирусного вектора была зарегистрирована Министерством здравоохранения России 11 августа и стала первой зарегистрированной вакциной от нового коронавируса SARS-COV-2 на рынке. Это событие создало так называемый «момент Спутника» для мирового сообщества.
Проверенная технология использования векторов на базе аденовирусов человека
Технология использования аденовирусных векторов в качестве векторных вакцин развивается с 80-х годов прошлого века, является безопасной и эффективной, что подтверждается в многочисленных исследованиях.
Клинические испытания
Вакцина получила свидетельство о регистрации от Минздрава России, и в соответствии с правилами, принятыми во время пандемии, может использоваться для вакцинации населения в России.
Как работают вакцины на основе аденовирусного вектора
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
Безопасность и эффективность
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Противопоказания
Перед вакцинацией врач терапевт проводит осмотр и анкетирование, определяет отсутствие или наличие противопоказаний.
Рекомендации после проведения вакцинации:
Возможны следующие индивидуальные реакции:
Рекомендации: уменьшить физическую нагрузку и дать себе отдохнуть. Для уменьшения отека принять антигистаминные препараты. При повышении температуры больше 38 градусов принять жаропонижающие препараты (парацетамол, ибупрофен). Если температура выше 39 градусов и не снижается более 4-х часов необходимо вызвать врача. При насморке и заложенности носа используйте назальные спреи и антисептические средства, при першении в горле полоскайте.
Рекомендуется в течении 3-х дней после вакцинации не мочить место инъекции, не посещать сауну, баню, не применять алкоголь, избегать чрезмерных физических нагрузок.
Ответы на популярные вопросы
Когда необходимо проводить ревакцинацию «Спутником V»?
Можно ли делать ревакцинацию после «Спутника V» вакциной «Спутником Лайт» и когда?
Да, можно. Через полгода.
Можно ли делать вакцинацию «Спутник V» если переболел коронавирусом (Covid-19) или ОРВИ?
Да, можно. Через полгода если официально переболели коронавирусом и передали данные в Госуслуги и ЕМИАС. Через 30 дней после выздоровления, для того, чтобы успел восстановиться иммунитет. Так же вы можете сдать тест на антитела igG, если их количество высокое, то дополнительно вакцинироваться не требуется. Но наличие антител не является противопоказанием для вакцинации.
Каков срок действия вакцины «Спутник V» после вакцинации?
Российская вакцина «Спутник V» точно дает защиту от коронавируса на 6 месяцев. «Спутник V» практически на 100% защищает от тяжелых и летальных случаев.
Можно ли делать «Спутник V» иностранному гражданину?
Если у иностранного гражданина есть полис ОМС, регистрация (РВП или ВНЖ) и СНИЛС, то он может сделать вакцинацию «Спутником V» и любой вакциной, имеющейся в наличии. В этом случае иностранный гражданин имеет право на бесплатную медицинскую помощь и может сделать вакцинацию бесплатно в любом пункте вакцинации.
Если нет полиса ОМС, то сделать вакцинацию иностранный гражданин может только платно в частных клиниках. Прививки от коронавируса не относятся к экстренной медицинской помощи, а поэтому иностранцам без полиса ОМС, бесплатно их не поставят.
Для трудовых мигрантов (без регистрации, РВП и ВНЖ), без СНИЛС и полиса ОМС доступна вакцина «Спутник Лайт».
Ключ к спасению: как работает вакцина «Спутник V»
В нашей рубрике «Живой уголок» мы расскажем о том, что за зверь такой этот коронавирус, и о том, каким образом от него защищает прививка «Спутник V».
Жил был вирус. Вирус – это микроскопический живой организм. Его размер действительно очень маленький – лишь одна десятитысячная миллиметра. Как и все живые организмы, вирус размножается. Романтики в этом – никакой. У вируса нет ни сердца, ни мозга. Но вирус все же очень раним. Ему нужны исключительные условия для жизни. Вирус комфортно живет и плодится лишь в организме человека.
Но что это за шипы? Они словно липучки. С их помощью вирус прицепляется к здоровым клеткам человека. Идеальное место для коронавируса – наши легкие. Что же происходит дальше? Вирус обладает чудесной возможностью проникнуть внутрь клетки сквозь оболочку. Делает он это для того, чтобы именно внутри клетки и размножиться. То есть клетка для вируса – настоящее родильное отделение. Здесь для него есть все: и питание, и ограниченное пространство. Внутри клетки вирус дает прямо-таки несметное потомство – сотни и тысячи новых маленьких вирусят. Их так много, что оболочка клетки не выдерживает и лопается. А маленькие вирусята, «выйдя из роддома на волю», отправляются на охоту за другими здоровыми клетками. Этот цикл занимает лишь пару дней. Столько живет одно поколение коронавируса.
А что же тем временем чувствует зараженный человек? Каждое новое поколение вируса разрушает наши легкие все больше и больше. Это лавинообразный процесс. Дышать становится все труднее и труднее. От недостатка кислорода страдают все органы, прежде всего мозг. Лечение запущенных случаев оказывается безнадежным. А тем, кого врачам в реанимации все же удается спасти, в большинстве случаев вернуться к прежней нормальной жизни не удается.
Поэтому надо защищаться. Лучше не заболеть. Самое надежное средство – вакцина. Российские ученые в Институте Гамалеи первыми в мире разработали спасительную прививку. Но как она работает? В чем принцип действия? Как она защищает нас?
Известно, что организм человека защищается от инфекций, вырабатывая антитела. Инфекция – это всегда микроб – бактерия или вирус. Антитела – это армия воинов против болезнетворных микробов. Это боевые молекулы, способные облепить собой, связать, обездвижить, в конечном счете обезвредить микробы. Они всегда вырабатываются у нас после встречи с инфекцией.
Новорожденный младенец получает их с грудным молоком матери. Она передает ему иммунитет как память о перенесенных болезнях. На первые месяцы хватает. А потом начинает работать своя иммунная система, производящая свои антитела. Антитела всегда специфичны и работают по конкретным мишеням.
Когда же пару лет назад появился новый и доселе неизвестный коронавирус, то антител к нему ни у кого не было. И быть не могло. Нужно было научить наш организм вырабатывать новые антитела, нацеленные на новые мишени. Конкретно – на коронавирус.
То есть наш организм предстояло познакомить с коронавирусом, но безопасно. И вот как коронавирус удалось перехитрить. Решили создать своего рода чучело. Нечто похожее на коронавирус. За основу взяли известный всем аденовирус – тот, что вызывает легкую простуду. Но при этом из него удалили органы размножения, попросту говоря, кастрировали. То есть вирус есть, даже может проникнуть внутрь наших клеток, но размножаться там не может. А значит, и не может вызвать болезнь.
В такой обезвреженный аденовирус вживили ген, вынуждающий наши клетки синтезировать фрагменты короны, только те самые шипы с поверхности зловредного шарика. Сами по себе эти запчасти безвредны. Но именно эти шипы, если растут на живом коронавирусе, – самое запоминающееся, самое характерное и самое опасное. Мы же помним, что именно они необходимы коронавирусу для проникновения в клетку. Но без тела микроба сами по себе шипы безопасны.
Итак, когда обезвреженный аденовирус доставляет в наши клетки приказ производить фрагменты короны, иммунная система начинает против чужаков вырабатывать совершенно определенные антитела. И в будущем, когда организм встретится с реальным коронавирусом, он будет уже вооружен против его шипов. Антитела, выработанные после прививки, набросятся на агрессора, облепят его и обездвижат. Лишат возможности проникать в наши здоровые клетки.
Собственно, так и работает вакцина «Спутник V». Секретов ни для кого нет. Механизм защиты доказан миллионы и миллионы раз в десятках стран мира. В России он тоже работает.
Вакцина Спутник V
Вакцина «Спутник V» защищает от инфекций:
Стоимость прививки Спутник V в Москве составляет 1500 руб. В цену включён осмотр врача перед вакцинацией.
Похожие вакцины (аналоги Спутник V):
Название семейство коронавирусов получило благодаря шипам, с помощью которых вирус прикрепляется к поверхности клетки и проникает внутрь. Эти шипы формируют «корону» вируса.
Для COVID-19 характерны симптомы ОРВИ: повышение температуры тела, кашель (сухой или с небольшим количеством мокроты), одышка, утомляемость, ощущение заложенности в грудной клетке. Также отмечаются боль в горле, насморк, снижение обоняния и вкуса, конъюнктивит. Одышка развивается к 6-8-му дню от момента заражения. Могут быть боли в мышцах, спутанность сознания, головные боли, кровохарканье, диарея, тошнота, рвота, сердцебиение. Эти симптомы наблюдаются и при отсутствии повышения температуры тела.
Вакцина Sputnik V («Спутник Ви» «Гам-КОВИД-Вак») разработана Национальным исследовательским центром эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи. Это первая в мире зарегистрированная векторная вакцина против коронавируса.
Вектор – это вирус, который не представляет опасности для организма и служит транспортом для доставки в клетку генетического материала другого вируса, против которого делается вакцина. В вакцине «Спутник V» в качестве вектора используется аденовирус, из которого удалили генетический материал, а на его место вставили ген, кодирующий белок шипа коронавируса (S-белок). В составе вектора этот ген безопасен для организма, но он помогает иммунной системе вырабатывать антитела, которые защищают от инфекции.
Могу ли я заболеть коронавирусом из-за вакцинации?
Нет, вакцина Спутник V не содержит живой вирус или его компоненты и не может вызвать коронавирусную инфекцию.
Какие побочные эффекты наблюдаются после введения вакцины?
В большинстве случаев побочные эффекты не наблюдаются. В редких случаях возможны повышение температуры тела, головная боль, слабость, усталость, боль в мышцах и суставах, заложенность носа, першение в горле, сыпь, аллергические реакции.
Могу ли я сделать только одну дозу вакцины?
Частичный иммунитет будет сформирован даже после первой вакцинации, однако для получения более выраженной и стойкой защиты рекомендовано введение обеих доз Спутника V.
При подготовке материала использована официальная информация с сайтов стопкоронавирус.рф, https://sputnikvaccine.com, Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) версия 10 (08.02.2021)
Узнать наличие вакцины Спутник V и записаться на прививку можно по телефонам центра:
«Диавакс» на Таганке
Если хотите пригласить определённого специалиста, оставьте заявку и мы вам перезвоним!
А еще мы отвечаем на интересующие вас вопросы в специальном разделе! Чаще всего это вопросы индивидуального характера в отношении вакцинации, иммунитета и тому подобного.
Гам-КОВИД-Вак
Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
раствор для внутримышечного введения
Состав
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0 ± 0,5) × 10 11 частиц/доза.
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1,21 мг, натрия хлорид — 2,19 мг, сахароза — 25,0 мг, полисорбат 80 — 250 мкг, магния хлорида гексагидрат — 102,0 мкг, ЭДТА динатриевая соль дигидрат — 19,0 мкг, этанол 95 % — 2,5 мкл, вода для инъекций — до 0,5 мл.
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2, в количестве (1,0 ± 0,5) × 10 11 частиц/доза.
Вспомогательные вещества: трис(гидроксиметил)аминометан — 1,21 мг, натрия хлорид — 2,19 мг, сахароза — 25,0 мг, полисорбат-80 — 250 мкг, магния хлорида гексагидрат — 102,0 мкг, ЭДТА динатриевая соль дигидрат — 19,0 мкг, этанол 95 % — 2,5 мкл, вода для инъекций — до 0,5 мл.
Описание
Замороженный препарат
Компонент Ⅰ. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент Ⅱ. Раствор замороженный. Представляет собой плотную затвердевшую беловатого цвета массу. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Жидкий препарат
Компонент Ⅰ. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент Ⅱ. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика
Вакцина получена биотехнологическим путём, при котором не используется патогенный для человека вирус SARS-CoV-2. Препарат состоит из двух компонентов: компонент Ⅰ и компонент Ⅱ.
В состав компонента Ⅰ входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S-вируса SARS-CoV-2, в состав компонента Ⅱ входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Вакцина индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARS-CoV-2.
Иммунологическая эффективность
Иммунологические свойства и безопасность вакцины изучали в различных клинических исследованиях у взрослых добровольцев обоего пола в возрасте старше 18 лет.
Промежуточный анализ иммуногенности показал, что вакцина формирует иммунный ответ у добровольцев. При исследовании гуморального иммунного ответа сыворотки добровольцев были проанализированы на наличие антител, специфичных к рецептор-связывающему домену гликопротеина S вируса SARS-CoV-2 на 42 день от начала вакцинации: в группе вакцинированных среднее геометрическое значение титра антител составило 8996, уровень сероконверсии — 98,25. При сравнении уровня RBD-специфических антител между возрастными стратами статистически значимая разница была показана для группы 18–30 лет относительно остальных возрастных групп; среднее геометрическое значение титра антител составило 18102–22067, уровень сероконверсии — 100 %. Уровни антител достоверно не различались у мужчин и женщин. На 42-й день от начала вакцинации средний геометрический титр нейтрализующих антител у иммунизированных добровольцев составил 44,47, уровень сероконверсии — 95,83 %. Статистически значимой разницы у добровольцев различного пола и возраста не выявлено.
Иммунизация препаратом Гам-КОВИД-Вак, формирует напряженный антиген- специфический клеточный противоинфекционный иммунитет у практически у всех обследованных добровольцев (формирование антиген-специфичных клеток обоих популяций T лимфоцитов: T хелперных (CD4+) и T киллерных (CD8+) и достоверному повышению секреции ИФНγ).
Защитный титр антител в настоящее время неизвестен. Продолжительность защиты неизвестна.
Клинические исследования по изучению эпидемиологической эффективности продолжаются в настоящее время. По данным промежуточного анализа эффективность составляет более 91 %.
Показания
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых старше 18 лет.
Противопоказания
Противопоказания для введения компонента Ⅱ
С осторожностью
Применять вакцину с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениях функции щитовидной железы и сахарный диабет в стадии декомпенсации), тяжёлых заболеваниях системы кроветворения, эпилепсии и других заболеваний ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Применение при беременности и в период грудного вскармливания
По результатам исследований на животных, репродуктивная токсичность и тератогенность отсутствуют. Клинические исследования Гам-КОВИД-Вак при беременности не проводились. В связи с этим применять препарат Гам-КОВИД-Вак при беременности следует в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода с 22 недели беременности.
Клинические данные по применению препарата Гам-КОВИД-Вак у женщин, кормящих грудью, и младенцев отсутствуют. В настоящее время неизвестно, способны ли действующие вещества, входящие в состав вакцины, проникать в грудное молоко. Перед принятием решения о вакцинации кормящей женщины необходимо оценить риски и пользу данной вакцинации.
Способ применения и дозы
Вакцина предназначена только для внутримышечного введения. Строго запрещено внутривенное введение препарата. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу — препарат вводят в латеральную широкую мышцу бедра.
Вакцинацию проводят в два этапа: вначале компонентом Ⅰ в дозе 0,5 мл, затем, через 3 недели — компонентом Ⅱ в дозе 0,5 мл.
После введения вакцины пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Применение вакцины производства ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России) (флаконы) и АО «Биннофарм» (ампулы)
Перед вакцинированием флакон или ампулу с компонентом Ⅰ или Ⅱ достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой. Вскрывают ампулу по цветной точке.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Не допускается хранение размороженного препарата!
Повторное замораживание не допускается!
Применение вакцины производства АО «ГЕНЕРИУМ» (флаконы), ОАО «Фармстандарт- УфаВИТА» (флаконы, ампулы) и ЗАО «ЛЕККО» (флаконы)
Замороженный препарат
Внимание! Повторное замораживание флакона или ампулы с раствором не допускается!
Суммарное время хранения размороженного раствора при комнатной температуре не должно превышать 2 часов. Неиспользованная вакцина подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом Ⅰ или Ⅱ достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой. Вскрывают ампулу по кольцу или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого флакона или ампулы — не более 2 часов при комнатной температуре.
Повторное замораживание флакона или ампулы с раствором не допускается!
Жидкий препарат
Внимание! Не использовать флакон или ампулу с препаратом с видимыми дефектами укупорочной системы и/или стекла. Замораживание флакона или ампулы с раствором не допускается!
Приготовление раствора для инъекций.
Флакон или ампулу достают из холодильника и выдерживают при комнатной температуре, допускается слегка нагреть препарат, например, подержав его в руках. Не следует нагревать препарат выше 37 °C.
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой или вскрывают ампулу по кольцу или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту. Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Многодозовые флаконы
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Многодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение вакцины при комнатной температуре: вскрытой ампулы, закрытой стерильной салфеткой, не более 1 часа; невскрытой ампулы — не более 2 часов.
ВНИМАНИЕ! Одна ампула содержит две дозы вакцины. Объём одной дозы составляет 0,5 мл. Одному пациенту вводить 1 дозу (0,5 мл).
Однодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение невскрытой ампулы при комнатной температуре не более 2 часов.
Жидкий препарат
Внимание! Замораживание флакона или ампулы с раствором не допускается! Неиспользованная вакцина подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом Ⅰ или Ⅱ достают из холодильника и выдерживают при комнатной температуре, допускается слегка нагреть препарат, например, подержав его в руках. Не следует нагревать препарат выше 37 °C.
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой. Ампулу вскрывают по кольцу и/или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту. Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Многодозовые флаконы
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Однодозовые ампулы
Содержимое одной ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение невскрытой ампулы при комнатной температуре не более 2 часов.
Применение вакцины производства ЗАО «БИОКАД» (флаконы)
Перед вакцинированием флакон с компонентом Ⅰ или Ⅱ достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого флакона по 3 мл не более 2 часов при комнатной температуре.
Не допускается хранение размороженного препарата во флаконах по 0,5 мл!
Повторное замораживание не допускается!
Жидкий препарат
Внимание! Не использовать флакон с препаратом с видимыми дефектами укупорочной системы и/или стекла. Замораживание флакона с раствором не допускается!
Флакон достают из холодильника и выдерживают при комнатной температуре, допускается слегка нагреть препарат, например, подержав его в руках. Не следует нагревать препарат выше 37 °C.
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого флакона по 3 мл не более 2 часов при комнатной температуре.
Внимание! К использованию непригоден препарат (жидкий и/или замороженный) с дефектами укупорочной системы и/или нарушенной маркировкой флакона или ампулы, при изменении физических свойств раствора (мутность, окрашивание), неправильном хранении и/или с истекшим сроком годности.
Применение вакцины производства АО «Р-Фарм» (флаконы) и ООО «СПУТНИК ТЕХНОПОЛИС», компонент Ⅱ (флаконы)
Внимание! К использованию непригоден препарат с дефектами укупорочной системы и/или нарушенной маркировкой флакона, при изменении физических свойств раствора (мутность, окрашивание), неправильном хранении и/или с истекшим сроком годности.
Однодозовые флаконы
Перед вакцинированием флакон с компонентом Ⅰ или Ⅱ достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Не допускается хранение размороженного препарата!
Повторное замораживание не допускается! Неиспользованная вакцина подлежит уничтожению.
Многодозовые флаконы
Перед вакцинированием флакон с компонентом Ⅰ или Ⅱ достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого размороженного флакона при комнатной температуре не более 2 часов.
Повторное замораживание не допускается! Неиспользованная вакцина подлежит уничтожению.
Внимание. К использованию непригоден препарат с дефектами укупорочной системы и/или нарушенной маркировкой флакона или ампулы, при изменении физических свойств раствора (мутность, окрашивание), неправильном хранении и/или с истекшим сроком годности.
| ▼ Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи, с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путём внесения информации в соответствующей раздел информационной системы ЕГИСЗ. |
Побочное действие
Нежелательные явления (НЯ), характерные для применения вакцины, выявленные в рамках клинических исследований, а также исследований других вакцин на основе аналогичной технологической платформы, бывают преимущественно лёгкой или средней степени выраженности, могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней. Чаще других могут развиться кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью) и местные (болезненность в месте инъекции, гиперемия, отёчность) реакции. Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда — увеличение регионарных лимфоузлов. У некоторых пациентов возможно развитие аллергических реакций, кратковременное повышение уровня печёночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови.
В рамках проведённых клинических исследований безопасности, переносимости и иммуногенности препарата Гам-КОВИД-Вак после вакцинации были зарегистрированы следующие нежелательные реакции:
«Общие нарушения и реакции в месте введения»: часто — гипертермия, боль, отёк, зуд в месте вакцинации, астения, боль, недомогание, пирексия, повышение температуры кожи в месте вакцинации, снижение аппетита.
«Желудочно-кишечные нарушения»: часто — тошнота, рвота, диспепсия.
«Нарушения со стороны дыхательной системы, органов грудной клетки и средостения»: часто — боль в ротоглотке, заложенность носа, першение в горле, ринорея.
«Со стороны кожи и подкожной клетчатки»: очень редко — ангиоотёк, крапивница и сыпь (эритематозная, папулёзная).
«Нарушения со стороны иммунной системы»: очень редко — анафилактический шок, анафилактическая реакция и гиперчувствительность.
«Со стороны крови и лимфатической системы»: редко — увеличение регионарных лимфоузлов.
«Нарушения со стороны нервной системы»: часто — головная боль; редко — головокружения, обмороки; очень редко — сообщается о единичных случаях воспалительной полиневропатии (причинно-следственная связь с лекарственным препаратом не установлена — частота данных событий в популяции имеет сезонный характер и может быть связана с различными причинами: провоцирующими факторами могут быть инфекционные заболевания вирусной и бактериальной этиологии, хирургические вмешательства, травматическое повреждение периферических нервов, любая вакцинация, аутоиммунные и системные заболевания).
«Лабораторные и инструментальные данные»: разнонаправленные отклонения показателей иммунологического статуса: повышение числа T-лимфоцитов, увеличение процентного содержания лимфоцитов, снижение числа естественных клеток-киллеров, увеличение количества СО4-лимфоцитов, снижение количества СО4-лимфоцитов, повышение числа B-лимфоцитов, снижение числа B-лимфоцитов, повышение числа естественных клеток-киллеров, повышение количества CDS-лимфоцитов, повышение уровня иммуноглобулина E (IgE) в крови, увеличение соотношения CD4/CD8, уменьшение соотношения CD4/CD8, повышение уровня иммуноглобулина A (IgA) в крови, уменьшение процентного содержания лимфоцитов CD8. Отклонения в общем анализе крови: увеличение процентного содержания лимфоцитов, снижение показателя гематокрита, увеличение числа лимфоцитов, повышение скорости оседания эритроцитов, повышение числа лейкоцитов, повышение числа моноцитов, повышение числа тромбоцитов, снижение числа нейтрофилов, снижение числа тромбоцитов. Отклонение показателей биохимического анализа крови: повышение уровня печёночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови. Отклонения в общем анализе мочи: эритроциты в моче. Большинство НЯ завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждались в проведении дополнительных диагностических процедур и назначении терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие указанных выше токсических и токсико-аллергических реакций в более тяжёлой степени.
Специфических антидотов к препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/ НПВС и десенсибилизирующие средства), кортикостероиды — парентерально при выраженном токсико-аллергическом синдроме). Режим назначения препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Взаимодействие с другими лекарственными средствами
Специальных исследований лекарственных взаимодействий не проводилось.
Взаимодействие с вакциной для профилактики гриппа изучено в доклинических исследованиях, показано отсутствие снижения иммуногенности как вакцины Гам-КОВИД-Вак (Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2), так и гриппозной вакцины в эксперименте при их одновременном введении. Ожидается отсутствие снижения иммуногенности для расщепленных, субъединичных и полимерсубъединичных гриппозных вакцин.
Не допускается смешивание вакцины Гам-КОВИД-Вак с другими вакцинами или иными лекарственными средствами в одном шприце, так как нет данных о фармацевтическом взаимодействии.
Особые указания
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ.
Поэтому приём препаратов, угнетающих функцию иммунной системы, противопоказан в течение, как минимум, 1 месяца до и после вакцинации из-за риска снижения иммуногенности.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
При принятии врачом (медицинским работником) решения о необходимости одновременного введения Гам-КОВИД-Вак с другой вакциной, не допускается их смешивание в одном шприце и введение в один участок тела.
▼ Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций.
Инструкция подготовлена на основании ограниченного объёма клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном порядке.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения, компонент Ⅰ — 0,5 мл/доза + компонент Ⅱ — 0,5 мл/доза.
Замороженный препарат
При производстве ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России):
по 0,5 мл (1 доза) каждого компонента препарата во флаконы нейтрального стекла, герметично укупоренные пробками из резины, обжатые алюминиевыми или алюмопластиковыми колпачками.
1 флакон компонента Ⅰ с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного; 1 флакон компонента Ⅱ с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного.
По 5 флаконов компонента Ⅰ или компонента Ⅱ помещают в контурную ячейковую упаковку из плёнки поливинилхлоридной. По 1 или 2 контурные ячейковые упаковки с компонентом Ⅰ или компонентом Ⅱ вместе с инструкцией по применению помещают в пачку картонную или в пачку из картона коробочного.
При производстве АО «Биннофарм»:
по 0,5 мл (1 доза) каждого компонента препарата в ампулы из бесцветного стекла с цветной точкой.
По 5 ампул каждого компонента препарата помещают в контурную ячейковую упаковку из плёнки поливинилхлоридной.
По 1 или 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона.
При производстве на АО «ГЕНЕРИУМ»:
по 3,0 мл (5 доз) каждого компонента — во флаконы, укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
1 флакон с компонентом Ⅰ или компонентом Ⅱ вместе с инструкцией по медицинскому применению — в пачке из картона с поролоновым держателем из пенополиуретана.
При производстве на ЗАО «ЛЕККО»:
по 3 мл (5 доз) каждого компонента препарата — во флаконы, укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
По 1 флакону с компонентом Ⅰ или с компонентом Ⅱ вместе с инструкцией по применению помещают в пачку из картона с поролоновым держателем из пенополиуретана.
При производстве на ОАО «Фармстандарт-УфаВИТА»:
по 0,5 мл (1 доза) или по 1,0 мл (2 дозы) каждого компонента препарата в ампулы из бесцветного стекла.
По 5 ампул каждого компонента препарата — в контурную ячейковую упаковку из плёнки поливинилхлоридной.
По 1 или 2 контурные ячейковые упаковки вместе с инструкцией по применению — в пачку из картона.
По 1 контурной ячейковой упаковке вместе с инструкцией по применению — в пачку из картона.
По 3 мл (5 доз) каждого компонента препарата — во флаконы, укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
По 1 флакону с компонентом Ⅰ или с компонентом Ⅱ вместе с инструкцией по применению — в пачку из картона с поролоновым держателем из пенополиуретана
При производстве на ЗАО «БИОКАД»:
по 0,5 мл (1 доза) или по 3,0 мл (5 доз) каждого компонента препарата во флаконы из нейтрального стекла Ⅰ гидролитического класса (типа 2R, 6R), герметично укупоренные резиновыми пробками, с обкаткой алюминиевыми колпачками с пластиковой крышкой типа «flip-off».
На флаконы каждого компонента препарата наклеивают этикетку самоклеящуюся.
1 флакон 6R с компонентом Ⅰ или компонентом Ⅱ с инструкцией по применению помещают в пачку картонную.
1 флакон 2R с компонентом Ⅰ или компонентом Ⅱ в контурной ячейковой упаковке из ПВХ плёнки с инструкцией по применению помещают в пачку картонную.
При производстве АО «Р-Фарм»:
по 0,5 мл (1 доза) каждого компоненте лекарственного препарата или по 3,0 мл (5 доз) компонента Ⅰ — во флаконы из нейтрального стекла Ⅰ гидролитического класса типа 2R (для однодозовых флаконов) или 10R (для пятидозовых флаконов), герметично укупоренные пробками из резины и обжатые алюмопластиковыми колпачками.
По 1, 2, 5 или 10 флаконов с компонентом Ⅰ или компонентом Ⅱ по 0,5 мл (1 доза) или по 1 или 10 флаконов с компонентом Ⅰ по 3,0 мл (5 доз) вместе с инструкцией по применению в пачку из картона.
При производстве на ООО «СПУТНИК ТЕХНОПОЛИС» (компонент Ⅱ):
по 3,0 мл (5 доз) компонента Ⅱ — во флаконы из нейтрального стекла Ⅰ гидролитического класса типа 10R герметично укупоренные пробками из резины и обжатые алюмопластиковыми колпачками.
По 1 или 10 флаконов с компонентом Ⅱ вместе с инструкцией по применению в пачку из картона.
Жидкий препарат
При производстве на АО «ГЕНЕРИУМ»:
по 3,0 мл (5 доз) каждого компонента — во флаконы, укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
1 флакон с компонентом Ⅰ или с компонентом Ⅱ в контурной ячейковой упаковке из плёнки поливинилхлоридной или полиэтилентерефталатной вместе с инструкцией по медицинскому применению — в пачку из картона или без контурной ячейковой упаковки вместе с инструкцией по медицинскому применению — в картонную пачку с поролоновым держателем из пенополиуретана.
При производстве на ЗАО «ЛЕККО»:
по 3 мл (5 доз) каждого компонента препарата — во флаконы, укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
1 флакон с компонентом Ⅰ или с компонентом Ⅱ в контурной ячейковой упаковке из плёнки поливинилхлоридной или полиэтилентерефталатной вместе с инструкцией по медицинскому применению — в пачку из картона или без контурной ячейковой упаковки вместе с инструкцией по медицинскому применению — в картонную пачку с поролоновым держателем из пенополиуретана.
При производстве на ОАО «Фармстандарт-УфаВИТА»:
по 0,5 мл (1 доза) каждого компонента препарата в ампулы из бесцветного стекла.
По 5 ампул каждого компонента препарата — в контурную ячейковую упаковку из плёнки поливинилхлоридной.
По 1 контурной ячейковой упаковке вместе с инструкцией по применению — в пачку из картона.
При производстве на ЗАО «БИОКАД»:
по 0,5 мл (1 доза) или по 3,0 мл (5 доз) каждого компонента препарата во флаконы из нейтрального стекла Ⅰ гидролитического класса (типа 2R, 6R), герметично укупоренные резиновыми пробками, с обкаткой алюминиевыми колпачками с пластиковой крышкой типа «flip-off».
На флаконы каждого компонента препарата наклеивают этикетку самоклеящуюся.
1 флакон 6R с компонентом Ⅰ или компонентом Ⅱ с инструкцией по применению помещают в пачку картонную.
1 флакон 2R с компонентом Ⅰ или компонентом Ⅱ в контурной ячейковой упаковке из ПВХ плёнки с инструкцией по применению помещают в пачку картонную.
Хранение
Замороженный препарат
Хранить в защищённом от света месте, при температуре не выше минус 18 °C. Повторное замораживание не допускается.
Хранить в недоступном для детей месте.
Жидкий препарат
Хранить в защищённом от света месте, при температуре от 2 до 8 °C. Не замораживать.
Хранить в недоступном для детей месте.
Условия транспортирования
Замороженный препарат
При температуре не выше минус 18 °C.
Для флаконов по 0,5 мл производства ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), флаконов по 3,0 мл производства АО «ГЕНЕРИУМ», ЗАО «ЛЕККО», ОАО, «Фармстандарт-УфаВИТА» и ампул по 0,5 мл производства ОАО «Фармстандарт-УфаВИТА» допускается повышение температуры не выше минус 10 °C не более 3 суток.
Жидкий препарат
При температуре от 2 до 8 °C. Не замораживать.
Срок годности
Замороженный препарат
Производственная площадка ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия:
Компонент Ⅰ — 1 год. Компонент Ⅱ — 1 год.
Производственные площадки АО «Биннофарм», Россия, АО «ГЕНЕРИУМ», Россия, ЗАО «БИОКАД», Россия, ЗАО «ЛЕККО», Россия, ОАО «Фармстандарт-УфаВИТА», Россия, АО «Р-Фарм», Россия:
Компонент Ⅰ — 6 месяцев. Компонент Ⅱ — 6 месяцев.
Производственная площадка ООО «СПУТНИК ТЕХНОПОЛИС», Россия:
Компонент Ⅱ — 6 месяцев.
Не применять по истечении срока годности.
Жидкий препарат
Компонент Ⅰ — 2 месяца. Компонент Ⅱ — 2 месяца.
Не применять по истечении срока годности.
Условия отпуска: для лечебно-профилактических учреждений.
Производитель
Наименования и адреса производственных площадок производителя лекарственного препарата:
Выпускающий контроль качества
Филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Россия, 123098, г. Москва, улица Гамалеи, д. 18.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителя:
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России).
Россия. 123098. г. Москва, улица Гамалеи, д. 18.
Тел: 8 499-193-30-01, факс: 8 499-193-61-83.