аллоиммунизация что это такое
Аллоиммунизация лимфоцитами
Метод аллоиммунизации лимфоцитами партнера призван помочь тем семейным парам, которые потеряли последнюю надежду и отчаялись иметь детей. О бесплодии супружеской пары принято говорить, когда беременность не наступает в течение года. Причин бесплодия много: анатомические, воспалительные заболевания, гормональные нарушения, иммуноллогические факторы.
Иммунологическое бесплодие возникает, когда супруги похожи по антигенам совместимости.
Если имеется иммунологическое сходство между партнерами, то состояние иммунологической толерантности не развивается. Это может стать препятствием для возникновения и вынашивания беременности.
Решить эту проблему можно при помощи метода лимфоцитотерапии или по другому он называется метод аллоиммунизации лимфоцитами партнера.
Показание к использованию медицинской технологии:
Женщины репродуктивного возраста с бесплодием неясного генеза
Сущность метода заключается в 3-кратном подкожном введении возрастающих доз мононуклеарных клеток, выделенных из крови партнера, с учетом менструального цикла женщины. Аллогенные лимфоциты вводят подкожно в межлопаточную область. Процедура несложная, безболезненная и хорошо переносится женщинами. Считается, что после теретьей, последней иммунизации индуцированная толерантность может сохраняться в течение года и женщина может забеременеть. С момента введения лимфоцитов партнера начинается процесс формирования толерантности, благодаря чему оптимизируется работа иммунной системы женщины. Она начинает работать «по правилам». Правильно реагировать на мужские антигены, вырабатывать блокирующие факторы для мимикрии и дальнейшего сохранения плода, формируя условия толерантности к растущему эмбриону.
Аллоиммунизация проводится 1 раз в месяц со 2 по 9 дн. МЦ (по предварительной записи тел.: 59-39-57)
Механизм иммунокорригирующего действия аллоиммунизации:
• Усиление HLA сигнала в 10000 раз (Human Leucocyte Antigens (HLA): человеческие лейкоцитарные антигены; антигены тканевой совместимости; антигены гистосовместимости. HLA обеспечивает регуляцию иммунного ответа, контролируя такие важнейшие физиологические функции, как взаимодействие иммунокомпетентных клеток организма, распознавание клеток, запуск и реализация иммунного ответа.)
• Индукция иммунного ответа на аллоантигены партнера
• Усиление пролиферативной активности клеток
• Переключение иммунного ответа в сторону Th2,3 типа
• Усиление продукции Th2/противовоспалительных цитокинов
• Усиление генерации Т- регуляторных клеток
• Формирование иммунологической толерантности к аллоантигенам партнера
Процедура проводится при отсутствии противопоказаний:
— Тяжелые аутоиммунные заболевания, в том числе антифосфолипидный синдром.
— Тромбофилии, ст. декомпенсации.
— Острые инфекционные заболевания.
— Вакцинация против кори и др. инфекций в течение 4-6 недель.
Обследование перед проведением аллоиммунизации:
Перед проведением процедуры необходимо:
— Обследование супругов на наличие ВИЧ-инфекции, сифилиса, вирусных гепатитов (давность не более 3 мес.)
— Иммунологическое обследование (СКЛ)
— спермограмма с морфологией (фрагментация ДНК сперматозоидов), тестостерон, ФСГ, пролактин
— фолликулометрия (овуляторные циклы)
— проходимость маточных труб
— уровень продукции репродуктивных гормонов и гормонов щитовидной железы
— уровень антифосфолипидных антител, анти-ХГЧ антител
— исключить гиперплазию эндометрия, эндометриоз
© ООО «Авиценна», 2011 – 2021
Лицензия № ЛО-72-01-002935 от 16.11.2018 г. на осуществление Медицинской деятельности.
Аллоиммунизация (Лимфоцитотерапия) лимфоцитами партнера в лечении иммунного бесплодия
В.М.ЧЕРВИНЕЦ д.м.н., профессор, зав. кафедрой Микробиологии и вирусологии с курсом иммунологии Тверского ГМУ, г. Тверь
В последние годы в экономически развитых странах наблюдается рост бесплодных браков, в том числе форм, обозначенных как «бесплодие неясного генеза», причины которого связывают с иммунными дисфункциями. Иммунные нарушения проявляются наличием антител против различных антигенных детерминант собственных тканей (антифосфолипидных и антинуклеарных антител, антител к половым гормонам) или сперматозоидов, что может оказывать неблагоприятное влияние на имплантацию эмбриона и вынашивание беременности [1]. Кроме того, причина бесплодия может быть обусловлена нарушением иммунных механизмов, участвующих в формировании толерантности к фетальным аллоантигенам. На это указывают многочисленные данные о нарушении Th1/Th2 баланса [2, 3], снижении количества регуляторных Т-клеток [4] и ослаблении толерегоненной активности ДК [5, 6] у женщин с привычным невынашиванием беременности (ПНБ). Поиск биомаркеров, ассоциированных с бесплодием иммунного генеза, активно ведется во всем мире, однако найти универсальный параметр, позволяющий диагностировать данную патологию, до сих пор не удается, что, видимо, обусловлено патогенетической разнородностью иммунных нарушений.
Еще в 1958 г. Payne и Rolfs обнаружили, что в крови не единожды рожавших женщин содержатся аллореактивные антитела, вызывающие агглютинацию отцовских лейкоцитов [7]. Антитела против отцовских лимфоцитов получили название блокирующих факторов (БФ) [8].
Большинство авторов подчеркивают высокую эффективность АИЛ в лечение ПНБ 18.
По данным Хониной Н.А., и соавт. 2010, 2013, дефицит БФ являлся наиболее частым нарушением, выявляемым у преобладающего большинства женщин, как при вторичном, так и первичном бесплодии. Причем в половине случаев отсутствие БФ не было ассоциировано с низким пролиферативным ответом в СКЛ, отражающим сходство партнеров по HLA-антигенам [25, 26].
При исследовании женщин с первичным (90 женщин в среднем возрасте 34,4±2,6 лет) и вторичным (97 женщин 35,3±2,5 лет) бесплодием Хонина Н.А. с соавт, 2015 г., установила отсутствие активности БФ. После проведения курса АИЛ наличие БФ в обеих группах регистрировалось у 75% женщин.
Клиническая эффективность оценивалась по исходам беременности. Наступление беременности регистрировали в течение 12 месяцев после проведения АИЛ. (Таблица 3). В целом у женщин с первичным бесплодием беременность наступила в 44% случаев (40 из 90), и в 40% (36/90) завершилась родами.
У женщин с вторичным бесплодием (ПНБ) беременность наступила у 88,8% (87 из 97) женщин и завершилась родами у 65,5% (57 из 87), что было достоверно чаще, чем при первичном бесплодии (65,5% vs 40%; χ2=0,05).
При этом успешная беременность у женщин с наличием БФ была достоверно выше, чем у женщин с отсутствием БФ (28 против 70,4%).
Проведенные исследования показали, что независимо от того, является ли бесплодие первичным или вторичным, в обоих случаях АИЛ сопровождается эффективной генерацией БФ у большей части (74-75%) женщин.
И хотя появление методов вспомогательных репродуктивных технологий позволило существенно продвинуться в терапии первичного бесплодия, лечение данной патологии представляет существенные трудности. Поэтому полученный результат, на наш взгляд, свидетельствует о перспективности применения АИЛ для лечения инфертильности у женщин данной категории.
Еще одним важным моментом настоящего исследования явились данные, подтверждающие значительную роль БФ в обеспечении успешной беременности. Как при первичном бесплодии, так и в группе с ПНБ частота родов у женщин с наличием БФ превышала таковую в группах с дефицитом БФ, соответственно, в 5,5 и 2,5 раза. Генерация БФ после проведения АИЛ у женщин с привычным невынашиваением является хорошо известным фактом [19, 20]. В то же выявление взаимосвязи между успешной беременностью и появлением БФ на фоне первичного бесплодия продемонстрировано нами впервые.
Таким образом, будучи одной из давно разработанных технологий, метод аллоиммунизации (лимфоцитотерапии) отцовскими лимфоцитами в сопровождении иммунологического мониторинга может занять определенную нишу в лечении бесплодия, причем не только вторичного, но и первичного генеза.
1. Shetty S, Ghosh K. Anti-phospholipid antibodies and other immunological causes of recurrent foetal loss—a review of literature of various therapeutic protocols//Am J Reprod Immunol.-2009.- Vol. 62.-P.19-24.
2. Gharesi-Fard B., Zolghadri J, Haghbin H.. Soluble CD30 (sCD30) and effectiveness of leukocyte therapy in recurrent pregnancy loss patients//J Reprod Immunol.–2013.-Vol.97.-P.240-244.
3. Mjösberg J., Berg G., Jenmalm M.C., Ernerudh J. FOXP3+ regulatory T cells and T helper 1, T helper 2, and T helper 17 cells in human early pregnancy deciduas//Biol Reprod.-2010.-Vol.82.-P.698-705.
4. Winger EE, Reed JL. Low circulating CD4+CD25+Foxp3+ T regulatory cell levels predict miscarriage risk in newly pregnant women with a history of failure//Am J Reprod Immunol.-2011.-Vol.66.-P.320-328.
5. Askelund K., Liddell H.S., Zanderigo A.M., Fernando N.S., Khong T.Y., Stone P.R., Chamley L.W. CD83dendritic cells in the decidua of women with recurrent miscarriage and normal pregnancy// Placenta 2004.-Vol. 25.-P.140–145.
6. Martínez F.F., Knubel C.P., Sánchez M.C., Cervi L., Motrán C.C. Pregnancy-specific glycoprotein 1a activates dendritic cells to provide signals for Th17-, Th2-, and Treg-cell polarization//Eur J immunol.-2010.- Vol.42. –P.1573-1584.
7. Payne R., Rolfs M.R. Fetomaternal leukocyte incompatibility//J Clin Invest.-1958.-Vol.37.-P.1756–1763.
8. Pandey M.K., Agrawal S. Induction of MLR-Bf and protection of fetal loss: a current double blind randomized trial of paternal lymphocyte immunization for women with recurrent spontaneous abortion// International Immunopharm.-2004.- Vol.4.-P.289-298.
9. Agarwal S., 17 R., Halder A, Sharma R.K., Agarwal S.S. Outcome of pregnancy in women with recurrent spontaneous abortion following immunotherapy with allogeneic lymphocyes//Hum reprod.-1995.-Vol.10.-P.2280-2284.
10. Aoki K., Kajiura S., Matsumoto Y., Yagani Y. Clinical evaluation of immunotherapy in early pregnancy with X-irradiated paternal cells for primary and recurrent aborters//Am J Obstet Gynecol.-1993.-Vol.169.-P.649-653.
11. Beer AE, Quebbeman JF, Ayers JW, Haines RF. Major histocompatibility complex antigens, maternal and paternal immune responses, and chronic habitual abortions in humans//Am J Obstet Gynecol.-1981.- Vol.141.-P.987-99.
12. Kishore R, Agrawal S, Halder A, Das V, Shukla B. R. HLA sharing, anti-paternal cytotoxic antibodies and MLR blocking factors in women with recurrent spontaneous abortion.//J Obstet Gynaecol Res. – 1996. – Vol.22. – P.177–183.
14. Clark D.A. Cell surface CD200 may predict efficacy of paternal mononuclear leukocyte immunotherapy in treatment of human reccurent pregnancy loss//Am J Reprod Immunol.- 2009.-Vol.61.-P.75-84.
16. Khonina N.A., Broitman E.V., Shevela E.Y., Pasman N.M., Chernykh E.R. Mixed lymphocyte reaction blocking factors (MRL-Bf) as potential biomarker for indication and efficacy of paternal lymphocyte immunization in recurrent spontaneous abortion//Arch Gynecol Obstet.-2013.- DOI 10.1007/s00404-013-2832-x.
17. Kim D. Ly, Aziz N., Safi J., Agarwal A. Evidence-Based Management of Infertile Couples with Repeated Implantation Failure Following IVF//Current Women’s Health Reviews.-2010.-Vol.6.-P.200-218.
18. Kling C., Schutzler A., Wilke G. Two-year outcome after recurrent implantation failure: prognostic factors and additional interventions//Arch Gynecol Obstet.-2008.-Vol. 278.-P.135-142.
19. Nonako T., 36 K., Ooki I. Results of immunotherapy for patients with unexplained primary recurrent abortions – prospective non-randomized cohort study// Am. J. Reprod. Immunol.-2007.-Vol.58.-P.530-536.
20. Pandey M.K., Halder A., Agarwal S., Srivastava M., Agarwal S.S., Agrawal S. Immunotherapy in recurrent spontaneous abortion: randomized and non-randomized trials//Internet J Gynecol Obstetrics.-2006.- ISSN:1528-8439.
21. Porter N.F. La Coursiere Y., Scot J.R. Immunotherapy for recurrent miscarriage// Cohrane Database Syst Rev.-2006.-CD 000112.
22. The practice Committee of the American Society for Reproductive Medicine. Effectiveness and treatment for unexplained infertility//Fertil. Steril.-2006.-Vol.86.- P.111-114.
23. Kling C., Steimann J., Westphal E., Magez J., Kabelitz D. Adverse effects of intradermal allogeneic lymphocyte immunotherapy: acute reactions and role of autoimmunity//Hum Reprod.-2006.-Vol. 21.-P.429-435.
24. Pandey M.K., Agrawal S. Induction of MLR-Bf and protection of fetal loss: a current double blind randomized trial of paternal lymphocyte immunization for women with recurrent spontaneous abortion// International Immunopharm.-2004.- Vol.4.-P.289-298.
26. Khonina N.A., Broitman E.V., Shevela E.Y., Pasman N.M., Chernykh E.R. Mixed lymphocyte reaction blocking factors (MRL-Bf) as potential biomarker for indication and efficacy of paternal lymphocyte immunization in recurrent spontaneous abortion//Arch Gynecol Obstet.-2013.- DOI 10.1007/s00404-013-2832-x.
27. Pandey M.K., Thakur S, Agarwal S. Lymphocyte immunotherapy and its probable mechanism in the maintenance of pregnancy in women with recurrent spontaneous abortion// Arch. Gynecol. Obstet.- 2004.- Vol. 269, N 3.- P. 161-172.
28. Pandey M.K., Rani R., Agrawal S. An update in recurrent spontaneous abortion//Arch Gynecol Obstet.-2005.- Vol.272.-P. 95-108.
29. Wegener S., Schnurstein K., Hansch S.,Briese V., Busecke A., Müller H. Immunotherapy with Paternal Lymphocytes for Recurrent Miscarriages and Unsuccessful in vitro Fertilization Treatment// Transfusion Med Hemother.-2006.- Vol.33.-P. 501-507.
30. Wilczyński JR, Radwan P, Tchórzewski H, Banasik M. Immunotherapy of patients with recurrent spontaneous miscarriage and idiopathic infertility: does the immunization-dependent Th2 cytokine overbalance really matter?//Arch Immunol Ther Exp.- 2012.-Vol.60.-P.151-160.
31. Yokoo T., 36 K., Ooki I., Kikuchi A. Tamura M., Tanaka K. Alteration of TH1 and TH2 cells by intracellular cytokine detection in patients with unexplained recurrent abortion before and after immunotherapy with the husband’s mononuclear cells//Fertil Steril.-2006.-Vol. 85.-P.1452-1458.
Лимфоцитотерапия (ЛИТ) — метод аллоиммунизации лимфоцитами партнера
Что из себя представляет этот метод?
Женщине вводят клетки (лимфоциты), взятые из крови ее супруга. Лимфоциты вводят подкожно в межлопаточную область со 2 по 10 день менструального цикла. Процедура хорошо переносится женщинами. Через 30 дней процедуру последовательно повторяют трижды.
Рекомендовано 3 инъекции в течение 3-х месяцев для выработки защитных, блокирующих факторов, сохраняющих плод.
Эта методика используется не только для женщин, которые пытаются забеременеть естественным путем, но и после неудачных попыток ЭКО. И в этой ситуации половина женщин в результате аллоимунизации получают желанную беременность.
Мне вводили очищенную кровь мужа уже беременной, на раннем сроке. Делали 3 инъекции. перерыв между ними составлял 3 недели.
В нашем городе, Барнауле, данную процедуру проводят в Железнодорожной больнице, в кабинете плазмафереза.
Сама процедура стоит недорого: в мае-июне 2015 года один укол стоил 510 руб.
Перед тем, как муж сдавал кровь для очистки, он должен был сдать следующие анализы:
Муж сдавал предварительно анализы там же. Сдавал платно. Каждый раз на это уходило 1195 руб. И так 3 раза, потому что анализы действительны лишь в течение 10 дней, а промежуток между уколами составлял 3 недели.
Как у нас проходила эта процедура?
Сначала утром, перед работой, (с 8 до 9) в больницу ехал муж, сдавал 40 мл крови, которую затем очищали.
Через несколько часов, ближе к обеду, в больницу приезжала я. Оплачивала и шла в кабинет плазмофереза, где мне ставили около 10 уколов в предплечье (в интернете я нашла разную информацию о месте уколов: ставят и в межлопаточную область, и на внутренней стороне руки). Вводили всего 1 кубик очищенной лимфы мужа. Было абсолютно не больно. Затем место уколов заклеивали специальным пластырем, который можно было снять вечером после мытья.
В первый раз меня предупредили, что место уколов может зудеть и чесаться, доставлять дискомфорт. У меня никакого дискомфорта не было. Лишь было неприятно, когда я задевала предплечьем о ткань спинки дивана, когда спала.
Как я уже писала выше, всего мне было сделано 3 укола с перерывом между ними в 3 недели.
В итоге в декабре 2015 года у нас родился сын.
Рекомендовать/не рекомендовать процедуру ЛИТ я не вправе: это должен сделать ваш лечащий врач. Я просто рассказала про свой опыт.
Но, если у вас есть показания к проведению этой процедуры, то не отказывайтесь: это не больно и не долго. Ради того, чтобы на свет появился долгожданный малыш, пойдёшь на многое, и оно того стоит.
Иммунологическое бесплодие: лечение, диагностика и причины
Наталья Алексеевна Хонина
Врач иммунолог-репродуктолог, доктор медицинских наук, ведущий научный сотрудник института фундаментальной и клинической иммунологии, профессор НГУ, НОВОСИБИРСК.
Впоследние годы во многих странах мира увеличивается число пар с бесплодием в браке. Это одна из главных проблем репродуктивной медицины. Ухудшение экологии, раннее начало половой жизни, хронические урогенитальные воспалительные заболевания, снижение иммунитета приводят к нарушениям репродуктивной функции. Появление методов вспомогательных репродуктивных технологий, в том числе экстракорпорального оплодотворения (ЭКО), позволило повысить эффективность лечения женского и мужского бесплодия. Однако, несмотря на все достижения медицины, неудачные исходы ЭКО составляют, по разным данным, от 50 % до 70 %.
Наиболее частыми причинами бесплодия у женщин считаются трубно-перитонеальный фактор, эндокринные расстройства, анатомические дефекты репродуктивных органов. У мужчин часто выявляется уменьшение доли наиболее активных и морфологически правильно сформированных сперматозоидов.
У 10–15 % бесплодных пар не удается выявить объективных причин нарушений репродуктивной функции, и в таких случаях выставляется диагноз бесплодия «неясного генеза».
Многие специалисты предполагают, что зачастую причина такого бесплодия — нераспознанные иммунные нарушения. Конечно, они могут сочетаться с другими формами бесплодия, например, с воспалительными процессами и эндокринной патологией.
Возможные нарушения, приводящие к иммунологическому бесплодию у женщин:
Иммунные нарушения могут приводить к дефекту имплантации эмбриона даже при хороших эмбриологических показателях, что остается неразрешимой задачей при экстракорпоральном оплодотворении.
В чем же причина того, что иммунная система матери отторгает плод? Еще в середине прошлого века известный английский ученый Питер Брайан Медавар назвал плод «аллотрансплантатом в организме матери», то есть наполовину чужим ей «органом». Действительно, эмбрион несет чужие для матери антигены отца и, по всем законам иммунологии, должен быть отторгнут. В большинстве случаев этого не происходит, потому что иммунная система матери существенно изменяется. Формируется иммунологическая толерантность к антигенам плода. Это совершенно необходимое условие для имплантации и дальнейшего развития эмбриона. Аллоантигенраспознающие Т-лимфоциты матери перестраиваются и позволяют прижиться наполовину чужому эмбриону. Однако в некоторых случаях иммунная система матери бывает слишком агрессивна к эмбриону, либо эмбрион не защищен специфическими АТ либо факторами, которые прикрывают его от иммунного надзора материнского организма.
Ключевая функция блокирующих факторов, главные из которых АТ, — подавлять активацию тех клеток иммунной системы матери, которые способны распознавать отцовские антигены и отторгать плод. Блокирующие факторы вырабатываются у женщины в ответ на антигены мужчины при регулярной половой жизни партнеров.
Возможные причины недостаточной продукции блокирующих факторов:
Дефицит продукции блокирующих факторов связан с бесплодием. Причем как с первичным бесплодием — когда беременность не наступает, так и с вторичным — когда беременность не развивается или заканчивается выкидышами.
Цитотоксические клетки — друзья или враги?
Другой неблагоприятный фактор для вынашивания беременности — это повышение содержания в сыворотке крови женщины активированных цитотоксических клеток (лимфоцитов). В норме они всегда присутствуют в периферической крови и защищают организм от чужеродных, мутирующих или инфицированных вирусами клеток. Поскольку плод наполовину чужероден для иммунной системы матери, цитотоксические клетки распознают чужие антигены и способны повреждать трофобласт, что приводит к нарушению плацентации и потере плода. С целью снижения повышенного количества цитотоксических клеток рекомендуется использовать терапию иммуноглобулином, который связывается с рецепторами на клетках и, таким образом, препятствует их негативному воздействию.
Новый шаг в лечении иммунологического бесплодия
Для выявления иммунных факторов бесплодия супруги проходят обследование для определения степени их иммунологической совместимости. Кроме HLA-антигенов исследуется содержание блокирующих факторов в сыворотке крови и количество цитотоксических клеток в периферической крови женщины, а также уровень пролиферативного ответа иммунных клеток женщины на лимфоциты партнера. При низком иммунном ответе и недостаточной продукции блокирующих факторов женщине назначается процедура аллоиммунизации лимфоцитами партнера (АИЛ).
В НИИ фундаментальной и клинической иммунологии (Новосибирск) разработана модификация данного метода и получена лицензия на проведение аллоиммунизации лимфоцитами партнера. Лимфоциты, выделенные из крови партнера, вводят подкожно в межлопаточную область женщине. Процедура проводится в соответствии с менструальным циклом пациентки (один раз в цикл) и повторяется от 3 до 6 раз в зависимости от степени восстановления иммунного ответа (по иммунограмме). В лаборатории клеточной иммунотерапии института прошли обучение специалисты из Красноярска, Томска, Тюмени, Челябинска и Твери.
Приближая материнство
Исследования показали, что метод АИЛ обладает выраженным иммунокорригирующим эффектом, повышает эффективность лечения бесплодия как в естественном цикле, так и при экстракорпоральном оплодотворении. За время проведения АИЛ ни в одном центре не было зарегистрировано серьезных осложнений у матери или ребенка.
По нашим данным, при достижении нормативных значений иммунограммы (высокий пролиферативный ответ клеток, достаточная продукция блокирующих факторов, отсутствие высокого содержания цитотоксических клеток) беременность наступает значимо чаще. За период работы в лаборатории было обследовано более 5000 супружеских пар и половине из них проведено лечение по предложенной методике. В итоге беременность наступила у 46 % пар в естественном цикле и у 51 % пар, имеющих 2 и более неудачные попытки ЭКО в анамнезе.
Таким образом, иммунологическое бесплодие — это не повод для отчаяния, а лишь долгий путь к материнству.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Аллоиммунизация что это такое
аллоиммунизация (лимфоцитотерапия), лечение иммунного бесплодия, (выкидыша), предотвращение невынашивания беременности, анализ на цитотоксичность, подготовка к ЭКО.
Используй свой шанс!
Результаты исследования и обсуждение.
Из 118 женщин с самопроизвольными выкидышами в анамнезе, у которых в сыворотке крови отсутствовали БФ, аллоиммунизация (лимфоцитотерапия) лимфоцитами партнера была проведена 82 женщинам, 36 женщинам терапия не проводилась.
Появление блокирующих факторов после 1-го курса аллоиммунизации (лимфоцитотерапии) было зарегистрировано у 55 из 82 женщин (67%). У 27 женщин отсутствие БФ сохранялось, и таким женщинам был проведен второй курс АИЛ. В результате позитивный эффект был зарегистрирован у 9 из 27 женщин (33%). Таким образом, по завершению 2 курсов АИЛ у 78% женщин регистрировались сывороточные БФ. Для дальнейшего исследования группа 1 была разделена на подгруппы в зависимости от наличия БФ. В подгруппу 1А включили женщин с позитивным результатом лечения (n=64, БФ+), в подгруппу 1В вошли женщины с отсутствием БФ после 2-х курсов АИЛ (n=18, БФ-). При оценке клинической эффективности в указанных группах учитывали наличие срока беременности более 20 недель. Аналогичный опрос был проведен в контрольной группе женщин (группа 2), которым АИЛ не проводилась. После 1 курса АИЛ беременность наступила и прогрессировала у 26 из 55 женщин (47,3%), после 2 курса у 4 из 9 женщин (44,4%).
В целом по группе 1А у женщин с нормативными значениями БФ клиническая эффективность составила 46,8%. В группе 1В у женщин с отсутствием БФ после иммунизации беременность регистрировалась у 4 из 18 женщин (22,2%). В контрольной группе женщин (группа 2), которым АИЛ не проводилась, беременность наступила у 6 из 36 женщин (16,6%). Полученные данные показали, что в подавляющем большинстве случаев проведение АИЛ у женщин со спонтанными выкидышами сопровождается появлением в сыворотке крови БФ. Число случаев прогрессирующей беременности было достоверно выше в группе женщин с наличием БФ.
Наши данные согласуются с исследованиями, проведенными Pandy М.К. c cоавторами в США и Nonako Т. с коллегами из Японии, которые также показали высокую эффективность аллоиммунизации (лимфоцитотерапии) лимфоцитами партнера при привычном невынашивании. В то же время другие исследователи не находят достоверных различий в группе женщин с невынашиванием, которым проводили АИЛ, и контрольных группах [5]. Возможно, данные противоречивые факты обусловлены разным подбором женщин в группы для исследования. В нашей работе, также как в исследованиях Pandy М.К. и Nonako Т., для проведения иммунотерапии отбирали женщин с отсутствием БФ в сыворотке крови. Соответственно результаты лечения оценивали раздельно в группах женщин с наличием и отсутствием БФ. Полученные различия по эффективности АИЛ в группах женщин с наличием и отсутствием БФ после лечения свидетельствует о том, что БФ играют важную роль в поддержании физиологического течения беременности на ранних сроках гестации и препятствуют развитию самопроизвольных выкидышей.
Известно, что физиологическое течение беременности ассоциировано с супрессорной перестройкой Т-клеточного звена иммунной системы, в результате которой доминируют Тh2/противовоспалительные цитокины и повышается содержание регуляторных CD4+CD25+ Т-клеток. В ряде работ показано, что доминирование Тh2-цитокинов, которое индуцируется аллоиммунизацией (лимфоцитотерапией), коррелирует с эффективностью терапии.
Следовательно, представленные данные свидетельствуют о необходимости иммунодиагностики перед проведением аллоиммунизации (лимфоцитотерапии) лимфоцитами партнера и высокой эффективности данного метода иммунотерапии у женщин с синдромом потери плода.
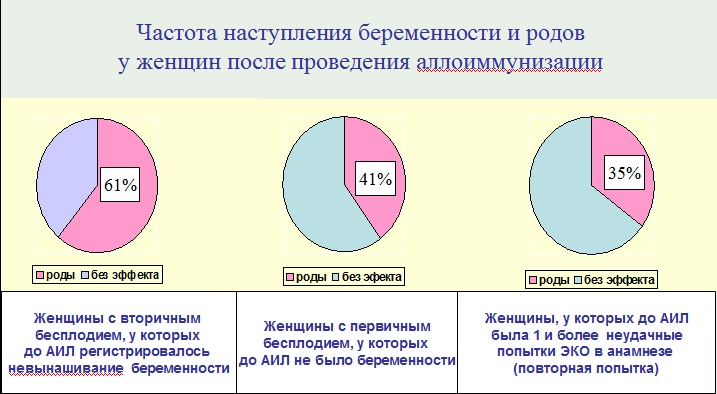
Показатель эффективности АИЛ в группах женщин с бесплодием