алт аст и щелочная фосфатаза повышена что это значит
Щелочная фосфатаза в крови – норма и причины отклонения от нормы
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/10/Щелочная-фосфатаза-в-крови-–-норма-и-причины-отклонения-от-нормы.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/10/Щелочная-фосфатаза-в-крови-–-норма-и-причины-отклонения-от-нормы.jpg?fit=825%2C550&ssl=1″ />
Щелочная фосфатаза – важный фермент в организме человека.
Если у пациента есть признаки заболевания печени или проблемы с костями, врач может назначить тест на щелочную фосфатазу (ЩФ), чтобы измерить количество фермента в крови и диагностировать проблему.
Что показывает щелочная фосфатаза?
В организме человека происходят многие биохимические процессы, в том числе реакция дефосфорилирования. В этом случае фосфорная кислота отделяется от органических эфирных соединений, участвуя в кальций-фосфорном обмене. Этот процесс происходит в присутствии фермента щелочная фосфатаза.
Щелочная фосфатаза – это фермент, обнаруженный во многих тканях организма. Но в основном она сконцентрирована в клетках печени, костях, плаценте. Основной объем приходится на слизистую кишечника.
Щелочная фосфатаза представлена в организме 11 изоферментами. Для определения причины повышенной щелочной фосфатазы необходимо также определить ее изоферменты, специфичные для определенных тканей:
Щелочная фосфатаза вырабатывается верхним слоем слизистой оболочки кишечника, но только вторично участвует в пищеварительных процессах. Основная функция щелочной фосфатазы – дефосфорилирование, то есть отделение фосфорной кислоты от фосфорсодержащих соединений. Этот фермент также способствует транспортировке фосфора по организму.
Фермент называют «щелочным», потому что он проявляет наибольшую активность в щелочной среде с pH в диапазоне от 8,6 до 10,1.
Соблюдение содержания щелочной фосфатазы отражает метаболическую эффективность фосфора и кальция в организме.
Щелочная фосфатаза у детей – норма, причины отклонения от нормы
Контрольные значения для теста на щелочную фосфатазу меняются в зависимости от возраста из-за роста.
Нормальный уровень щелочной фосфатазы в плазме зависит от возраста и пола. Норма для детей и подростков:
Уровень этого фермента в сыворотке крови может незначительно отличаться в зависимости от используемых методов тестирования и реагентов.
В педиатрической практике исследование активности щелочной фосфатазы играет важную роль в диагностике заболеваний печени, что дополняется снижением оттока желчи в двенадцатиперстной кишке. Кроме того, уровень щелочной фосфатазы в крови ребенка часто повышен. Высокий уровень фосфатазы нарушает отток желчи из-за камней в желчных протоках или опухолей желчных протоков.
Ребенку с повышенной щелочной фосфатазой врач может поставить следующие диагнозы:
Большое значение у детей имеет показатель щелочной фосфатазы в ранней диагностике рахита. В этом случае активность фермента увеличивается задолго до появления клинических симптомов заболевания.
Иногда происходит физиологическое, то есть естественное, повышение уровня щелочной фосфатазы в сыворотке крови: у недоношенных детей или подростков в период полового созревания и интенсивного роста костей.
Лекарственные препараты с побочными гепатотоксическими эффектами могут также повышать уровень фермента щелочной фосфатазы у ребенка. К таким препаратам относятся парацетамол, пенициллины, сульфаниламиды, эритромицин и многие другие. Повышенный метаболизм в костной ткани во время заживления переломов костей часто увеличивает уровень этого фермента.
Снижение уровня фермента щелочной фосфатазы не имеет клинического значения. Снижение уровня ферментов может происходить при различных нарушениях роста костей, дефиците цинка, магния, витаминов C и B12 в пище, анемии и гипотиреозе, а также в редких случаях врожденной гипофосфатазии.
Как уменьшить щелочную фосфатазу?
Чтобы уровень щелочной фосфатазы у ребенка был нормальным, необходимо вылечить основное заболевание, а не просто довести его до нормы.
Активность щелочной фосфатазы у детей всегда выше, чем у взрослых. В некоторых случаях повышенная активность фосфатазы – единственный признак злокачественного новообразования печени. Именно поэтому так важно провести все необходимые клинические испытания и вовремя начать лечение ребенка, чтобы оно привело к скорейшему выздоровлению.
Щелочная фосфатаза у взрослых – норма, причины отклонения от нормы
Тест на определение уровня фермента в крови проводится в следующих случаях:
После шестнадцати лет количество щелочной фосфатазы начинает снижаться. Но диапазон его нормальной концентрации все же достаточно широк.
При наступлении зрелого и солидного возраста уровень ферментов снова повышается и должен быть (ед / л):
У взрослых значения количества щелочной фосфатазы незначительно различаются в зависимости от пола, для мужчин норма на 20-25 ед / л выше, чем для женщин того же возраста:
Аномальная щелочная фосфатаза – причины
Причины повышения уровня щелочной фосфатазы можно сгруппировать следующим образом:
III. Прочие патологии:
Превышение нормы фермента не всегда указывает на тип заболевания. Может быть, человек здоров и рост щелочной фосфатазы обусловлен физиологическими свойствами. Поэтому необходимо провести дополнительные анализы, чтобы определить точные причины.
Уровень щелочной фосфатазы ниже нормы
Понижение содержания фермента может сигнализировать о появлении или наличии в организме опасных заболеваний.
Причины снижения содержания ферментов:
В каких случаях проводится анализ крови на щелочную фосфатазу?
В клинической практике уровни щелочной фосфатазы приобретают важное диагностическое значение только в сочетании с другими лабораторными и инструментальными исследованиями. Поэтому пациентам обычно сдают биохимический анализ крови, который включает щелочную фосфатазу.
Это исследование показано всем амбулаторным и стационарным пациентам с нарушениями функции печени, почек, пищеварения и эндокринной системы. В настоящее время в большинстве случаев они ограничиваются определением общего уровня щелочной фосфатазы, поскольку фракционный анализ, хотя и более информативный, очень дорог и проводится только в специализированных лабораториях.
Как проводится анализ на щелочную фосфатазу?
Чтобы получить правильный результат теста, нужно соблюдать следующие правила:
Обычно результаты анализов готовы через 1 – 2 дня.
Особенности определения щелочной фосфатазы
Для анализа используется сыворотка крови. В большинстве случаев берут верхний слой, образовавшийся в трубке сепаратора. Активность этого фермента может незначительно отличаться при хранении образцов крови при комнатной температуре. Гемолиз in vitro не влияет на результаты анализа.
Что делать при аномальном уровне щелочной фосфатазы?
При лечении следует указывать этиологическое направление. При заболеваниях печени или желчевыводящих путей стоит обратиться к гастроэнтерологу. Наличие холестаза, панкреатита, алкогольного гепатита или цирроза печени требует соответствующей медицинской коррекции, размер которой определяет только врач. Самолечение в этом случае может обострить основное заболевание.
Изменения уровней ферментов, в том числе щелочной фосфатазы, могут наблюдаться при сердечной недостаточности, раке и серьезных проблемах с почками, а также при диабете, поэтому следует проконсультироваться с кардиологом, нефрологом или эндокринологом. Врач определяет лечебную тактику в зависимости от клинической картины.
За счет устранения этиологических факторов нормализуется активность щелочной фосфатазы. При назначении терапии следует учитывать, что, например, физиологическое повышение этого показателя возможно при переломах, активном росте скелета и вынашивании плода. Это не требует медицинского вмешательства. Интерпретацию результатов лабораторного исследования следует проводить комплексно с учетом других биохимических показателей и жалоб пациентов.
Добавить комментарий Отменить ответ
Вы должны быть авторизованы, чтобы оставить комментарий.
Алт аст и щелочная фосфатаза повышена что это значит
Щелочная фосфатаза – группа ферментов, содержащихся практически во всех тканях организма, с преимущественной локализацией в печени, костях и плаценте. Фосфатазы в клетках участвуют в реакциях отщепления остатка фосфорной кислоты от ее органических соединений. Активность общей щелочной фосфатазы повышается при целом ряде заболеваний, сопровождающихся повреждением ткани печени, костей, почек и других органов.
ALK PHOS, ALP, ALKP, alkaline phosphatase.
Кинетический колориметрический метод.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Щелочная фосфатаза – фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимических реакций в этих клетках (в кровеносном русле он не работает). При разрушении этих клеток их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность щелочной фосфатазы. Если гибнет много клеток, она может повышаться очень значительно.
Желчь образуется в клетках печени и выделяется по системе внутрипеченочных желчевыводящих канальцев. Они затем объединяются в печеночные протоки, которые выходят за пределы печени и образуют общий желчный проток, впадающий в тонкий кишечник.
Желчь необходима для всасывания жиров, поступающих с пищей. Также посредством желчи выделяются некоторые лекарственные вещества. Она образуется постоянно, но поступает в кишечник только во время и после приема пищи. Когда она не нужна, она накапливается в желчном пузыре.
Активность щелочной фосфатазы сильно увеличивается при препятствиях оттоку желчи, например камнях в желчных протоках. Такой застой желчи называется холестазом.
В костях щелочная фосфатаза образуется в специальных клетках – остеобластах, которые играют важную роль в формировании и обновлении костной ткани. Чем выше активность остеобластов, тем выше активность щелочной фосфатазы в крови, поэтому у детей и лиц, перенесших переломы костей, активность щелочной фосфатазы на высоком уровне.
Щелочная фосфатаза также содержится в клетках кишечника и плаценты.
Для чего используется исследование?
Обычно данный тест назначают для выявления заболеваний печени или костей. Кроме того, щелочная фосфатаза повышается при болезнях, затрагивающих желчные ходы, поэтому такой анализ помогает подтвердить закупорку желчевыводящих путей при камнях в желчных протоках или опухолях поджелудочной железы.
Тест на щелочную фосфатазу, а также гамма-глутамилтрансферазу проводится для того, чтобы диагностировать заболевания, поражающие желчевыводящие пути: первичный билиарный цирроз и первичный склерозирующий холангит.
Любые состояния, которые связаны с ростом костей или повышенной активностью костных клеток, повышают активность щелочной фосфатазы. Поэтому анализ на щелочную фосфатазу может использоваться, например, для того, чтобы определить, что произошло распространение опухоли за пределы первичного очага – в кости.
Повторное назначение щелочной фосфатазы используется для контроля за активностью заболеваний, при которых она повышена, или для оценки эффективности лечения.
Когда назначается исследование?
Тест на щелочную фосфатазу может являться частью стандартных диагностических панелей, которые используются при плановых медицинских осмотрах и при подготовке пациента к хирургическому вмешательству. Обычно он также входит в «печеночные пробы», используемые для оценки функции печени.
Это исследование проводят при жалобах пациента на слабость, усталость, потерю аппетита, тошноту, рвоту, боли в животе (особенно в правом подреберье), желтуху, потемнение мочи или осветление кала, кожный зуд.
Кроме того, анализ назначается при симптомах поражений костей: болях в костях, их деформации, частых переломах.
Что означают результаты?
Возраст, пол
Референсные значения
Если показатели, полученные в результате других анализов, таких как тест на билирубин, аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ), тоже повышены, то увеличение активности щелочной фосфатазы в крови, возможно, связано с повреждением печени. Если изменены уровни кальция и фосфора, наиболее вероятная причина повышения щелочной фосфатазы – патология костной ткани.Повышение активности щелочной фосфатазы почти всегда означает поражение или вовлечение в патологический процесс печени, желчевыводящих путей или костей.
Повышенные активности гамма-глутамилтранспептидазы (ГГТ) и 5-нуклеотидазы указывают на то, что повышение ЩФ обусловлено повреждением желчевыводящих путей.
Причины повышения активности щелочной фосфатазы
1. Поражение печени и желчевыводящих путей.
2. Поражение костей.
Причины понижения активности щелочной фосфатазы
Что может влиять на результат?
Активность щелочной фосфатазы иногда повышается и у здоровых лиц, это не обязательно свидетельствует о какой-либо патологии. Чтобы верно интерпретировать изменение активности ЩФ, нужна комплексная оценка результатов остальных анализов, а также других медицинских данных.
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, инфекционист, гематолог, эндокринолог, хирург.
Биохимический анализ крови — важное исследование, которое позволяет по анализу различных микроэлементов в крови оценивать функциональное состояние органов и систем организма человека
Аланинаминотрансфераза (АЛТ, АлАТ, ALT) — это фермент, содержащийся в тканях в печени и высвобождающийся в кровь при ее поражении. Повышенный уровень АЛТ может быть вызван вирусными, токсическими или другими поражениями печени. При вирусных гепатитах уровень АЛТ может колебаться с течением времени от нормальных значений до нескольких норм, поэтому этот фермент нужно контролировать каждые 3-6 месяцев. Принято считать, что уровень АЛТ отражает степень активности гепатита, однако у около 20% больных хроническими вирусными гепатитами (ХВГ) со стабильно нормальным уровнем АЛТ обнаруживается серьезное повреждение печени. Можно добавить, что АлАТ — чувствительный и точный тест ранней диагностики острого гепатита.
Аспартатаминотрансфераза (АСТ, АсАТ, AST) — это фермент, содержащийся я в тканях сердца, печени, скелетной мускулатуры, нервной ткани и почек и других органах. Повышение АСТ совместно с АЛТ у больных ХВГ может свидетельствовать о некрозе клеток печени. При диагностике ХВГ особое внимание нужно обращать на соотношение АСТ/АЛТ, называемое коэффициентом де Ритиса. Превышение АСТ над АЛТ у больных ХВГ может говорить о выраженном фиброзе печени или токсическом (лекарственном или алкогольном) поражении печени. Значительное повышение АсАТ свидетельствует о некрозе гепатоцитов, сопровождающемся распадом клеточных органелл.
Билирубин является одним основных компонентов желчи. Образуется в результате распада гемоглобина, миоглобина и цитохромов в клетках ретикулоэндотелиальной системы, селезенке и печени. Общий билирубин включает в себя прямой (конъюгированный, связанный) и непрямой (неконъюгированный, свободный) билирубин. Считается, что повышение билирубина в крови (гипербилирубинемия) за счет прямой фракции (более 80% общего билирубина составляет прямой билирубин) имеет печеночное происхождение. Такая ситуация характерна для ХВГ. Это также может быть связано с нарушением выведения прямого билирубина вследствие цитолиза гепатоцитов. Увеличение концентрации за счет свободного билирубина в крови может говорить об объемном поражении паренхимы печени. Другой причиной может служить врожденная патология — синдром Жильбера. Также концентрация билирубина (билирубинемия) в крови может повышаться при затруднении оттока желчи (закупорке жёлчных протоков). Во время проведения противовирусной терапии гепатита повышение билирубина может быть вызвано увеличением интенсивности гемолиза эритроцитов. При гипербилирубинемии свыше 30 мкмоль/л появляется желтуха, которая проявляется пожелтением кожных покровов и склер глаз, а также потемнением мочи (моча приобретает цвет темного пива).
Гамма-глутамилтранспептидаза (ГГТ, ГГТП) — фермент, активность которого увеличивается при заболеваниях гепатобилиарной системы (маркер холестаза). Используется при диагностике механической желтухи, холангитов и холециститов. Также ГГТ используют как индикатор токсических поражений печени, вызванных употреблением алкоголя и гепатотоксичных лекарственных препаратов. ГГТ оценивается совместно с АЛТ и щелочной фосфатазой. Этот фермент обнаруживается в печени, поджелудочной железе, почках. Он более чувствителен к нарушениям в тканях печени, чем АлАТ, АсАТ, щелочная фосфатаза и др. Особенно чувствителен к длительному злоупотреблению алкоголем. По крайней мере, пять процессов в печени повышают его активность: цитолиз, холестаз, интоксикация алкоголем, опухолевый рост, лекарственные поражения. При ХВГ стойкое повышение ГГТП свидетельствует либо о тяжелом процессе в печени (цирроз), либо о токсическом воздействии.
Глюкоза (Glucose) используется в диагностике сахарного диабета, эндокринных заболеваний, а также заболеваний поджелудочной железы.
Альбумин (Albumin) — основной белок плазмы крови, синтезируемый в печени Снижение его уровня может указывать патологию печени, вызванную острыми и хроническими заболеваниями. Снижение количества альбуминов свидетельствует о тяжелом поражении печени со снижением ее белковосинтетической функции, что происходит уже в стадии цирроза печени.
Общий белок (Protein total) — суммарная концентрация белков (альбумина и глобулинов), находящихся в сыворотке крови. Сильное понижение общего белка в анализе может свидетельствовать о недостаточности функции печени.
Креатинин является результатом обмена белков в печени. Креатинин выводится почками с мочой. Повышение в крови уровня креатитина может говорить о нарушении нормальной работы почек. Анализ делается перед противовирусной терапией для оценки ее безопасности.
Срок исполнения: 1-2 дня
Щелочная фосфатаза: норма, причины повышенного уровня
Щелочная фосфатаза (ЩФ) — это особое вещество, присутствующее в различных тканях человеческого организма. Соединение принимает участие в жизненно важных процессах. Оптимальная концентрация фосфатазы требуется для полноценной работы многих органов и систем, способствует нормальному самочувствию.
Анализ на уровень ЩФ назначается при разнообразных нарушениях. В их число входят болезни печени, костной ткани, онкологические заболевания. Изменение уровня фосфатазы часто свидетельствует о наличии патологических процессов, требующих обязательного медицинского вмешательства.
Роль вещества в организме
Под щелочной фосфатазой подразумевают комплекс, в составе которого обнаруживается более десяти ферментов. Вещество присутствует в составе клеточных мембран. Основные области образования этого соединения:
Главная функция щелочной фосфатазы — участие в реакции дефосфолирования. При этом происходит отделение фосфора от определенных органических веществ. Также соединение регулирует обмен кальция, способствует нормальному расщеплению желчи.
В процессе жизнедеятельности небольшое количество щелочной фосфатазы поступает в кровь. Концентрация ЩФ позволяет оценивать состояние организма, делать выводы об особенностях протекания физиологических процессов, наличии каких-либо заболеваний.
При исследовании сыворотки крови обнаруживается несколько изоферментов ЩФ. К ним принадлежат костная фосфатаза (вырабатывается остеобластами, способствует минерализации межклеточного вещества костной ткани), кишечная (синтезируется клеточными структурами, выстилающими просвет кишечника), печеночная (состоит из двух изоферментов), плацентарная (вырабатывается у беременных женщин, естественным образом возрастает на поздних сроках). При выполнении анализа определению подлежит суммарная активность ЩФ.
Для определения уровня щелочной фосфатазы берется венозная кровь пациента. Допустимая концентрация этого вещества определяется возрастом и половой принадлежностью обследуемого:
В первый год жизни нормальным уровнем фосфатазы считается 90-518 Ед/л. От 1 до 13 лет он составляет 156-460 Ед/л. В этом возрасте такие показатели являются одинаковыми для мальчиков и девочек.
Причины повышения щелочной фосфатазы
Возрастание уровня щелочной фосфатазы рассматривается как физиологическое явление, характерное для организма недоношенных младенцев, детей, переживающих период быстрого роста. Рост показателей ЩФ также происходит при рахите. Во время такой болезни наблюдаются размягчение костей, деформации грудной клетки и крупных суставов в области нижних конечностей. У женщин количество вещества увеличивается в последнем триместре вынашивания, после наступления менопаузы.
У взрослых пациентов обоих полов высокий показатель фосфатазы может быть связан с развитием ряда заболеваний:
Кроме этого, уровень ЩФ повышается в период заживления костей после полученных переломов. Показатель этого вещества способен выходить за рамки положенной нормы на фоне применения определенных лекарственных средств. К таким препаратам принадлежат Аспирин, Парацетамол, метотрексат, магнезия, некоторые медикаменты с антибактериальными свойствами. Иногда подъем показателя щелочной фосфатазы происходит в результате продолжительного приема повышенных доз витамина C.
С чем связан пониженный уровень?
Недостаточная концентрация ЩФ также обусловлена протеканием некоторых патологий. В список подобных заболеваний входят:
Пониженный уровень щелочной фосфатазы может указывать на недостаток витамина В12, магния или цинка. У представительниц женского пола концентрация вещества иногда падает в результате использовании оральных контрацептивов.
Диагностика и лечение
Прежде чем сдавать кровь для проведения анализа, необходимо поставить врача в известность обо всех принимаемых препаратах. Это позволит избежать получения недостоверного результата.
Полученный биоматериал сразу же отправляется в лабораторию для дальнейшего исследования. Хранение крови недопустимо, поскольку это приводит к изменению показателей ЩФ даже при отсутствии каких-либо патологий в организме обследуемого человека.
Результаты сообщаются спустя 1-2 дня. Пациентам, у которых выявлен ненормированный уровень щелочной фосфатазы, может потребоваться дополнительная диагностика.
Лечение определяется причиной, повлекшей за собой повышение или понижение уровня ЩФ. При обнаружении патологий печени применяются гепатопротекторы, назначается инфузионная терапия. Если имеется кишечная инфекция, возникает потребность в антибиотиках. В случае подтверждения инфекционного мононуклеоза показаны противовирусные средства. Детям с рахитом требуется прием витамина Д. При генетических болезнях, считающихся неизлечимыми, предусмотрена симптоматическая коррекция.
Неалкогольная жировая болезнь печени: клиника, диагностика и лечение
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из самых распространенных заболеваний в гепатологии, приводящим к ухудшению качества жизни, инвалидизации и смерти. В первую очередь, это обусловлено высоким риском прогрессирова
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из самых распространенных заболеваний в гепатологии, приводящим к ухудшению качества жизни, инвалидизации и смерти. В первую очередь, это обусловлено высоким риском прогрессирования НЖБП с развитием неалкогольного стеатогепатита (НАСГ), печеночной недостаточности и гепатоцеллюлярной карциномы. Общая распространенность НЖБП в популяции колеблется от 10 до 40%, тогда как частота НАСГ составляет 2–4% [1, 2, 3].
Эпидемиология и патогенез НЖБП
Понятие НЖБП объединяет спектр клинико-морфологических изменений печени, представленных стеатозом, НАСГ, фиброзом и циррозом, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах (не более 40 г этанола в сутки для мужчин и не более 20 г — для женщин). НЖБП встречается во всех возрастных группах, но наибольшему риску ее развития подвержены женщины в возрасте 40–60 лет с признаками метаболического синдрома (МС) [4, 5].
Патогенез НЖБП тесно связан с синдромом инсулинорезистентности (ИР), вследствие которого в печени накапливаются триглицериды (ТГ) и формируется жировой гепатоз (ЖГ) — первый этап или «толчок» заболевания. В последующем происходит высвобождение из жировой ткани и синтез de novo в гепатоцитах свободных жирных кислот (СЖК), способствующих возникновению окислительного стресса, являющегося вторым «толчком» заболевания и приводящего к развитию воспалительно-деструктивных изменений в печени в виде стеатогепатита [6].
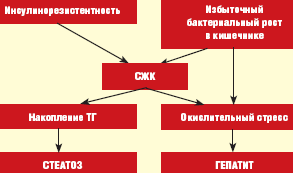
Максимальный риск развития НЖБП отмечен в группе лиц с МС — это пациенты с сахарным диабетом (СД) 2 типа, ожирением, гипертриглицеридемией. Частота НЖБП у больных СД 2 типа и ожирением по данным различных исследований варьирует от 70 до 100%. При этом СД 2 типа или нарушение толерантности к глюкозе (НТГ) отмечаются у 10–75%, ожирение — у 30–100%, гипертриглицеридемия — у 20–92% пациентов с НЖБП [1, 4, 7, 8]. В то же время признаки НЖБП обнаруживаются у 10–15% людей без клинических проявлений МС, что может быть обусловлено другими патогенетическими механизмами формирования НЖБП, например, синдромом избыточной пролиферации бактерий в кишечнике или дисбиозом, как это принято формулировать в отечественной литературе [5, 10].
Основные механизмы развития НЖБП при кишечном дисбиозе связаны с нарушением синтеза апо-липопротеидов классов А и С, являющихся транспортной формой для ТГ в процессе образования липопротеидов очень низкой плотности (ЛПОНП), а также кишечным эндотоксикозом, что позволяет рассматривать это состояние в качестве дополнительного источника окислительного стресса (рис.) [11, 12].
Взаимосвязь патогенеза НЖБП с ИР позволяет считать это заболевание одним из независимых компонентов МС, клиническая значимость которого заключается в значительном прогрессировании атеросклеротического поражения сосудов.
В ряде работ показано, что НЖБП повышает риск возникновения сердечно-сосудистых заболеваний (ССЗ) независимо от других предикторов и проявлений МС [13]. Это подтверждается несколькими фактами, к которым относится связь НЖБП с концентрацией адипонектина в плазме. Известно, что адипонектин обладает антиатерогенным действием и по данным многих проспективных исследований снижение его уровня является ранним предиктором ССЗ и МС. У пациентов с НЖБП была отмечена более низкая концентрация адипонектина в плазме, чем у здоровых лиц [13].
Кроме этого, у указанной категории больных по сравнению с контрольной группой отмечается значительное увеличение толщины интимы (ТИ) сонной артерии, которое также признано достоверным субклиническим признаком атеросклероза. Доказано, что величина ТИ менее 0,86 мм связана с низким риском ССЗ, а более 1,1 — с высоким. У пациентов с НЖБП ее значение составляет в среднем 1,14 мм [14–18].
Другим субклиническим признаком атеросклероза, обнаруженным у больных НЖБП, служит выявление эндотелиальной дисфункции, что подтверждается снижением эндотелийзависимой вазодилатации плечевой артерии у пациентов с НЖБП. При этом уменьшение этого показателя коррелирует со степенью морфологических изменений в печени независимо от пола, возраста, ИР и других компонентов МС [19, 20].
Таким образом, патогенез НЖБП неразрывно связан с МС, а сам факт развития указанной патологии изменяет прогноз для этих пациентов, как в виде прогрессирования печеночной недостаточности, так и в виде значительного увеличения частоты осложнений ССЗ.
Клиника и диагностика
В целом для НЖБП характерно бессимптомное течение, поэтому наиболее часто в практике врач сталкивается со случайно обнаруженным при биохимическом исследовании синдромом цитолиза. При этом пациент с НЖБП, как правило, либо не предъявляет жалоб, либо они являются неспецифичными в виде астеновегетативного синдрома (слабость, утомляемость) и дискомфорта в правом подреберье. Наличие кожного зуда, диспепсического синдрома, наряду с развитием желтухи и портальной гипертензии, свидетельствует о далеко зашедшей стадии НЖБП [2, 3].
При объективном осмотре больных НЖБП обращают на себя внимание гепатомегалия, которая встречается у 50–75%, и спленомегалия, выявляемая у 25% пациентов [4].
При лабораторном исследовании для НЖБП характерны следующие изменения:
Основным дифференциальным отличием ЖГ от НАСГ, доступным в клинической практике, может быть выраженность биохимического синдрома цитолиза.
Следует отметить, однако, что отсутствие изменений лабораторных показателей, характеризующих функциональное состояние печени (АЛТ, АСТ, ЩФ, ГГТП), не исключает наличия воспалительно-деструктивного процесса и фиброза [10].
Как указывалось выше, диагностический поиск проводится в связи с выявлением у больного синдрома цитолиза, при этом наличие у него СД 2 типа, абдоминального ожирения, артериальной гипертензии и нарушения липидного обмена свидетельствует о высокой вероятности НЖБП. Постановка этого диагноза достаточно сложна ввиду необходимости исключения всех других причин, вызывающих цитолиз, макровезикулярный стеатоз и воспалительно-деструктивные изменения в печени. Следует исключить вторичный характер поражения печени (табл. 1) [2].
Для уточнения диагноза могут использоваться инструментальные методы (ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ)), которые позволяют верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии.
УЗИ является недорогим и, по мнению некоторых авторов, достаточно информативным инструментальным методом диагностики стеатоза печени. Выделяют 4 основных ультразвуковых признака стеатоза печени:
К преимуществам УЗИ относится также возможность регистрировать динамику признаков стеатоза, в том числе на фоне лечения [20].
При проведении КТ печени основными признаками, свидетельствующими о наличии стеатоза, являются:
В целом КТ менее информативна, чем УЗИ при диффузных поражениях печени, однако она является методом выбора при очаговых заболеваниях [23].
Преимуществами современной высокопольной МРТ по сравнению с другими методами визуализации являются: высокая тканевая контрастность изображения за счет выгодного соотношения сигнал–шум, возможность получения целостного изображения органа в любой проекции, а также большие ресурсы программного обеспечения, используемые для дифференциальной диагностики.
Однако все визуализационные методы диагностики, несмотря на достаточно высокую информативность, не позволяют оценить наличие признаков стеатогепатита, степень его активности и стадию фиброзных изменений в печени [24, 25]. Поэтому с целью верификации диагноза необходимо проведение пункционной биопсии.
Значение пункционной биопсии печени в клинической практике неоднозначно. С одной стороны, только биопсия печени позволяет провести дифференциальный диагноз между стеатозом и стеатогепатитом, оценить стадию фиброза и на основании гистологических данных прогнозировать дальнейшее течение заболевания, а также исключить другие причины поражения печени. Однако отсутствие информированности врачей о целесообразности, а пациентов о безопасности метода сдерживают активное внедрение пункционной биопсии в практику.
Помимо этого, до сих пор активно обсуждаются морфологические критерии НЖБП. До настоящего времени в практике широко использовалась классификация, предложенная Brunt Е. (1999, 2001), которая подразделяет НЖБП в зависимости от степеней стеатоза, активности воспаления и стадии фиброза печени:
I. Степени крупнокапельного стеатоза:
0 степень: нет стеатоза;
1 степень: стеатоз до 33% гепатоцитов;
2 степень: стеатоз 33–66% гепатоцитов;
3 степень: стеатоз более 66%.
II. Степени НАСГ:
1 степень (мягкий НАСГ) — стеатоз 1–2 степени, минимальная баллонная дистрофия в 3 зоне ацинуса, лобулярное воспаление — рассеянная или минимальная лимфоплазмоцитарная инфильтрация, портальное воспаление отсутствует или минимальное;
2 степень (умеренный НАСГ) — стеатоз любой степени (крупно- и мелкокапельный), умеренная баллонная дистрофия в 3 зоне ацинуса, мягкое или умеренное портальное и лобулярное воспаление в 3 зоне ацинуса, может быть перисинусоидальный фиброз;
3 степень НАСГ (тяжелый НАСГ) — панацинарный стеатоз (смешанный), выраженная баллонная дистрофия, выраженное лобулярное воспаление, мягкое или умеренное портальное воспаление.
III. Стадии фиброза:
1 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный;
2 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный перипортальный фиброз;
3 стадия — очаговый или распространенный мостовидный фиброз;
4 стадия — цирроз печени [26].
Однако, по мнению ряда авторов, эта классификация не отражает целый спектр морфологических признаков, выявляемых у больных НЖБП при гистологическом исследовании. Недавно на основе существующей классификации была разработана и предложена Шкала активности НЖБП (NAFLD activity score — NAS), представляющая комплексную оценку морфологических изменений в баллах и объединяющая такие критерии, как стеатоз (0–3), лобулярное воспаление (0–2) и баллонную дистрофию гепатоцитов (0–2). Сумма баллов менее 3 позволяет исключить НАСГ, а более 5 свидетельствует о наличии у пациента гепатита. Данная шкала используется преимущественно для оценки эффективности лечения НЖБП, поскольку позволяет определить достоверность динамики морфологических изменений на фоне терапии за относительно короткий период времени [27].
В тех случаях, когда выполнение пункционной биопсии невозможно, диагноз НЖБП устанавливается в соответствии с алгоритмом, позволяющим пошагово исключить другие заболевания печени (табл. 2).
В связи с тем, что все пациенты с МС относятся к группе риска развития НЖБП, то больные с ожирением, СД 2 типа или НТГ, нарушением липидного обмена нуждаются в дополнительном обследовании, включающем клинические, лабораторные и инструментальные методы диагностики НЖБП и, в особенности, НАСГ. Однако до настоящего времени НЖБП и ее проявления не входят ни в критерии постановки диагноза МС, ни в алгоритм обследования больных с подозрением на его наличие (табл. 3).
Скрининг больных на стадии доклинических проявлений МС включает:
С учетом частоты, роли и значения НЖБП, в алгоритм обследования больных с МС должны входить клинико-лабораторные и инструментальные методы, позволяющие оценить морфофункциональное состояние печени:
Обязательными показаниями для биопсии являются:
Оценивать течение НЖБП возможно на основании данных гистологического исследования печени. Однако когда выполнение биопсии недоступно, существуют предикторы, позволяющие предположить высокий риск прогрессирования НЖБП с развитием гепатита и фиброза, которые были установлены при проведении статистической обработки результатов большого количества наблюдений [28–30].
Выявление более 2 критериев свидетельствует о высоком риске фиброза печени.
Для формулировки полноценного клинического диагноза необходимо учитывать данные клинико-лабораторного и инструментального обследования, выявление факторов неблагоприятного течения заболевания и других компонентов МС. Поскольку диагноз «неалкогольная жировая болезнь печени» в МКБ-10 (ВОЗ, 1998) пока отсутствует, его формулировка практическими врачами может производиться с учетом правил диагностики алкогольной болезни печени и вирусных гепатитов. В диагнозе на первом месте лучше указывать ту нозологическую единицу, на фоне которой развилась НЖБП, далее идет форма заболевания (гепатоз или НАСГ), степень стеатоза (по данным УЗИ), активность гепатита и стадия фиброзных изменений в печени в случае проведения гепатобиопсии. Если морфологическое исследование не выполнялось, допустимым, как и при других заболеваниях печени, является заключение: неустановленный фиброз. Примеры диагностических заключений:
Лечение НЖБП
В связи с высокой вероятностью неблагоприятного течения НЖБП, особенно в сочетании с другими проявлениями МС, все больные независимо от тяжести заболевания нуждаются в динамическом наблюдении и лечении. Однако до сих пор не разработаны стандартизированные терапевтические подходы к ведению пациентов с НЖБП.
Используемые направления терапии больных НЖБП основываются на механизмах развития заболевания, к которым в первую очередь относятся синдром ИР и окислительный стресс, поэтому наиболее важными задачами у данной категории пациентов являются:
Диета. С учетом современных представлений об этиологии, патогенезе и факторах прогрессирования НЖБП больным рекомендуются следующие диетические принципы:
Для пациентов с избыточной массой тела и ожирением — снижение общей энергетической ценности пищевого рациона. Суточная калорийность подбирается индивидуально в зависимости от массы тела, возраста, пола, уровня физической активности с использованием специальных формул. Сначала рассчитывают количество калорий, необходимых для основного обмена:
18–30 лет: (0,06 × вес в кг + 2,037) × 240
31–60 лет: (0,034 × вес в кг + 3,54) × 240
старше 60 лет: (0,04 × вес в кг + 2,76) × 240
18–30 лет: (0,06 × вес в кг + 2,9) × 240
31–60 лет: (0,05 × вес в кг + 3,65) × 240
старше 60 лет: (0,05 × вес в кг + 2,46) × 240.
Полученное значение умножают на коэффициент физической активности (1,1 — низкая активность, 1,3 — умеренная, 1,5 — тяжелая физическая работа или активное занятие спортом) и получают калорийность суточного рациона. Для снижения массы тела из рассчитанной величины суточных энергозатрат вычитают 500–700 ккал. Однако минимальное потребление калорий в сутки должно быть не менее 1200 ккал для женщин и не менее 1500 для мужчин. Доказано, что снижение массы тела на 5–10% сопровождается уменьшением гепатоспленомегалии, активности АЛТ, АСТ и коррелирует с регрессированием стеатоза печени [4]. Следует учесть, что быстрая потеря веса может привести к развитию «острого» НАСГ с формированием портального фиброза, центральных некрозов на фоне значительного повышения воспалительной активности вследствие увеличения поступления СЖК в печень на фоне периферического липолиза [5, 31]. Для больных ожирением и НЖБП безопасным и эффективным является снижение массы тела на 500 г в неделю для детей и на 1600 г в неделю для взрослых [31].
Кроме этого, всем пациентам с НЖБП рекомендуется:
Физическая нагрузка. Обязательным условием лечения больных НЖБП является физическая нагрузка. Она оказывает положительный эффект на снижение массы тела и чувствительность к инсулину, при этом увеличивается поступление СЖК в мышечную ткань, где происходит их окисление, тем самым уменьшается ИР [4]. Степень снижения ИР, как правило, коррелирует с интенсивностью физических упражнений, которые рекомендуется проводить не менее 3–4 раз в неделю, продолжительностью 30–40 минут.
Повышение чувствительности клеточных рецепторов к инсулину. К базисным медикаментозным средствам лечения синдрома ИР у больных НЖБП могут быть отнесены инсулиновые сенситайзеры — бигуаниды (метформин) и тиазолидиндионы (пиоглитазон, росиглитазон) — препараты, повышающие чувствительность клеточных рецепторов к инсулину. Опыт применения данных лекарственных средств свидетельствует о положительном влиянии на клинико-морфологические проявления НЖБП в виде уменьшения активности показателей цитолитического синдрома, степени стеатоза и воспаления. Но в целом вопрос применения этих препаратов у больных НЖБП требует проведения дальнейших исследований, что обусловлено отсутствием адекватных методов контроля эффективности лечения (гепатобиопсия) в выполненных работах [32].
Гиполипидемические средства. Учитывая патогенез заболевания, у пациентов с НЖБП эффективным может оказаться применение гиполипидемических средств из группы фибратов. Однако результаты исследования с назначением клофибрата больным НЖБП показали его неэффективность [33]. Не следует забывать и о возможности развития фибрат-индуцированных гепатитов. В отношении статинов также существует ряд противопоказаний, связанных с их гепатотоксическим действием. В целом данные выполненных работ противоречивы и указывают на необходимость дальнейшего изучения возможности использования этих препаратов у пациентов с НЖБП.
Пентоксифиллин. Снижение концентрации тумор-некротизирующего фактора-a (TNFa) имеет значение для прогрессирования НЖБП. Обладая высокой биологической активностью, TNFa усиливает ИР и приводит к развитию окислительного стресса. Уменьшение его уровня в крови связано с регрессом клинических и морфологических проявлений НЖБП. Подобный эффект был обнаружен у пентоксифиллина. Назначение этого препарата у пациентов с НАСГ в суточной дозе 1200 мг на протяжении 12 месяцев было связано со снижением показателей цитолитического синдрома и достоверным улучшением гистологических показателей у 67% больных [34].
Антагонисты рецепторов ангиотензина II. Формирование данного подхода обусловлено ролью ангиотензина в прогрессировании НАСГ. Установлено, что он, способствуя пролиферации миофибробластов, клеточной миграции, синтезу коллагена и провоспалительных цитокинов, активирует процессы фиброгенеза в печени. Поэтому в настоящее время исследуется возможность применения блокаторов ангиотензиновых рецепторов у пациентов с НЖБП. Так, прием лозартана у пациентов с НАСГ и артериальной гипертензией в суточной дозе 50 мг в течение 38 недель приводил к достоверному снижению АЛТ и ГГТП, что сочеталось с уменьшением степени стеатоза и воспалительной активности [35].
Антиоксиданты. Применение антиоксидантов у больных НЖБП оправдано наличием окислительного стресса, что подтверждается повышением в плазме у больных НАСГ маркера окислительного стресса — тиоредоксина и снижением концентрации антиоксидантных факторов. В настоящее время активно изучается возможность использования витамина Е, эффективность которого была продемонстрирована в ряде исследований [36]. Также имеется ряд зарубежных и отечественных работ, посвященных оценке влияния УДК на морфофункциональное состояние печени. Механизмы действия этой гидрофильной кислоты связаны с тем, что, нормализуя гепатоэнтеральную циркуляцию желчных кислот и целого ряда биологически активных веществ, вытесняя токсичные желчные кислоты, она способствует ликвидации избытка холестерина в гепатоцитах, путем уменьшения его синтеза и всасывания из кишечника. УДК также обладает цитопротективным и антиапоптотическим действием, препятствуя развитию окислительного стресса, что позволяет применять ее на обоих этапах НЖБП [33].
В отношении АЛК установлено, что она обладает плейотропным действием на весь организм, оказывая положительное влияние на энергетический, липидный (тормозит синтез холестерина, подавляя высвобождение СЖК из жировой ткани, что предупреждает развитие стеатоза гепатоцитов) и углеводный (снижает ИР, усиливает захват и утилизацию глюкозы клеткой, повышает чувствительность клеточных рецепторов к инсулину) виды обменов.
Кроме этого, АЛК, имея низкий оксислительно-восстановительный потенциал, обладает мощным антиоксидантным эффектом, действуя непосредственно на печень, способствует повышению детоксицирующих субстанций в гепатоцитах (восстанавливает глутатион) и улучшению морфологических изменений [36].
Восстановление микробиоценоза кишечника. К сожалению, большинство работ, подтверждающих патогенетическую роль дисбиоза кишечника в формировании НЖБП и эффективность антибактериальных препаратов в лечении указанной нозологии, относится к 80–90-м годам прошлого столетия.
Поэтому вопрос проведения санации кишечника антибактериальными препаратами остается открытым. Антибиотики рекомендуются только при наличии верифицированной чувствительной условно-патогенной флоры в кишечнике или формировании заболевания после оперативного лечения на брюшной полости, например «синдрома приводящей петли». Преимуществом выбора при этом принадлежит препаратам, обладающим способностью хорошо накапливаться в желчи с эффектом вторичного прохождения через желудочно-кишечный тракт, к которым относятся фторхинолоны первого поколения (ципрофлоксацин). Также могут использоваться кишечные антисептики, типа метронидазола или нифуроксазид, и невсасывающиеся в кишечнике препараты, например рифаксимин.
Во всех остальных случаях, когда нет показаний для применения антибиотиков, кишечную санацию у больных НЖБП следует проводить пребиотиками, а препаратом выбора в данном случае является Эубикор. Его преимуществом является сбалансированный состав, куда входят пищевые волокна и винные дрожжи (S. vini). Кроме мощного пребиотического эффекта, Эубикор обладает хорошими сорбционными свойствами, что позволяет не только восстанавливать нормальную микрофлору, но и проводить дезинтоксикацию. По результатам исследований, прием Эубикора у данной категории пациентов способствовал дополнительному уменьшению дислипопротеидемии и повышению чувствительности к инсулину [37, 38].
Лечение неалкогольного ЖГ
В целом требования, предъявляемые к лекарственным средствам, используемым в лечении НЖБП, достаточно высоки. В первую очередь, они должны быть максимально безопасны с точки зрения гепатотоксичности, также желательно их позитивное действие на улучшение клинико-лабораторных и морфологических изменений в печени.
Собственный опыт лечения больных НЖБП на стадии гепатоза состоит в использовании комбинации АЛК с Эубикором. АЛК (препарат «Берлитион», производитель — Берлин-Хеми, Германия) назначалась по 600 ЕД внутривенно в течение 14 дней, с переходом на пероральный прием в той же суточной дозе, однократно в течение 6 месяцев. Эубикор назначался по 2 пакетика 3 раза в день во время еды. Результаты работы показали положительное влияние Берлитион и Эубикора не только на показатели липидного и углеводного обменов, но и на степень жировой дистрофии в печени по результатам ультразвукового и морфологического исследований. Положительная динамика указанных изменений имеет значение как для формирования системной ИР, являющейся основной причиной развития МС, так и для течения собственно НЖБП и развития НАСГ. Поэтому данные препараты, наряду с немедикаментозной терапией, могут рассматриваться как средства базисной терапии первой стадии НЖБП — ЖГ.
Лечение НАСГ
При развитии у пациентов НАСГ терапия заболевания усиливалась дополнительной комбинацией метформина (препарат «Сиофор», производитель — Берлин-Хеми, Германия) в дозе 1500 мг в сутки с УДК (препарат «Урсосан» фирмы PRO.MED.CS Praha a.s.) в дозе 15 мг на 1 кг массы тела, с однократным приемом через час после ужина. Длительность лечения подбиралась индивидуально, как правило, она составляла не менее 6 месяцев, иногда достигая 12 и более месяцев. Продолжительность курса зависела от выраженности клинических проявлений, комплайнса и динамики лабораторно-инструментальных показателей на фоне лечения. Назначение этих препаратов сопровождалось уменьшением не только клинико-лабораторных проявлений заболевания, но и достоверно способствовало улучшению гистологической картины печени. При этом комбинированная терапия у данной категории пациентов являлась методом выбора, поскольку именно в группе, получавшей одновременно Сиофор, Берлитион и Урсосан, динамика показателей синдромов цитолиза, холестаза, а также жирового и углеводного обменов была более значимой. На фоне лечения у больных НАСГ также отмечалось обратное развитие жировой дистрофии, достоверно уменьшилась выраженность воспалительных изменений и отсутствовало прогрессирование стадии фиброза в печени. Таким образом, комбинированная терапия воздействует на основные этиопатогенетические механизмы формирования метаболических нарушений, приводит к улучшению показателей липидного и углеводного обменов в виде нормализации уровней ЛПВП, ТГ и индекса ИР у пациентов с НАСГ.
Предложенная схема лечения НЖБП не является стандартизированной, но она патогенетически обоснована, а ее рабочий вариант может рассматриваться как применение:
На практике рациональный выбор того или иного препарата может определяться сочетанием НЖБП с другими компонентами МС.
Рекомендуемые алгоритмы выбора терапии пациентов с НЖБП и ожирением:
ИМТ менее 40 кг/м 2 :