анаэробные бактерии что это такое простыми словами
Анаэробная инфекция
Анаэробная инфекция — крайне тяжелый инфекционный процесс, вызываемый анаэробными бактериями, который нередко заканчивается летально. Чаще всего такой тип инфекции развивается в месте тяжелых ранений и больше распространен среди больных сахарным диабетом и атеросклерозом. Почему развивается эта инфекция, как ее избежать и какие здесь возможности лечения — читайте в нашем материале.
Что это такое
Анаэробным инфекционный процесс называют тогда, когда его вызывают анаэробные бактерии. Эти микроорганизмы не нуждаются в кислороде и размножаются только в условиях его дефицита. Так как кислород в ткани приносит артериальная кровь, условием для развития инфекции является нарушение кровоснабжения. Этим можно объяснить, почему болезнь развивается в глубоких размозженных ранах и поражает конечности больных сахарным диабетом и атеросклерозом.
Наличие повреждения тканей является обязательным для анаэробной инфекции, так как только в этом случае микробы смогут преодолеть механические барьеры — кожу и слизистые оболочки.
Чаще всего анаэробная инфекция развивается в конечностях, так как они в наибольшей степени подвержены травматизации. В редких случаях возможно поражение внутренних органов, особенно при повреждении стенки кишечника, так как анаэробы это его обычные его обитатели.
Анаэробный процесс может быть запущен двумя различными типами бактерий — спорообразующими и неспорообразующими. К первым относят род Clostridium, представители которого вызывают газовую гангрену. Ко вторым — множество различных микроорганизмов: Bacteroides, Fusobacterium, Eubacterium, Peptococcus, Proteus и другие. Последние вызывают неклостридиальную анаэробную (гнилостную) инфекцию.
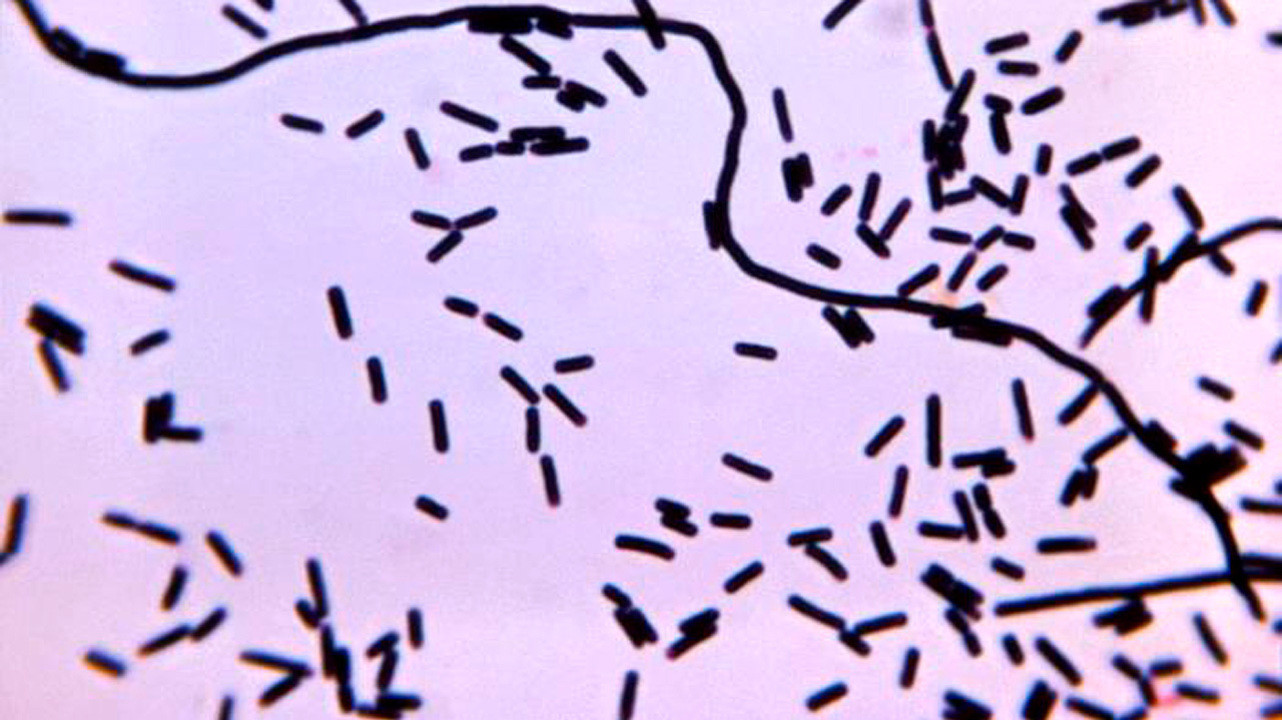
Несмотря на такое деление, инфекционные процессы, вызываемые этими группами бактерий, имеют много общих черт. Существует, однако, и ряд отличий, о чем речь пойдет далее.
Причины
Для развития инфекции необходимо попадание анаэробов в рану и местное нарушение кровоснабжения, поэтому первоочередной причиной будет раневой процесс. В случае газовой гангрены инфекция часто развивается вследствие загрязнения раны землей. Помимо уличных, бытовых и боевых травм причиной могут стать:
Факторы, которые могут сильно увеличить риск развития инфекции:
Симптомы
Для анаэробной инфекции характерны местные и общие симптомы, причем последние преобладают. Это объясняется большим количеством вырабатываемых анаэробами токсинов, которые попадают в кровь и вызывают сильнейшую интоксикацию. К наиболее характерным общим симптомам относят:
Местные симптомы специфичны и сильно облегчают диагностику, но их количество и выраженность варьируют. Обратим внимание на самые частые из них.
Важно! Обычно указанные симптомы врачи определяют уже в стационаре при проведении обследования по поводу травмы. Самостоятельно можно обратить внимание на повышение температуры, боль и отек после травматизации — в этом случае стоит немедленно вызвать скорую помощь.
Диагностика
Диагностика заболевания чаще всего основана на выявлении характерных симптомов. На проведение сложных длительных лабораторных исследований для уточнения диагноза времени нет — необходимо как можно быстрее начать лечебные мероприятия.
На практике применяют следующие методы диагностики:
Перечисленные исследования неспецифичны и являются диагностическим минимумом при любом поступлении в стационар. Они помогают при дифференциальной диагностике и выявлении сопутствующих заболеваний, а также многое говорят о настоящем состоянии больного. Из специфичных же исследований прибегают к следующим:
Поскольку бактериологические исследования длительны, их результаты становятся известны уже на этапе лечения. Для более быстрой диагностики образцы отделяемого из раны смешивают со специальными реактивами и наблюдают специфичные для разных микробов реакции.
Лечение
Лечение при анаэробной инфекции всегда подразумевает два равнозначных этапа: медикаментозный и хирургический. Остановимся подробно на каждом из них.
Медикаментозная терапия
Медикаментозное лечение направлено на устранение последствий интоксикации и уничтожение микробов. С этой целью используются различные растворы для внутривенного вливания, которые восполняют ионные потери, снижают тромбообразование, способствуют очищению крови от токсинов.
Антибактериальная терапия подразумевает поддержание в крови высоких доз антибиотиков. В лечении неклостридиальной анаэробной инфекции и газовой гангрены эффективно использование различных антибактериальных препаратов, специфичных в отношении соответствующего возбудителя. Этим объясняется ценность бактериологического исследования.
В терапии газовой гангрены также используется лечебная сыворотка в количестве нескольких доз, активная в отношении различных штаммов клостридий. При точной идентификации возбудителя применяют сыворотку, активную в отношении конкретного штамма.
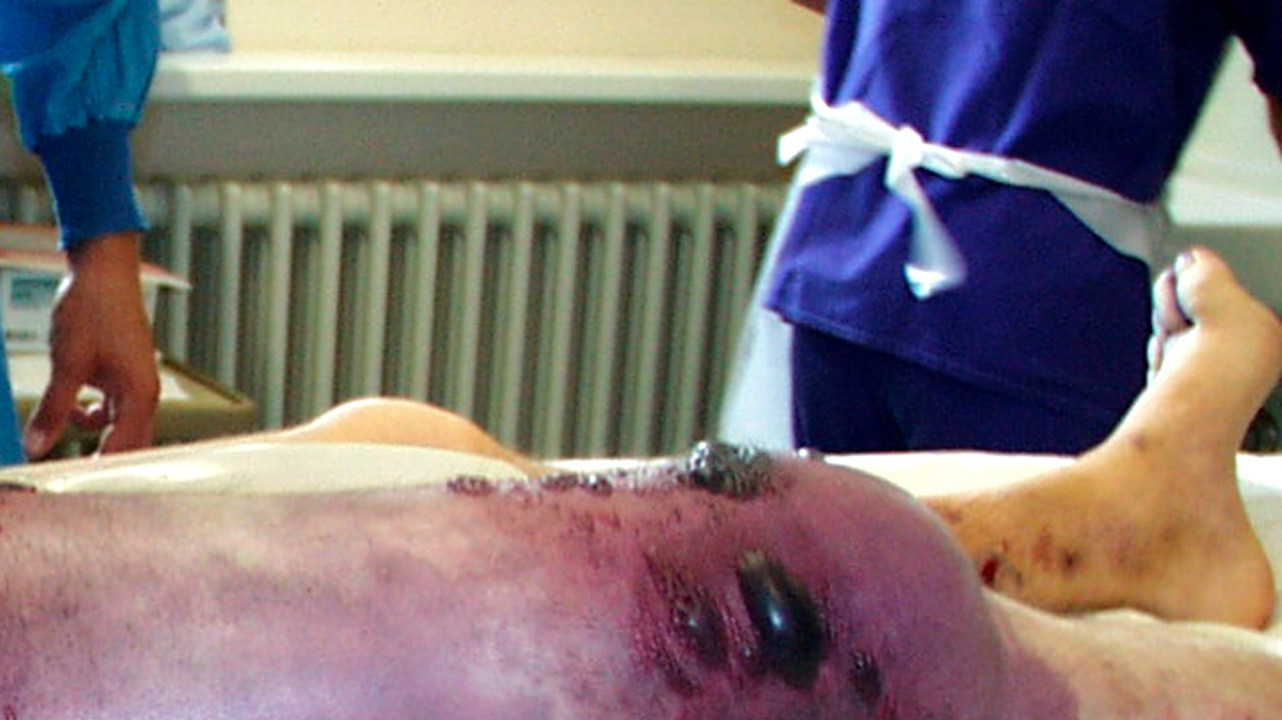
Хирургическое лечение
Оперативное вмешательство при анаэробной инфекции обязательно. Объем его зависит от распространенности процесса. Главный принцип хирургического лечения — обеспечение поступления кислорода в место развития инфекции. Для этого производят длинные разрезы, глубина которых зависит от уровня инфекционного поражения.
Так, при поражении лишь подкожной клетчатки достаточно разрезов в пределах этой ткани, при поражении мышц и фасций (своеобразных мышечных футляров из соединительной ткани) — рассекают и их. При этом разрезы оставляют открытыми, промывают и рыхло тампонируют их марлей, смоченной лекарственными препаратами. Явно безжизненные участки тканей иссекают.
Чаще всего бывает, что такого объема вмешательства достаточно, однако при поражении магистральных сосудов и далеко зашедших случаях показано удаление конечности (ампутация) или пораженного органа.
Чтобы улучшить прогноз и уменьшить объем операции прибегают к процедуре гипербарической оксигенации. Больного при этом укладывают в специальную капсулу, в которую подается кислород под высоким давлением.
Последствия запоздалого лечения
При поздних сроках начала лечения наиболее вероятным исходом заболевания становится летальный. Сильнейшая интоксикация быстро расходует защитные возможности организма — резко падает эффективность иммунитета.
Возбудители инфекции попадают в кровоток, способствуя распространению процесса и повреждению всех органов и систем. Развивается полиорганная недостаточность — процесс, при котором органы постепенно перестают выполнять свои функции. Вылечить нарушения такого масштаба практически невозможно.
Прогноз и профилактика
Прогноз зависит в основном от степени распространения инфекции и сроков начала лечения. Если анаэробный процесс развился лишь в подкожной клетчатке (флегмона), то лечение, как правило, не составляет проблем — прогноз благоприятный.
При поражении более глубоко лежащих тканей лечение значительно усложняется, интоксикация всегда более выраженная — прогноз ухудшается, возрастает риск инвалидизации и летального исхода. Возраст и сопутствующие заболевания в этом случае приобретают большое значение для прогноза.
В значительной степени прогноз определяют сроки начала хирургического лечения и качество обработки раны на этапе оказания первичной помощи при ранениях. Важно внимательное отношение хирурга к раневому процессу и скорость принятия решения о проведении оперативного лечения при подозрении на анаэробный процесс.
При подозрении на анаэробную инфекцию возможна ее экстренная профилактика с помощью введения антигангренозной сыворотки. Такая мера имеет смысл при газовой гангрене.
Как можно понять из сказанного, самое главное, что зависит от больного и влияет на исход заболевания — это своевременное обращение за квалифицированной медицинской помощью при получении тяжелых, глубоких травм.
Заключение
Анаэробная инфекция — раневой инфекционный процесс, тяжесть и прогноз которого напрямую зависит от степени поражения тканей. Вызывают его анаэробные бактерии, которые являются частью нормальной микробиоты организма, но становятся причиной инфекционного заболевания в условиях дефицита кислорода. Боль, отек и неприятный запах — характерные симптомы такой инфекции. Болезнь хорошо подвергается лечению на ранних этапах и значительно хуже в далеко зашедших случаях. Однако своевременность обращения за помощью при травме, симптомах анаэробного процесса вкупе с внимательностью хирурга позволяют избежать усугубления инфекции и, как следствие, летального исхода и инвалидизации.
Anaerovibrio (Анаэробные бактерии)
Анаэробные бактерии (Anaerovibrio) живут в организме человека в желудочно-кишечном тракте. Обитают также в толстой кишке и приносят большую пользу для организма.
Для своей жизнедеятельности этот тип бактерий не нуждается в кислороде. Поэтому живут и размножаются внутри ЖКТ. Кроме организма человека, анаэробные бактерии обитают также в рубце овец и крупного рогатого скота.
Бактерии этого вида необходимы для нормального функционирования организма человека и животных. При недостаточном содержании этих бактерий, нарушается работа различных органов.
Поэтому они привлекают пристальное внимание ученых. Анаэробные бактерии продолжают изучать с помощью современного оборудования. Это открывает из новые свойства и качества.
Какие основные свойства анаэробных бактерий?
В процессе жизнедеятельности анаэробные бактерии производят необходимые для нормальной деятельности организма человека и животных короткоцепочечные жирные кислоты. Кроме этого, они обеспечивают организм необходимым количеством уксусной и пропионовой кислоты.
Анаэробные бактерии входят в обширную группу микроорганизмов, которые играют важную роль в жизнедеятельностиорганизма. Впервые этот термин ввел ученый Луи Пастер, который открыл анаэробы в 1861 году, в процессе маслянокислого брожения. С момента своего открытия анаэробы продолжат изучать.
К какому роду бактерий относятся анаэробы?
Семейство и род анаэробных бактерий меняло свое название. Сначала род анаэробных бактерий относили к семейству Acidaminococcaceae. С развитием науки и знаний о свойствах анаэробных бактерий, это семейство упразднили.
Используя современную классификацию, бактерии этого рода входят в семейство Selenomonadaceae, царство Бактерий. Группа без ранга. В настоящее время к роду анаэробных бактерий ученые относят только один вид под названием Anaerovibrio lipolyticus.
В ранней классификации в род бактерий входил еще один вид. Но современные ученые произвели реклассификацию. В результате бактерии рода Anaerovibrio переименовали в род Anaerosinus.
Свое второе название получили также бактерии вида Anaerovibrio burkinabensis. После дополнительного изучения свойств и особенностей, ученые переименовали этот вид бактерий в род под названием Anaeroarcus.
Эти полезные для жизнедеятельности организма человека бактерии продолжают изучать. Новые методы и технологии позволяют обнаруживать неизвестные ранее свойства.
Условно-патогенная микрофлора
В организме существует множество бактерий, которые находятся с человеком в разных взаимоотношениях. Большую часть микрофлоры (микробиоценоза) представляют микроорганизмы, которые сосуществуют с человеком на основе симбиоза. Иными словами, основная масса микробов получает от человека пользу (в виде постоянной температуры и влажности, питательных веществ, защиты от ультрафиолета и так далее). В то же время эти бактерии сами приносят пользу, синтезируя витамины, расщепляя белки, соперничая с болезнетворными микроорганизмами и выживая их со своей территории. И одновременно с такими полезными бактериями у человека есть «сожители», которые в небольших количествах не приносят существенного вреда, но при определенных условях становящиеся болезнетворными. Такую часть микробов называют условно-патогенной микрофлорой.
Условно-патогенные микроорганизмы (УПМ) желудочно-кишечного тракта борются за свое выживание, поэтому их поколения вырабатывают устойчивость к конкурентной нормальной флоре. Лакто– и бифидобактерии в процессе жизнедеятельности производят вещества, сходные с антибиотиками по своему действию. Кроме того, сам организм, благодаря иммунной системе сдерживает размножение болезнетворных бактерий. Прием алкоголя и табакокурение, не говоря уже о наркомании, нервные стрессы, физические перегрузки, возрастные изменения, физиологическое несовершенство лимфатической системы (у маленьких детей), различные заболевания (в первую очередь – вирусного происхождения) – все это нарушает нормальный баланс микрофлоры в желудочно-кишечном тракте, приводит к гибели полезных микроорганизмов. Природа не терпит пустоты, и на смену погибшим полезным бактериям приходят условно-патогенные. С этого момента начинается развитие дисбиоза и дисбактериоза. Если же бывшие условно-патогенными, а теперь ставшие болезнетворными, бактерии покидают свое привычное место жительства, проникая через тканевые барьеры, то развивается оппортунистическая инфекция.
Состав условно-патогенной микрофлоры
Нормофлора у каждого человека индивидуальна по своему составу. То же самое касается и условно-патогенной микрофлоры, как части нормального биоценоза. Да-да! Несмотря на свою пагубную деятельность, условно-патогенные микроорганизмы нужны нормальной микрофлоре. Бактерии живут по принципу: «Что нас не убивает, то делает сильнее». То есть, постоянно соперничая за место, наши полезные бактерии становятся более выносливыми, вырабатывают «навыки» борьбы с УПМ на генном уровне. То же самое происходит и с остальной иммунной системой. Так что, можно сказать, что даже условно-патогенные микробы нужны нашему организму в качестве своеобразного «тренера» иммунитета.
К условно-патогенным микроорганизмам желудочно-кишечного тракта относится практически все семейство Enterobacteriaceae. Сюда входят клебсиелла пневмония, энтеробактеры (аэрогенес и клоацеа), цитробактер фреунди, протеи. Предельно допустимой нормой для семейства энтеробактерий в ЖКТ является показатель в 1000 микробных единиц. Из семейства стафилококков в кишечнике обитают на постоянной основе негемолитические формы стафилококка, количество которого может достигать в норме 10 000 микроорганизмов на 1 гкала. Гемолитических форм, то есть растворяющих эритроциты, в кишечнике в норме быть не должно вообще. Из УПМ очень большое количество бактероидов (фрагилис, например), можно встретить в толстом отделе кишечника. Эти бактерии принимают участие в жировом (липидном) обмене. Но их количество не должно выходить за пределы 10 9 колониеобразующих единиц, то есть отдельных особей, в1 г кала. В кишечнике можно также встретить небольшое количество стрептококков, которые помимо антагонистических (враждебных) свойств несут также и полезную нагрузку в нашем организме – они стимулируют выработку иммуноглобулинов, а также активно подавляют патогенных бактерий типа сальмонелл, шигелл.
Среди представителей нормофлоры также есть микроорганизмы, способные вызывать дисфункции кишечника. То есть, собственно эти бактерии относят к условно-патогенным, но тем не менее, их полезные свойства преобладают над патогенными. Такими бактериями являются энтерококки фекалис и фециум.
Из представителей условно-патогенной микрофлоры желудочно-кишечного тракта есть и такие, которые весьма редко, но все же могут вызывать заболевания. К таким можно отнести вейлонелл и фузобактерий. Их локализация, преимущественно, ограничена ротовой полостью. Но при попадании в кишечник, по данным некоторых ученых, они могут вызывать разного рода воспаления. Сведения о роли этих микробов в возникновении заболеваний ЖКТ весьма разрозненные и поэтому врачи, в лабораторных исследованиях причин дисбактериозов, особого внимания на них не обращают.
В отличие от вейлонелл и фузобактерий, хеликобактер пилори изучен довольно неплохо. Ему было отведено большое внимание в последнее время в связи с тем, что средой обитания он избрал желудок. Гастриты, язвенная болезнь желудка инфекционной природы в первую очередь связывается именно с хеликобактером. Лечение и приведение концентрации этого микроба к норме – довольно сложный процесс. Основная сложность терапии – высокая устойчивость хеликобактера к антимикробным препаратам. Еще бы – ведь он обитает в среде с повышенной кислотностью и через него проходят все лекарственные препараты. Какие должны быть защитные механизмы у бактерии, чтобы не только выживать, но и прекрасно себя чувствовать в подобных условиях!
Для того чтобы сдерживать патогенные свойства УПМ организму необходима помощь. Человек должен понимать, что его здоровье – в его же руках. Какими бы замечательными антагонистическими свойствами ни обладали наши эшерихии, бифидобактерии и лактобактерии, им нужна наша помощь, которая заключается в разумном подходе к образу жизни, и в первую очередь – к питанию.
Кишечная микрофлора и значение пребиотиков для ее функционирования
Микрофлора кишечника человека является составляющей человеческого организма и выполняет многочисленные жизненно важные функции. Общая численность микроорганизмов, обитающих в различных частях макроорганизма, приблизительно на два порядка превышает числен
У здоровых лиц в кишечнике насчитывается более 500 видов микроорганизмов. Общая масса микрофлоры кишечника составляет от 1 до 3 кг. В разных отделах ЖКТ количество бактерий различно, большинство микроорганизмов локализованы в толстой кишке (около 10 10–12 КОЕ/мл, что составляет 35–50% ее содержимого). Состав кишечной микрофлоры достаточно индивидуален и формируется с первых дней жизни ребенка, приближаясь к показателям взрослого к концу 1-го — 2-му году жизни, претерпевая некоторые изменения в пожилом возрасте (табл. 1). У здоровых детей в толстой кишке обитают представители факультативно-анаэробных бактерий рода Streptococcus, taphylococcus, Lactobacillus, nterobacteriacae, Candida и более чем 80% биоценоза занимают анаэробные бактерии, чаще грамположительные: пропионобактерии, вейлонеллы, эубактерии, анаэробные лактобациллы, пептококки, пептострептококки, а также грамотрицательные бактероиды и фузобактерии.
Вся совокупность микроорганизмов и макроорганизм составляют своеобразный симбиоз, где каждый извлекает выгоды для своего существования и оказывает влияние на партнера. Функции кишечной микрофлоры по отношению к макроорганизму реализуются как локально, так и на системном уровне, при этом различные виды бактерий вносят свой вклад в это влияние. Микрофлора пищеварительного тракта выполняет следующие функции.
Так, бифидобактерии за счет ферментации олиго- и полисахаридов продуцируют молочную кислоту и ацетат, которые обеспечивают бактерицидную среду, секретируют вещества-ингибиторы роста патогенных бактерий, что повышает резистентность организма ребенка к кишечным инфекциям. Модуляции иммунного ответа ребенка бифидобактериями также выражаются в снижении риска развития пищевой аллергии.
Лактобациллы уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие.
Из представителей энтеробактерий наиболее важное значение имеет Escherichia coli M17, которая вырабатывает колицин В, за счет чего подавляет рост шигелл, сальмонелл, клебсиелл, серраций, энтеробактеров и оказывает незначительное влияние на рост стафилококков и грибов. Также кишечная палочка способствуют нормализации микрофлоры после антибактериальной терапии и воспалительных и инфекционных заболеваний.
Кишечные палочки, бифидо- и лактобактерии выполняют витаминообразующую функцию (участвуют в синтезе и всасывании витаминов К, группы В, фолиевой и никотиновой кислот). По способности синтезировать витамины кишечная палочка превосходит все остальные бактерии кишечной микрофлоры, синтезируя тиамин, рибофлавин, никотиновую и пантотеновую кислоты, пиридоксин, биотин, фолиевую кислоту, цианокобаламин и витамин К. Бифидобактерии синтезируют аскорбиновую кислоту, бифидо- и лактобактерии способствуют всасыванию кальция, витамина D, улучшают всасывание железа (благодаря созданию кислой среды).
Процесс пищеварения условно можно разделить на собственное (дистанционное, полостное, аутолитическое и мембранное), осуществляемое ферментами организма, и симбиозное пищеварение, происходящее при содействии микрофлоры. Микрофлора кишечника человека участвует в ферментации нерасщепленных ранее компонентов пищи, главным образом углеводов, таких, как крахмал, олиго- и полисахариды (в том числе и целлюлоза), а также белков и жиров.
Не всосавшиеся в тонкой кишке белки и углеводы в слепой кишке подвергаются более глубокому бактериальному расщеплению — преимущественно кишечной палочкой и анаэробами. Конечные продукты, образующиеся в результате процесса бактериальной ферментации, оказывают различное влияние на состояние здоровья человека. Например, бутират необходим для нормального существования и функционирования колоноцитов, является важным регулятором их пролиферации и дифференцировки, а также всасывания воды, натрия, хлора, кальция и магния. Вместе с другими летучими жирными кислотами он оказывает влияние на моторику толстой кишки, в одних случаях ускоряя ее, в других — замедляя. При расщеплении полисахаридов и гликопротеинов внеклеточными микробными гликозидазами образуются, помимо прочего, моносахариды (глюкоза, галактоза и т. д.), при окислении которых в окружающую среду выделяется в виде тепла не менее 60% их свободной энергии.
Среди важнейших системных функций микрофлоры — поставка субстратов глюконеогенеза, липогенеза, а также участие в метаболизме белков и рециркуляции желчных кислот, стероидов и других макромолекул. Превращение холестерина в не всасывающийся в толстой кишке копростанол и трансформация билирубина в стеркобилин и уробилин возможны только при участии бактерий, находящихся в кишечнике.
Протективная роль сапрофитной флоры реализуется как на местном, так и на системном уровнях. Создавая кислую среду, благодаря образованию органических кислот и снижению рН среды толстой кишки до 5,3–5,8, симбионтная микрофлора защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенных, гнилостных и газообразующих микроорганизмов. Механизм этого явления заключается в конкуренции микрофлоры за питательные вещества и участки связывания, а также в выработке нормальной микрофлорой определенных ингибирующих рост патогенов субстанций, обладающих бактерицидной и бактериостатической активностью, в том числе антибиотикоподобных. Низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь летучие жирные кислоты, лактат и др., обладают заметным бактериостатическим эффектом. Они способны ингибировать рост сальмонелл, дизентерийных шигелл, многих грибов.
Также кишечная микрофлора усиливает местный кишечный иммунологический барьер. Известно, что у стерильных животных в lamina propria определяется очень малое количество лимфоцитов, кроме того, у этих животных наблюдается иммунодефицит. Восстановление нормальной микрофлоры быстро приводит к увеличению количества лимфоцитов в слизистой кишечника и исчезновению иммунодефицита. Сапрофитные бактерии в определенной степени обладают способностью модулировать уровень фагоцитарной активности, снижая его у людей, страдающих аллергией и, наоборот, повышая его у здоровых индивидуумов.
Таким образом, микрофлора ЖКТ не только формирует местный иммунитет, но и играет огромную роль в становлении и развитии иммунной системы ребенка, а также поддерживает ее активность у взрослого. Резидентная флора, особенно некоторые микроорганизмы, обладают достаточно высокими иммуногенными свойствами, что стимулирует развитие лимфоидного аппарата кишечника и местный иммунитет (в первую очередь за счет усиления продукции ключевого звена системы местного иммунитета — секреторного IgA), а также приводит к системному повышению тонуса иммунной системы, с активацией клеточного и гуморального звеньев иммунитета. Системная стимуляция иммунитета — одна из важнейших функций микрофлоры. Известно, что у безмикробных лабораторных животных не только подавлен иммунитет, но и происходит инволюция иммунокомпетентных органов. Поэтому при нарушениях микроэкологии кишечника, дефиците бифидофлоры и лактобацилл, беспрепятственном бактериальном заселении тонкой и толстой кишки возникают условия для снижения не только местной защиты, но и резистентности организма в целом.
Несмотря на достаточную иммуногенность, сапрофитные микроорганизмы не вызывают реакций иммунной системы. Возможно, это происходит потому, что сапрофитная микрофлора является своего рода хранилищем микробных плазмидных и хромосомных генов, обмениваясь генетическим материалом с клетками хозяина. Реализуются внутриклеточные взаимодействия путем эндоцитоза, фагоцитоза и пр. При внутриклеточных взаимодействиях достигается эффект обмена клеточным материалом. В результате представители микрофлоры приобретают рецепторы и другие антигены, присущие хозяину. Это делает их «своими» для иммунной системы макроорганизма. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены.
Обсуждается вопрос о ключевом участии микрофлоры в обеспечении противовирусной защиты хозяина. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора становится способной к перехвату и выведению вирусов, обладающих соответствующими лигандами.
Таким образом, наряду с низким рН желудочного сока, двигательной и секреторной активностью тонкой кишки, микрофлора ЖКТ относится к неспецифическим факторам защиты организма.
Важной функцией микрофлоры является синтез ряда витаминов. Человеческий организм получает витамины в основном извне — с пищей растительного или животного происхождения. Поступающие витамины в норме всасываются в тонкой кишке и частично утилизируются кишечной микрофлорой. Микроорганизмы, населяющие кишечник человека и животных, продуцируют и утилизируют многие витамины. Примечательно, что наиболее важную роль для человека в этих процессах играют микробы тонкой кишки, так как продуцируемые ими витамины могут эффективно всасываться и поступать в кровоток, тогда как витамины, синтезирующиеся в толстой кишке, практически не всасываются и для человека оказываются недоступными. Подавление микрофлоры (например, антибиотиками) снижает и синтез витаминов. Наоборот, создание благоприятных для микроорганизмов условий, например при употреблении в пищу достаточного количества пребиотиков, повышает обеспеченность макроорганизма витаминами.
Наиболее изучены в настоящее время аспекты, связанные с синтезом кишечной микрофлорой фолиевой кислоты, витамина В12 и витамина К.
Фолиевая кислота (витамин В9), поступая с продуктами питания, эффективно всасывается в тонкой кишке. Синтезирующийся в толстой кишке представителями нормальной кишечной микрофлоры фолат идет исключительно для ее собственных нужд и не утилизируется макроорганизмом. Тем не менее синтез фолата в толстой кишке может иметь большое значение для нормального состояния ДНК колоноцитов.
Кишечные микроорганизмы, синтезирующие витамин В12, обитают как в толстой, так и в тонкой кишке. Среди этих микроорганизмов наиболее активны в данном аспекте представители Pseudomonas и Klebsiella sp. Однако возможностей микрофлоры для полной компенсации гиповитаминоза В12 оказывается недостаточно.
С содержанием в просвете толстой кишки фолата и кобаламина, полученных с пищей или синтезированных микрофлорой, связана способность эпителия кишечника противостоять процессам канцерогенеза. Предполагается, что одной из причин более высокой частоты опухолей толстой кишки, по сравнению с тонкой, является недостаток цитопротекторных составляющих, большинство из которых всасывается в средних отделах ЖКТ. Среди них — витамин В12 и фолиевая кислота, которые совместно определяют стабильность клеточных ДНК, в частности ДНК клеток эпителия толстой кишки. Даже незначительный дефицит этих витаминов, не вызывающий анемию или другие тяжелые последствия, тем не менее приводит к значимым аберрациям в молекулах ДНК колоноцитов, способным стать основой канцерогенеза. Известно, что недостаточное поступление к колоноцитам витаминов В6, В12 и фолиевой кислоты ассоциируется с повышенной частотой рака толстой кишки в популяции. Дефицит витаминов приводит к нарушению процессов метилирования ДНК, мутациям и, как следствие, раку толстой кишки. Риск толстокишечного канцерогенеза повышается при низком потреблении пищевых волокон и овощей, обеспечивающих нормальное функционирование кишечной микрофлоры, синтезирующей трофические и протективные в отношении толстой кишки факторы.
Витамин К существует в нескольких разновидностях и необходим человеческому организму для синтеза различных кальцийсвязывающих белков. Источником витамина К1, филохинона, являются продукты растительного происхождения, а витамин К2, группа соединений менахинонов, синтезируется в тонкой кишке человека. Микробный синтез витамина К2 стимулируется при недостатке филохинона в диете и вполне способен его компенсировать. В то же время недостаточность витамина К2 при сниженной активности микрофлоры плохо корригируется диетическими мероприятиями. Таким образом, синтетические процессы в кишечнике являются приоритетными для обеспечения макроорганизма этим витамином. Витамин К синтезируется и в толстой кишке, но используется преимущественно для потребностей микрофлоры и колоноцитов.
Кишечная микрофлора принимает участие в детоксикации экзогенных и эндогенных субстратов и метаболитов (аминов, меркаптанов, фенолов, мутагенных стероидов и др.) и, с одной стороны, представляет собой массивный сорбент, выводя из организма токсические продукты с кишечным содержимым, а с другой — утилизирует их в реакциях метаболизма для своих нужд. Помимо этого, представители сапрофитной микрофлоры продуцируют на основе конъюгатов желчных кислот эстрагеноподобные субстанции, оказывающие влияние на дифференцировку и пролиферацию эпителиальных и некоторых других тканей путем изменения экспрессии генов или характера их действия.
Итак, взаимоотношения микро- и макроорганизма носят сложный характер, реализующийся на метаболическом, регуляторном, внутриклеточном и генетическом уровне. Однако нормальное функционирование микрофлоры возможно только при хорошем физиологическом состоянии организма и в первую очередь нормальном питании.
Питание микроорганизмов, населяющих кишечник, обеспечивается за счет нутриентов, поступающих из вышележащих отделов ЖКТ, которые не перевариваются собственными ферментативными системами и не всасываются в тонкой кишке. Эти вещества необходимы для обеспечения энергетических и пластических потребностей микроорганизмов. Способность использовать нутриенты для своей жизнедеятельности зависит от ферментативных систем различных бактерий.
В зависимости от этого условно выделяют бактерии с преимущественно сахаролитической активностью, основным энергетическим субстратом которых являются углеводы (характерно в основном для сапрофитной флоры), с преимущественной протеолитической активностью, использующих белки для энергетических целей (характерно для большинства представителей патогенной и условно-патогенной флоры), и смешанной активностью. Соответственно, преобладание в пище тех или иных нутриентов, нарушение их переваривания будет стимулировать рост различных микроорганизмов.
Углеводные нутриенты особенно необходимы для жизнедеятельности нормальной кишечной микрофлоры. Ранее эти компоненты пищи называли «балластными», предполагая, что они не имеют какого-либо существенного значения для макроорганизма, однако по мере изучения микробного метаболизма стало очевидно их значение не только для роста кишечной микрофлоры, но для здоровья человека в целом. Согласно современному определению, пребиотиками называют частично или полностью не перевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза. Свои энергетические потребности микроорганизмы толстой кишки обеспечивают за счет анаэробного субстратного фосфорилирования, ключевым метаболитом которого является пировиноградная кислота (ПВК). ПВК образуется из глюкозы в процессе гликолиза. Далее, в результате восстановления ПВК, образуется от одной до четырех молекул аденозинтрифосфата (АТФ). Последний этап приведенных выше процессов обозначается как брожение, которое может идти различными путями с образованием различных метаболитов.
Гомоферментативное молочное брожение характеризуется преимущественным образованием молочной кислоты (до 90%) и характерно для лактобактерий и стрептококков толстой кишки. Гетероферментативное молочное брожение, при котором образуются и другие метаболиты (в том числе уксусная кислота), присуще бифидобактериям. Спиртовое брожение, ведущее к образованию углекислого газа и этанола, является побочным метаболическим эффектом у некоторых представителей Lactobacillus и Clostridium. Отдельные виды энтеробактерий (E. coli) и клостридий получают энергию в результате муравьинокислого, пропионового, маслянокислого, ацетонобутилового или гомоацетатного видов брожения.
В результате микробного метаболизма в толстой кишке образуются молочная кислота, короткоцепочечные жирные кислоты (С2 — уксусная; С3 — пропионовая; С4 — масляная/изомасляная; С5 — валериановая/изовалериановая; С6 — капроновая/изокапроновая), углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты (в первую очередь жирные короткоцепочечные) утилизируются макроорганизмом. Нормальная микрофлора толстой кишки, перерабатывая не переваренные в тонкой кишке углеводы, производит короткоцепочечные жирные кислоты с минимальным количеством их изоформ. В то же время при нарушении микробиоценоза и увеличении доли протеолитической микрофлоры указанные жирные кислоты начинают синтезироваться из белков преимущественно в виде изоформ, что отрицательно сказывается на состоянии толстой кишки, с одной стороны, и может быть диагностическим маркером — с другой.
Помимо этого, различные представители сапрофитной флоры имеют свои потребности в определенных нутриентах, объясняющиеся особенностями их метаболизма. Так, бифидобактерии расщепляют моно-, ди-, олиго- и полисахариды, используя их как энергетический и пластический субстрат. При этом они могут ферментировать белки, в том числе и для энергетических целей; не требовательны к поступлению с пищей большинства витаминов, но нуждаются в пантотенатах.
Лактобактерии также используют различные углеводы для энергетических и пластических целей, однако плохо расщепляют белки и жиры, поэтому нуждаются в поступлении извне аминокислот, жирных кислот, а также витаминов.
Энтеробактерии расщепляют углеводы с образованием углекислого газа, водорода и органических кислот. При этом существуют лактозонегативные и лактозопозитивные штаммы. Также они могут утилизировать белки и жиры, поэтому мало нуждаются во внешнем поступлении аминокислот, жирных кислот и большинства витаминов.
Очевидно, что питание сапрофитной микрофлоры и ее нормальное функционирование принципиально зависит от поступления к ней не переваренных углеводов (ди-, олиго- и полисахаридов) для энергетических целей, а также белков, аминокислот, пуринов и пиримидинов, жиров, углеводов, витаминов и минералов — для пластического обмена. Залогом поступления к бактериям необходимых нутриентов является рациональное питание макроорганизма и нормальное течение пищеварительных процессов.
Хотя моносахариды могут легко утилизироваться микроорганизмами толстой кишки, к пребиотикам их не относят.
В нормальных условиях кишечная микрофлора не потребляет моносахариды, которые должны полностью всасываться в тонкой кишке. Пребиотики включают некоторые дисахариды, олигосахариды, полисахариды и достаточно гетерогенную группу соединений, в которой присутствуют и поли- и олигосахариды, которую обозначили как пищевые волокна. Из пребиотиков в женском молоке присутствует лактоза и олигосахариды.
Лактоза (молочный сахар) представляет собой дисахарид, состоящий из галактозы и глюкозы. В норме лактоза расщепляется лактазой тонкой кишки до мономеров, которые практически полностью всасываются в тонкой кишке. Лишь незначительное количество нерасщепленной лактозы у детей первых месяцев жизни попадает в толстую кишку, где утилизируется микрофлорой, обеспечивая ее становление. В то же время дефицит лактазы приводит к избытку лактозы в толстой кишке и значительному нарушению состава кишечной микрофлоры и осмотической диарее.
Лактулоза — дисахарид, состоящий из галактозы и фруктозы, в молоке (женском или коровьем) отсутствует, однако в небольших количествах может образовываться при нагревании молока до температуры кипения. Лактулоза не переваривается ферментами ЖКТ, ферментируется лакто- и бифидобактериями и служит им субстратом для энергетического и пластического обмена, за счет чего способствует их росту и нормализации состава микрофлоры, увеличению объема биомассы в содержимом кишечника, что определяет ее слабительный эффект. Помимо этого, показана антикандидозная активность лактулозы и ее угнетающий эффект на сальмонелл. Полученная синтетическим путем лактулоза (дюфалак) широко используется как эффективное слабительное средство, обладающее пребиотическими свойствами. Как пребиотик детям дюфалак назначается в низких дозах, не оказывающих слабительного эффекта (по 1,5–2,5 мл 2 раза в день в течение 3–6 нед).
Олигосахариды представляют собой линейные полимеры глюкозы и других моносахаров с общей длиной цепи не более 10. По химической структуре выделяют галакто-, фрукто-, фукозил-олигосахариды и др. Концентрация олигосахаридов в женском молоке относительно невелика, не более 12–14 г/л, однако их пребиотический эффект весьма значителен. Именно олигосахариды сегодня рассматриваются как основные пребиотики женского молока, обеспечивающие как становление нормальной микрофлоры кишечника ребенка, так и ее поддержание в дальнейшем. Важным является то обстоятельство, что олигосахариды присутствуют в значимых концентрациях только в женском молоке и отсутствуют, в частности, в коровьем. Следовательно, в состав адаптированных молочных смесей для искусственного вскармливания здоровых детей должны добавляться пребиотики (галакто- и фруктосахариды).
Полисахариды представляют собой длинноцепочечные углеводы в основном растительного происхождения. Инулин, содержащий фруктозу, в больших количествах присутствует в артишоках, клубнях и корнях георгинов и одуванчиков; утилизируется бифидо- и лактобактериями, способствует их росту. Помимо этого, инулин повышает всасывание кальция и влияет на метаболизм липидов, снижая риск развития атеросклероза.
Пищевые волокна — большая гетерогенная группа полисахаридов, наиболее известными из которых являются целлюлоза и гемицеллюлоза. Целлюлоза — неразветвленный полимер глюкозы, а гемицеллюлоза — полимер глюкозы, арабинозы, глюкуроновой кислоты и ее метилового эфира. Помимо функции субстрата для питания лакто- и бифидофлоры и опосредованно поставщика короткоцепочечных жирных кислот для колоноцитов, пищевые волокна оказывают и другие важные эффекты. Они обладают высокой адсорбционной способностью и удерживают воду, что приводит к повышению осмотического давления в полости кишки, увеличению объема фекалий, ускорения пассажа по кишечнику, что обусловливает слабительный эффект.
В средних количествах (1–1,9 г/100 г продукта) пищевые волокна содержатся в моркови, сладком перце, петрушке (в корне и зелени), редьке, репе, тыкве, дыне, черносливе, цитрусовых, бруснике, фасоли, гречневой, перловой крупе, «Геркулесе», ржаном хлебе.
Высокое содержание (2–3 г/100 г продукта) пищевых волокон характерно для чеснока, клюквы, красной и черной смородины, черноплодной рябины, ежевики, овсяной крупы, хлеба из белково-отрубной муки.
Наибольшее же их количество (более 3 г/100 г) содержится в укропе, кураге, клубнике, малине, чае (4,5 г/100 г), овсяной муке (7,7 г/100 г), пшеничных отрубях (8,2 г/100 г), сушеном шиповнике (10 г/100 г), жареном кофе в зернах (12,8 г/100 г), овсяных отрубях (14 г/100 г). Пищевые волокна отсутствуют в рафинированных продуктах.
Несмотря на очевидную значимость пребиотиков для питания микрофлоры, благополучия ЖКТ и всего организма в целом, в современных условиях отмечается дефицит пребиотиков в питании во всех возрастных группах. В частности, взрослый человек должен съедать в сутки примерно 20–35 г пищевых волокон, тогда как в реальных условиях европеец потребляет не более 13 г в сутки. Уменьшение доли естественного вскармливания у детей первого года жизни приводит к недостатку пребиотиков, содержащихся в женском молоке.
Таким образом, пребиотики обеспечивают благополучие микрофлоры толстой кишки, здоровье толстой кишки и являются необходимым фактором здоровья человека в связи с их существенными метаболическими эффектами. Преодоление дефицита пребиотиков в современных условиях связано с обеспечением рационального питания лиц всех возрастных категорий, начиная от новорожденных и кончая людьми преклонного возраста.
Литература
С. В. Бельмер, доктор медицинских наук, профессор
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва