артроскопическая абляция сердца что это такое
Артроскопическая абляция сердца что это такое
В норме регулярная работа нашего сердца поддерживается электрическими импульсами, которые генерируются группой специальных клеток. Эти клетки сформированы в компактное образование – синусовый узел, расположенный в верхней части правого предсердия [рис. 1].
При фибрилляции предсердий (мерцательной аритмии) вместо регулярного сердечного ритма в предсердиях возникают множественные электрические волны, приводящие к хаотичным сокращениям обоих предсердий с очень высокой частотой [рис. 2].
Фибрилляция предсердий (мерцательная аритмия), как правило, проявляется учащенным нерегулярным сердечным ритмом, одышкой, плохой переносимостью физических нагрузок. Нередко фибрилляции предсердий протекает бессимптомно и обнаруживается случайно при регистрации ЭКГ. Нередко у пациентов с фибрилляцией предсердий (мерцательной аритмии) обнаруживается еще один вид нарушений сердечного ритма – трепетание предсердий [ рис.3 ]. Симптомы трепетания предсердий мало отличаются от фибрилляции предсердий. Точная диагностика данных нарушений ритма и определение тактики лечения должны определяется кардиологом-аритмологом.
2. Зачем и как лечить фибрилляцию предсердий?
Лечение фибрилляции предсердий ставит своей целью:
По данным мировой медицинской статистики фибрилляция предсердий (мерцательная аритмия) – самое часто встречающаяся (1-2 % в популяции) нарушение сердечного ритма. У значительной части пациентов (до 40%) ФП носит бессимптомный характер. У этой категории больных медикаментозное антиаритмическое или немедикаментозное лечение (катетерная аблация) ФП, как правило, не проводится. Лечение этих пациентов заключается в контроле частоты сердечного ритма и назначении антикоагулянтов для профилактики тромбоэмболических осложнений. Пациентам, у которых фибрилляция предсердий сопровождается описанными выше симптомами назначают постоянную антиаритмическую терапию, направленную на профилактику рецидивов ФП. Приблизительно у одной трети среди всех больных ФП удается подобрать эффективный антиаритмический препарат или их комбинацию.
У 30% больных с симптомной, плохо переносимой фибрилляцией предсердий не удается подобрать эффективную антиаритмическую терапию, либо прием антиаритмических средств противопоказан, сопровождается развитием побочных эффектов или пациенты не хотят придерживаться тактики длительного консервативного медикаментозного лечения. Этой категории больных в соответствии с современными международными и российскими рекомендациями рекомендуется проведение катетерной аблации.
Следует подчеркнуть, что выбор вариантов лечения в каждом конкретном случае – задача кардиолога-аритмолога с учетом мнения пациента и объективных медицинских данных.
3. Катетерная и хирургическая аблация
В зависимости от формы фибрилляция предсердий (пароксизмальная, персистирующая или постоянная), наличия другой патологии со стороны сердечно-сосудистой системы и сопутствующих заболеваний применяются 3 разновидности катетерной (или хирургической) аблации:
• внутрисердечная катетерная аблация – наиболее широко используемый метод немедикаментозного лечения ФП. Катетерная аблация проводится в условиях рентгеноперационной с использованием управляемых катетеров, перемещаемых в камеры сердца через сосудистые доступы (бедренные и подключичные вены). Цель катетерной аблации радикальное устранение «источников» аритмии в левом и (при трепетании предсердий) правом предсердии. В настоящее время широкое клиническое применение нашли 2 вида катетерной аблации: радиочастотная катетерная аблация и баллонная криоаблация.
• катетерная аблация (деструкция) АВ узла – разновидность внутрисердечной катетерной аблации, которая применяется в тех случаях, когда ФП сопровождается стойко высокой частотой сердечных сокращений при невозможности медикаментозного контроля или радикального устранения ФП. Аблация АВ узла проводится только после имплантации искусственного водителя ритма (кардиостимулятора).
4. Радиочастотная или баллонная криоаблация?
Как это работает?
Видео 1. Баллонная криоаблация
Эффективность и безопасность
Общепринятым определением эффективности катетерной аблации при ФП считается отсутствие любых предсердных аритмий после аблации без применения антиаритмических средств. Контроль за эффективностью осуществляется клинически (самоконтроль пациентов) или с использованием систем длительной регистрации ЭКГ (ХМ ЭКГ или специальные имплантируемые регистраторы сердечного ритма).
Одним из основных факторов, определяющих эффективность катетерных аблаций при ФП является длительность эпизодов фибрилляции. В тех случаях когда приступы аритмии не превышают нескольких часов или дней (т.н. пароксизмальная форма) и, как правило, закачиваются самостоятельно, оперативное лечение максимально эффективно. В сравнительных исследованиях (международное исследование «Fire and Ice») рецидивов ФП в течение первого года не было у 65% больных как после радиочастотной, так и после баллонной криоаблации. При этом, есть наблюдения, что у лиц без сопутствующей кардиальной патологии эффективность баллонной криоаблации может достигать 80-90%.
У пациентов с персистирующей формой ФП, т.е. с аритмией длительностью более 7 дней, а также требующей для восстановления синусового ритма проведения медикаментозной или электрической кардиоверсии, ожидаемая эффективность катетерных аблаций – около 50-60%.
Если после катетерной аблации ФП рецидивирует с прежней частотой и длительностью, оправданным является проведение повторного вмешательства.
Осложнения при катетерной аблации ФП могут проявляться в виде повреждения сосудов в месте пункции, перфорации стенки сердца с развитием тампонады, образование тромбов в полости сердца и тромбоэмболическими осложнениями, термическим повреждением пищевода, развитием пареза диафрагмального нерва и рядом других. Применение современных высокотехнологичных методов контроля во время внутрисердечных вмешательств, достаточный опыт и квалификация врачей позволяет выполнять данные вмешательства эффективно и без значительного риска развития осложнений. Вместе с тем, необходимо четко осознавать, что решение о проведении интервенционного лечения ФП должен принимать врач с достаточным опытом лечения подобной категории больных, объективно учитывая аргументы «за и против».
5. Катетерная аблация ФП в отделе клинической электрофизиологии и рентгенхирургии нарушений ритма
Интервенционная аритмология – одно из основных направлений в научной и клинической работе отдела клинической электрофизиологии с момента его основания в 1990 г. Почти 20 лет насчитывает опыт лечения различных нарушений сердечного ритма с использованием технологии катетерных аблаций.
С 2012 года в отделе был внедрен метод катетерных аблаций при ФП. Сегодня приоритетным методом, используемым в клинической практике отдела клинической электрофизиологии при немедикаментозном лечении ФП является метод баллонной криоаблации. Этот выбор основан на том, что криоаблация при ФП не уступает по эффективности радиочастотной, являясь при этом наиболее безопасным методом интервенционного лечения ФП, что было доказано при анализе многолетнего опыта ведущих мировых центров в лечении ФП.
Специалисты отдела клинической электрофизиологии проводят полноценное предоперационное обследование пациентов, выполняют интервенционное вмешательство и обеспечивают амбулаторное наблюдение за всеми пациентами в течение не менее 1 года после катетерной криоаблации ФП. В тех случаях, когда у пациентов имеются сложные сопутствующие нарушения сердечного ритма применяется комплексное (одномоментное) интервенционное лечение, либо т.н. «гибридная терапия», сочетающая катетерное вмешательство и последующее медикаментозное лечение. В случае рецидива ФП может быть выполнена повторная баллонная криоаблация или радиочастотная катетерная аблация.
Радиочастотная абляция сердца
Радиочастотная абляция сердца
Изобретение и активное внедрение в повсеместную практику малоинвазивных вмешательств с максимальным эффектом – это основной путь развития современной медицины. Именно к таким операциям и относится радиочастотная катетерная абляция.
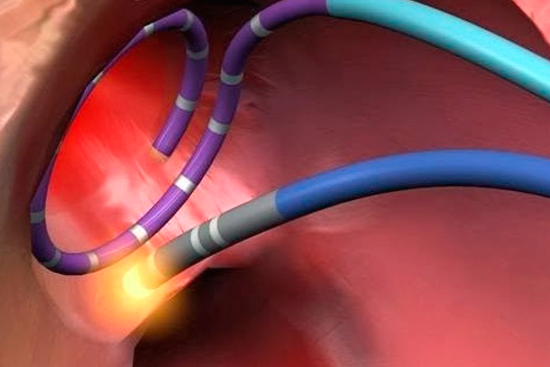
РЧА – это методика лечения нарушений сердечного ритма, путем проведения физической деструкции очага патологического возбуждения или участков анормального проведения импульса.
Эта операция позволила отказаться от сложных хирургических вмешательств на открытом сердце при лечении множества видов аритмий, в том числе и устойчивых к медикаментозной терапии.
Показания к операции
Радиочастотная катетерная абляция сердца является вариантом выбора при лечении аритмий у пациентов молодого возраста, так как позволяет в относительно короткие сроки не только улучшить самочувствие пациента и качество его жизни, но и уменьшить риски внезапной сердечной смерти и потери трудоспособности.
Патологии, при которых врачи настоятельно рекомендуют проведение РЧА сердца:
РЧА может при жизненной необходимости проводиться даже детям без врожденных пороков развития сердца, начиная с раннего возраста. В этом случае показаниями к назначению операции РЧА будет развитие тахизависимой кардиопатии со снижением насосной функции сердца и отсутствием должного эффекта после применения всех групп антиаритмических препаратов.
Стоит отметить, что при ряде аритмических нарушений радиочастотная абляция сердца рекомендуется и том в случае, если пациент не желает принимать антиаритмические средства пожизненно или плохо их переносит.
Цель операции
Цели, преследуемые при выполнении РЧА сердца, всегда направлены на устранение причины аритмогенеза – патологического проводящего пути или аномально активного участка миокарда. Для этого при абляции сердца выполняется точечное разрушение неправильно функционирующего участка проводящей системы сердца, что может иметь два различных эффекта, каждый из которых оптимален при своей группе патологий сердца. Так при лечении предсердных тахикардий с аномалиями AV-проведения методикой выбора является полная или частичная радиочастотная абляция атриовентрикулярного соединения. В то же время в случае желудочковой тахикардии или наличия обходных путей проведения РЧА будет направлено на разрушение самого патологического участка сердца.
Проведение радиочастотной катетерной абляции сердца позволяет избежать ряда негативных последствий жизни с аритмией, таких как:
Виды РЧА
Так как принцип действия катетерной абляции заключается в разрушении небольшого участка, то все разновидности данной процедуры отличаются по физическому фактору, вызывающему деструкцию:
Однако эффективность, управляемость деструкции и особенности выполнения для этих методик неодинаковы. Сейчас чаще всего применяется именно РЧА, так как именно по этой методике наработано наибольшее количество положительных результатов. Тогда как, например, от абляции постоянным электрическим током большинство кардиохирургов отходят в пользу РЧА сердца и других методик.
Подготовка к операции, необходимые анализы и обследования
Перед операцией при общении с кардиохирургом, который будет проводить радиочастотную абляцию сердца, необходимо четко озвучить список лекарственных препаратов, принимаемых пациентом, и их дозировки. Также важно предоставить врачу информацию о наличии имплантированного кардиостимулятора, аллергических реакций или непереносимости на медикаменты, если они имеют место.
В список обязательных диагностических процедур перед проведением абляции сердца включаются следующие:
Так же при наличии сопутствующей патологии, кроме рутинных методов, могут потребоваться дополнительные анализы и диагностических процедуры. Например, больным с ИБС может быть назначена липидограмма, а пациентам с сахарным диабетом – исследование уровня гликированного гемоглобина. Важно учитывать, что многие пациенты с аритмиями получают антикоагулянтную терапию, поэтому к вышеуказанному может быть добавлено и исследование МНО.
Рекомендуется накануне перед РЧА (не менее 12 часов) не принимать пищу и воду.
Методика проведения операции
При проведении радиочастотной абляции не требуется общая анестезия, поэтому пациенту лишь обезболивают место введения катетерного электрода, а также назначают седативные препараты. Уже в операционной обеспечивается стабильный венозный доступ: он понадобится для введения контрастных веществ, антиаритмиков или других лекарственных средств, необходимость в которых может возникнуть в ходе РЧА сердца.
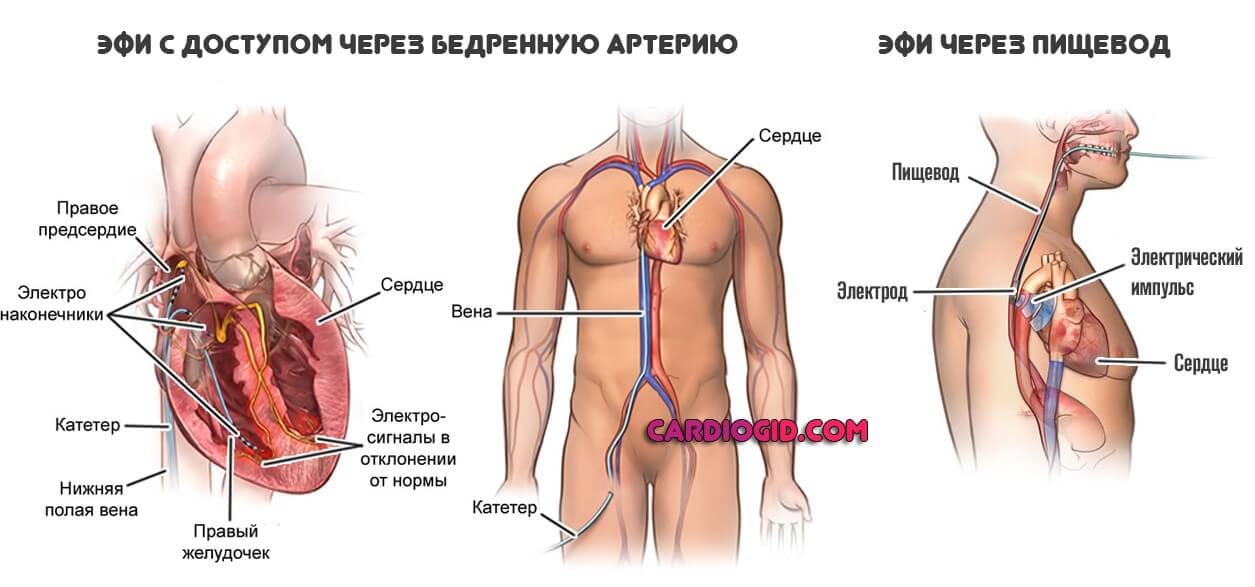
Главные инструменты бригады электрофизиологов и кардиохирургов – гибкие катетерные электроды. Они вводятся через крупный сосуд, преимущественно доступ проводится через бедренную артерию. Не исключаются и другие варианты введения электродов, например, через подключичную вену или другие сосуды. Радиочастотная абляция выполняется под контролем рентгеноскопии, поэтому пациенту не стоит бояться, что кардиохирурги действуют вслепую.
Обычно операция РЧА проводится в два этапа:
В случае, когда патология (например, фибрилляция предсердий) требует разрушения атриовентрикулярного соединения, то добавляется еще один этап – имплантация кардиостимулятора, так как при такой абляции сердца полностью прекращается проведение импульсов от тканей предсердий к миокарду желудочков.
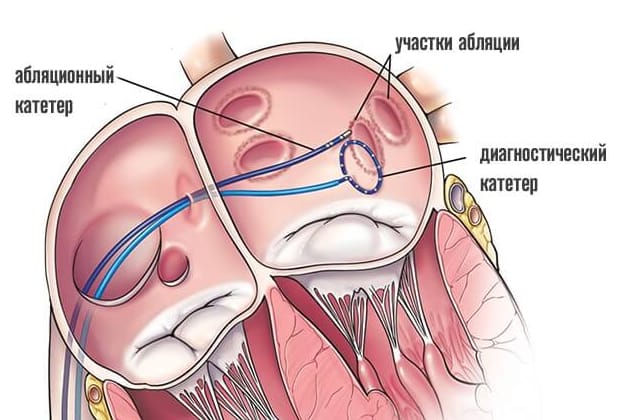
Электрофизиологическое исследование является составлением своеобразной карты сердца, на которой будут отражаться участки, где происходит патологическое проведение или образование электрических импульсов. Производится эта процедура путем введения специфического контраста и электрической стимуляции участков сердца. Во время этой процедуры обычно индуцируются нарушения ритмичности работы сердца, но в условиях операционной эти аритмии не несут угрозы пациенту.
По завершению картирования кардиохирурги вводят через тот же доступ абляционный электрод и приступают к собственно проведению РЧА сердца. Катетерный абляционный электрод устанавливают в проекции патологического участка и точечным воздействием радиочастотных волн производят его разрушение. При наличии крупного очага или нескольких аномальных зон в тканях сердца их деструкция может быть выполнена в ходе одной операции или потребуется повторное проведение РЧА позднее.
После процедуры РЧА при наличии показаний может производиться установка и программирование кардиостимулятора.
Так как во время проведения абляции сердца пациент находится в сознании, то это иногда сопряжено с некоторым дискомфортом. Поэтому при появлении любых неприятных ощущений желательно сообщать врачу. В то же время не стоит бояться этого вмешательства, ведь практически все манипуляции с электродами для больного безболезненны.
Количество времени, затрачиваемое на проведение радиочастотной абляции, колеблется в диапазоне от 3 до 7 часов.
Описание послеоперационного периода и реабилитации
Одним из наиболее значимых преимуществ РЧА по сравнению с операциями на открытом сердце – является малая травматичность и быстрое восстановление. В то время как больной после стернотомии будет ощущать боль в области грудины, месяцами носить специальный бандаж, а также ограничивать свои нагрузки, пациент после РЧА уже через пару недель сможет вернуться к своему обычному ритму жизни, который уже не будет обременен аритмией.
Непосредственно из операционной пациент переводится в отделение интенсивной терапии, где и проводит первые сутки после РЧА. Здесь проводится постоянный контроль за сердечным ритмом и артериальным давлением. Для предупреждения кровотечения из места введения абляционного катетера рекомендуется лежать в первые 4-5 часов после операции.
При отсутствии осложнений покинуть клинику, в которой проводилась абляция сердца, пациент сможет уже на следующий день.
Возможные осложнения при РЧА
Такое вмешательство, как абляция сердца, имеет очень низкий риск возникновения серьезных осложнений, но не исключает их совсем. Наиболее часто пациенты сталкиваются с возникновением гематомы в месте введения электродов, однако они обычно не требуют какого-либо специфического лечения и в течение нескольких недель проходят самостоятельно.
Реже встречаются более серьезные осложнения:
Риск смерти при проведении данной операции обычно составляет около 0,2% и менее.
Результативность после операции РЧА будет зависеть от типа аритмии, анатомических особенностей сердца пациента и наличия сопутствующей патологии внутренних органов в целом и сердца в частности. Процент успешных РЧА колеблется в пределах от 75% до 95%, например, при лечении суправентрикулярных аритмий он составляет около 96%. Частота осложнений при выполнении абляции сердца встречается не чаще, чем в 1,5-2%.
Иногда после удачно проведенной первой операции РЧА со временем формируются новые аномальные участки, что связано с особенностями электрофизиологии сердца конкретного пациента, в таких клинических ситуациях также может потребоваться повторная абляция.
В подавляющем большинстве случаев отзывы пациентов о качестве жизни после РЧА положительные. Они могут заниматься теми делами, доступ к которым ранее был закрыт из-за риска возникновения аритмии. Пациенты могут заниматься спортом, женщины фертильного возраста безопасно выносить и даже самостоятельно родить ребенка. Существенным плюсом является и то, что при ряде патологий после РЧА сердца не требуется продолжать постоянный прием медикаментов.
Выполнение радиочастотной абляции требует высокотехнологичного оборудования и наличия квалифицированных специалистов, поэтому еще не проводится повсеместно. Обычно клиники располагающие данными ресурсами есть в крупных городах, а в Санкт-Петербурге и Москве их даже несколько.
Стоимость радиочастотной абляции сердца рассчитывается индивидуально для каждого пациента и может значительно варьировать из-за разных объемов вмешательства, необходимости имплантации стимулятора, а также уровня клиники, в которой проводится операция. Средняя цена составляет от 150 тыс. руб.
Следует отметить, что в РФ существуют квоты на бесплатное проведение РЧА сердца.
Радиочастотная катетерная абляция (РЧА)
Малоинвазивная операция, проводимая с помощью небольших проколов. Осуществляется с применением последних компьютерных технологий в условиях постоянного рентгеновского контроля.
Об операции РЧА
Радиочастотная катетерная абляция или РЧА – это малоинвазивный метод лечения нарушений сердечного ритма (аритмии). Процедура начала применяться в кардиологических стационарах с 1980-х годов. Этот метод стал эффективной альтернативной и лекарственной терапии, и сложным хирургическим операциям.
Устранить патологический очаг, который вызывает сбои в нормальной работе сердца, возможно с помощью физического воздействия. Поэтому существует несколько видов абляции:
К основным преимуществам радиочастотной катетерной абляции относят:
Показания к радиочастотной абляции
Основными показаниями к проведению радиочастотной катетерной абляции являются следующие патологии:
Противопоказания для проведения РЧА
У операции нет абсолютных противопоказаний: радиочастотная катетерная абляция проводится при аритмии и других вышеперечисленных патологиях даже у пожилых людей и детей. Однако проведение РЧА нежелательно при таких патологиях, как:
Подготовка к радиочастотной катетерной абляции
Для того чтобы операция РЧА прошла успешно, пациенту важно подготовиться к абляции:
С 2013 года в Федеральном научно-клиническом центре ФМБА России работает кардиологическое отделение лечения нарушений ритма сердца (аритмии). Мы оказываем высокотехнологичную специализированную медицинскую помощь пациентам и делаем все возможное, чтобы как можно скорее больной смог вернуться к полноценной жизни. Центр оснащен медицинским и диагностическим оборудованием последнего поколения для максимально точных результатов. Поэтому все предоперационные исследования и анализы вы можете сделать в нашей клинике.
Проведение РЧА
Радиочастотная катетерная абляция проводится с применением либо местной, либо комбинированной анестезии.
После выполнения анестезии прокалываются вена или артерия, через которые к сердцу больного подводятся диагностические катетеры. С помощью этих катетеров выполняется электрофизиологическое исследование сердца (ЭФИ). При ЭФИ удаётся установить локализацию аритмогенного субстрата сердца и поставить больному точный диагноз.
Затем тем же способом в сердце проводится «лечебный» катетер, на кончик которого подаётся высокочастотный ток для точечного воздействия на очаг аритмии.
В ряде случаев для облегчения работы хирурга и для диагностики аритмии выполняют 3D-реконструкцию камер сердца, по которой можно визуально оценить, как проходят электрические сигналы в сердце, а также учесть анатомические особенности камер сердца.
В отделении работают опытные врачи, многие кардиологи являются кандидатами и докторами медицинских наук. Наши специалисты постоянно развиваются, принимают участие в международных конференциях, публикуют результаты исследований в ведущих научных журналах.
После операции
После проведения радиочастотной абляции пациента переводят в палату. Первые 24 часа больному обеспечивают покой и рекомендуют постельный режим. Это необходимо, чтобы сердце перестроилось на новый лад, а также не открылись раны в области проведения катетера. В первые сутки каждые 6 часов пациенту проводят ЭКГ для контроля состояния. На вторые сутки разрешается медленно передвигаться по палате, нагрузка должна увеличиваться постепенно.
В стационаре пациент наблюдается первые три дня и находится под постоянным присмотром наших специалистов. Если осложнений нет, пациента отпускают домой на амбулаторное восстановление. Перед выпиской врач-кардиолог осматривает пациента, выписывает ему назначения и выдает памятку о том, что необходимо делать в период реабилитации.
В первую неделю важно, чтобы пациент находился в полном покое и не занимался привычными делами, требующих концентрации внимания. Лучше всего, когда в этот период с пациентом находятся родственники или нанятый медицинский работник.
Полный период восстановления длится около 2-3 месяцев. В это время необходимо:
Следующий прием у кардиолога должен быть через 3 месяца после проведенной операции, затем через 6 и 12 месяцев.
Восстановление после РЧА полностью зависит от пациента. Не забывайте следовать указаниям в памятке и своевременно посещать кардиолога.
Стоимость РЧА
Стоимость проведения РЧА зависит от индивидуальных особенностей пациента, необходимости дополнительных исследований и выбора программы реабилитации.
Артроскопическая абляция сердца что это такое
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
Торакоскопический метод в лечении пациентов с фибрилляцией предсердий
Журнал: Кардиология и сердечно-сосудистая хирургия. 2013;6(4): 37-40
Елесин Д. А., Богачев-Прокофьев А. В., Романов А. Б., Лосик Д. В., Байрамова С. А., Шабанов В. В., Покушалов Е. А., Караськов А. М. Торакоскопический метод в лечении пациентов с фибрилляцией предсердий. Кардиология и сердечно-сосудистая хирургия. 2013;6(4):37-40.
Elesin D A, Bogachev-Prokof’ev A V, Romanov A B, Losik D V, Baĭramova S A, Shabanov V V, Pokushalov E A, Karas’kov A M. Thoracoscopic method in treatment of patients with atrial fibrillation. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2013;6(4):37-40.
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
Классическое вмешательство лабиринт (Maze III) — «золотой стандарт» хирургического лечения больных с клинически проявляющейся рефрактерной к медикаментозной терапии фибрилляцией предсердий (ФП). Несмотря на высокую эффективность, данное вмешательство не получило широкого применения вследствие технической сложности, большой инвазивности и использовании искусственного кровообращения [1].
Менее травматичные вмешательства внедрены в результате расширения знаний о патофизиологии ФП, а также развития аблационных методик и устройств, которые заменяют оригинальную технику разрез—шов.
Триггерная активность из легочных вен (ЛВ) играет важную роль в патофизиологии ФП, особенно при пароксизмальной форме [2]. Последние клинические и экспериментальные исследования также свидетельствуют о важной роли вегетативной нервной системы в индукции и поддержании ФП [3, 4]. R.Wolf и соавт. [5] разработали методику, при которой изоляция ЛВ и радиочастотная аблация (РЧА) ганглионарных сплетений (ГС) левого предсердия (ЛП) выполняется через двусторонний торакотомный доступ. Торакоскопическое вмешательство менее инвазивно, снижает количество периоперационных осложнений и дискомфорт пациента.
В данном исследовании оценивается первый опыт применения торакоскопического вмешательства у пациентов с различными формами ФП в течение 1 года наблюдения.
Материал и методы
С февраля 2011 г. по август 2012 г. торакоскопическое вмешательство было выполнено у 30 пациентов с рефрактерной к медикаментозной терапии ФП с клиническими проявлениями. Критерии включения в исследование: возраст 18—70 лет, пароксизмальная форма ФП после одной или более неэффективной катетерной аблации, персистирующая или длительно персистирующая форма ФП и размер ЛП более 6 см. Критерии исключения: предшествующие «открытые» хирургические вмешательства на сердце и легких, давность ФП более 10 лет и размеры ЛП более 70 см. Все пациенты подписывали добровольное информированное согласие на проведение хирургического вмешательства.
Возраст пациентов составил от 37,9 до 71,8 (57,6±8,6) года. У всех была нормальная фракция выброса левого желудочка и отсутствовала структурная патология сердца. Катетерную аблацию ранее перенесли 8 (26%) пациентов с пароксизмальной формой ФП и 5 (16%) с персистирующей формой ФП. В общей сложности у 8 (26%) пациентов была пароксизмальная форма ФП, у 15 (50%) — персистирующая форма ФП и у 7 (24%) — длительно персистирующая форма ФП. Клиническая характеристика пациентов до операции представлена в табл. 1.
При проведении вмешательства пациент находился в положении лежа на спине. Операцию выполняли под наркозом с интубацией двухпросветной трубкой. Доступ осуществляли с помощью 3 портов с обеих сторон грудной клетки. Два порта устанавливали в четвертое и шестое межреберье по средней подмышечной линии. Третий порт находился на 5 см кпереди от средней подмышечной линии в третьем межреберье. Эндоскоп вводили через порт, расположенный в четвертом межреберье. Оставшиеся два порта использовались для двух торакоскопических инструментов.
С правой стороны грудной клетки перикард открывали на 2—3 см выше диафрагмального нерва, затем его края фиксировали на держалки для оптимального позиционирования аблационного устройства. Перед РЧА трансполярным электродом (AtriCure, Inc., West Chester, Ohio, США) выполняли сверхчастотную стимуляцию (1000 имп/мин) в области устьев ЛВ для определения локализации ГС. Позитивная вагусная реакция расценивалась при асистолии не менее 3 с или замедлении желудочкового ритма более чем на 50% при наличии ФП. Радиочастотное воздействие выполняли в области ГС в течение 20 с трансполярным электродом (AtriCure, Inc., West Chester, Ohio, США). Затем повторно выполняли сверхчастотную стимуляцию в том же положении для подтверждения эффективности РЧА. При необходимости воздействие было повторено при наличии сохраняющегося вагусного ответа. Конечным пунктом данного этапа операции явилось отсутствие вагусного ответа после воздействия при повторной сверхчастотной стимуляции.
Следующим этапом операции осуществляли «тупое» рассечение пространства вокруг ЛВ с последовательным прохождением в поперечный, а затем косой синус полости перикарда. После этого с помощью диссектора (AtriCure Lumitip, Inc., West Chester, Ohio, США) выполняли обход ЛВ с последующей их изоляцией с помощью биполярного зажима (AtriCure, Inc., West Chester, Ohio, США). Изоляцию выполняли не менее 3 раз в области правых и левых ЛВ. Блок входа подтверждался с помощью биполярного картирующего электрода в отсутствие потенциалов в месте воздействия. Блок выхода подтверждался стимуляционно во время синусового ритма. При необходимости производили дополнительную изоляцию ЛВ. Заключительным этапом выполняли создание 2 аблационных линий от правых верхней и нижней ЛВ, по куполу и нижней стенке ЛП достигая левых легочных вен. Аналогичную процедуру осуществляли с левой стороны, за исключением перикарда, который открывали максимально низко под диафрагмальным нервом. Кроме того, связку Маршала рассекали электрокоагулятором (см. рис. 1, на цв. вклейке). 
Сразу после операции всем пациентам был имплантирован подкожный аппарат для длительного мониторирования ритма сердца (ИКМ). По окончании вмешательства пациентов переводили в палату интенсивной терапии под наблюдение.
Больных с долей ФП 0,5% по данным ИКМ) или какой-либо другой предсердной тахиаритмией. Данные ИКМ после выписки из стационара собирали каждые 3 мес в течение всего периода наблюдения.
Период наблюдения составил 12 мес. Все пациенты получали варфарин в течение 3 мес после операции, дальнейшая тактика антикоагулянтной терапии основывалась на результатах тестирования по шкале CHA2DS2VASc. Кроме того, в течение 3 мес пациентам проводили антиаритмическую терапию, и ее отмена основывалась на наличии рецидивов ФП после «слепого» периода.
Статистические расчеты выполняли с использованием программного обеспечения STATA 12&1. Сравнение эффективности лечения проводили с помощью логрангового критерия, что графически выражалось кривыми Каплан—Майера.
Результаты
Во время вмешательства 2 (6,7%) пациентам выполнена срединная стернотомия из-за выраженных плевральных спаек и в связи с кровотечением из правой нижней ЛВ. У остальных 28 (93,3%) пациентов не было никаких осложнений во время операции. Средняя продолжительность вмешательства составила 150,4±28,7 мин. Все пациенты были переведены в общую палату через 10—12 ч после вмешательства и выписаны через 4—9 (6,1±1,8) дней после операции. Результаты анализа раннего послеоперационного периода представлены в табл. 2.
Периоперационная и отдаленная смертность составила 0. Средний период наблюдения составил 12,5±2,2 мес.
В конце периода наблюдения у 22 (73,3%) пациентов не было зарегистрировано ФП или каких-либо других предсердных тахиаритмий (рис. 2). 
Обсуждение
В данном исследовании представлен первый опыт торакоскопической изоляции ЛВ с аблацией ГС при сроке наблюдения 12 мес. Эффективность при всех формах ФП по данным ИКМ составила 73,3%. Результаты исследования продемонстрировали, что торакоскопический подход является и безопасным, и эффективным, несмотря на то что 2 пациентам потребовалась проведение стернотомии вследствие кровотечения. Эти осложнения развились при выполнении данной процедуры у первых 6 пациентов, что можно связать с «периодом обучения». У последующих 24 пациентов осложнения отсутствовали. Кроме того, данная процедура является эффективной, даже у пациентов с длительным анамнезом ФП или ранее неэффективной катетерной аблацией.
Методика изоляции ЛВ и аблации ГС была ранее описана R. Wolf и соавт [5]. Наши результаты сопоставимы с результатами других исследователей, которые применяли эту технику [6, 7]. Данная операция менее эффективна, чем классическая операция Maze III [1], однако торакоскопический подход имеет ряд преимуществ. Вмешательство является малоинвазивным и не требует применения искусственного кровообращения, а также характеризуется меньшей продолжительностью как самой операции, так и нахождением больных в палате интенсивной терапии и пребывания в стационаре. Следует отметить, что все пациенты с неэффективной катетерной аблацией в анамнезе ответили на торакоскопическое вмешательство (ФП по данным ИКМ