атрофический эндометрий что это такое матки
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Вагинальная атрофия – симптом постменопаузы, характеризующийся эстрогендефицитным состоянием у женщин. Урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов. 27–55% всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (уга), затрагивающей половую функцию и качество жизни.
В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с вагинальной атрофией, а также расстройства с мочеиспусканием (цистоуретральная атрофия). Если вазомоторные симптомы проходят со временем, признаки вагинальной атрофии прогрессируют. У 40–57% женщин отмечается сухость влагалища, жжение и зуд, диспареуния, кровотечения, недержание мочи, инфекции органов малого таза.
Стенки влагалища состоят из трех слоев: внутреннего, среднего мышечного и наружного соединительнотканного. Атрофические процессы захватывают мышечные и соединительнотканные структуры, а также мышцы тазового дна, уретры, мочевого пузыря. Особенно выражены они в слизистой влагалища, которая состоит из 4 основных слоев эпителиальных клеток: базального, парабазального (митотически активного), промежуточного гликогенсодержащего и поверхностного слущивающегося. Эстрогеновые рецепторы в основном располагаются в базальном и парабазальном слоях и практически отсутствуют в промежуточном и поверхностном. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия, пролиферацию влагалищного эпителия. Следствием прекращения пролиферативных процессов являются исчезновение гликогена – питательной среды для лактобактерий, полное выведение лактобацилл, которые играют ключевую роль в предотвращении заболеваний урогенитального тракта. Вследствие расщепления гликогена при условии достаточного количества эстрогенов образуется молочная кислота, обеспечивающая кислую среду в пределах колебаний РН от 3,8 до 4,4. Подобный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка утрачивает защитные свойства, истончается, легко травмируется с последующим инфицированием.
Атрофия слизистой вульвы и влагалища характеризуется истончением, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления, а также происходит потеря упругости тканей, подкожно-жировой клетчатки, выпадение лобковых волос, снижение секреторной активности бартолиниевых желез. Как правило, врачи диагностируют вагинальную атрофию на основании сочетания клинических симптомов, визуального осмотра и субъективных жалоб пациентки.
Для диагностики и оценки эффективности лечения вагинальной атрофии необходимо: РН и подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев), мультистероидный профиль крови.
ЭСТРОГЕНЫ
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Все клинические рекомендации по лечению урогенитальной атрофии сходны в том, что наиболее эффективным методом лечения вагинальной атрофии является локальная гормональная терапия эстрогенами. Для лечения урогенитальной атрофии, сочетающейся с симптомами климактерия, используют системную гормональную терапию. Исследования показали, что локальная терапия устраняет симптомы вагинальной атрофии в 80–90% случаев, а системная терапия – в 75%. Ультранизкие дозы эстрогенсодержащих препаратов обладают выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстрогена, дополнительного введения прогестагена не требуется.
Роль дефицита эстрогенов у женщины в патогенезе урогенитальных расстройств в период менопаузы ни у кого не вызывает сомнений. Однако клиническая картина климактерического синдрома характеризуется широкой вариабельностью проявлений, поэтому не все урогенитальные расстройства в перименопаузе и постменопаузе могут быть объяснены недостаточным эффектом эстрогенов. С возрастом у женщин происходит значительное снижение уровня как эстрогенов, так и андрогенов. Так, уровень общего и свободного тестостерона, андростендиона и дегидроэпиандростерона в 45-летнем возрасте составляет в среднем 45%, в 60-летнем – около 30%, в 70-летнем – 10% от уровня этих гормонов у 20-летних женщин. Дефицит андрогенов, которому у женщин практически не уделяется внимания, оказывает негативное влияние на все органы и системы организма, особенно на половую систему. Применение ультранизких доз локальных эстрогенсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению вагинальной атрофии, не имеет ограничений по возрасту и длительности применения.
АНДРОГЕНЫ
Андрогены у женщин, как и у мужчин, представлены дегидроэпиандростерона сульфатом (ДГЭА-С), дегидроэпиандростероном (ДГЭА), андростендионом, тестостероном и 5α дегидротестостероном (5-α-ДГТ). Однако в отличие от мужчин концентрация первых трех гормонов у женщин выше, чем концентрация двух последних. Секреция андрогенов в надпочечниках регулируется адренокортикотропным гормоном (АКТГ), в яичниках – лютеинезирующим гормоном (ЛГ). У женщин около 25% андрогенов образуется в яичниках, 25% – в надпочечниках, остальные синтезируются в периферических тканях. После наступления менопаузы основным местом синтеза андрогенов становятся яичники. Циркулирующий в крови тестостерон у женщин функционирует как прогормон, способный к конверсии в 5-α-ДГТ или 17-β-эстрадиол в тканях-мишенях.
Андрогеновые рецепторы широко представлены в головном мозге, в изобилии – в женской мочеполовой системе, хотя влияние андрогенов на состояние влагалища изучено недостаточно. Слизистая оболочка влагалища во время возбуждения выделяет муцин и вагинальный транссудат (эстрогензависимая функция), секреция которых у женщин является андрогензависимой. Известно также, что уровень эстрогенов в крови влияет на экспрессию андрогеновых рецепторов во влагалище: у женщин, получающих препараты эстрогенов, плотность андрогеновых рецепторов оказывается ниже, чем у тех, кто такие препараты не получает. При этом показано, что плотность андрогеновых рецепторов в менопаузе существенно уменьшается. Следовательно, уменьшение плотности андрогеновых рецепторов у женщин в постменопаузе в сочетании с возрастным снижением уровня андрогенов в сыворотке крови у них может быть причиной уменьшения андроген-чувствительности тканей влагалища.
Кроме того, в женской половой системе наряду с эстрогензависимыми эффектами регуляции регионарного кровообращения выявлена андрогензависимая NO-опосредованная вазодилатация. Таким образом, уровень эстрогенов у женщин является основным, но не единственным механизмом, обеспечивающим рост клеток гладкой мускулатуры влагалища, а также регулирующим метаболизм соединительной ткани и синтез оксида азота. При дефиците эстрогенов происходит истончение эпителия влагалища, что делает его восприимчивым к травмам и инфекциям. Однако вагинальный эпителий у женщин, которым вводили тестостерон или ингибиторы ароматазы, также демонстрировал увеличение числа слоев клеток, их толщины и числа митозов.
Андрогены усливают экспрессию NO-синтазы в проксимальном отделе влагалища, что проявляется в облегчении релаксации гладких мышц влагалища. Эстрогены, с другой стороны, снижают активность NO-синтазы и повышают активность L-аргиназы, что может привести к относительному дефициту оксида азота и ослаблению релаксации вагинальной ткани. Таким образом, можно предположить, что при нормальном уровне эстрогенов имеющаяся у женщины диспареуния может быть проявлением дефицита вазомиорелаксирующего влияния андрогенов на мочеполовую систему, мионейроваскулярной недостаточностью и спазмом мышц тазового дна на фоне дефицита андрогенов.
Возрастное снижение уровня андрогенов у женщин коррелирует с развитием симптоматики цистоуретральной и вагинальной атрофии. В мышцах тазового дна и нижних мочевых путях имеется огромное количество андрогеновых рецепторов, что делает эти группы мышц также высокочувствительными к анаболическим эффектам андрогенов у женщин. Несмотря на то, что эстрогензаместительная терапия оказывает выраженное положительное влияние на клинические проявления урогенитальных расстройств, у 30–40% системная заместительная гормональная терапия (ЗГТ) не эффективна, поэтому обычно назначают местную терапию эстриолом, основным биологическим эффектом которого является трофическое воздействие на нижние отделы урогенитального тракта. Однако даже при таком подходе у значительного числа пациенток проблемы сохраняются.
СОВРЕМЕННОЕ ВИДЕНИЕ
Зарубежные и российские исследования показывают, что применение тестостерона в постменопаузе может быть эффективным средством лечения вагинальной атрофии, никтурии, недержания мочи как на фоне системной и локальной ЗГТ, так и без нее. Необходим индивидуальный подход к лечению урогенитальных расстройств, учитывающий разные типы течения пери- и менопаузы. Так, пациентки с клинически и лабораторно (мультистероидный профиль, определяемый масс-спектральным методом) подтвержденным дефицитом андрогенов не должны получать препарат ЗГТ с антиандрогенными свойствами, в связи с тем что ряд жалоб, обусловленных дефицитом эстрогенов, могут только усугубиться. В то время как при сохраненной секреции андрогенов назначение препаратов с андрогенной активностью может привести к нежелательным явлениям андрогенизации: спровоцировать рост волос на лице, прибавку мышечной массы, повысить сальность кожи, чрезмерно повысить либидо. Поэтому при выборе препаратов для лечения урогенитальной атрофии учитываются индивидуальные особенности каждой конкретной пациентки, основываясь на показателях ее гормонального профиля.
Ряд экспериментальных исследований показали эффективность применения андрогенных препаратов –
ДГЭА и тестостерона у пациенток в постменопаузе с сексуальными нарушениями и урогенитальными расстройствами. Андрогенные препараты для лечения вагинальной атрофии применяются в качестве эффективных и безопасных средств в виде трансдермального геля тестостерона пропионата, перорального тестостерона ундеканоата интравагинального геля дегидроэпиандростерона (DHEA) – 0,25% (3,25 мг), 0,5% (6,5 мг) и 10% (13 мг). Крем с 0,5% DHEA оказался самым оптимальным для лечения вагинальной атрофии, он эффективен и существенно не влияет на сывороточный уровень эстрогенов.
Помимо перечисленных выше методов лечения вагинальной атрофии, на сегодняшний день существуют такие, как терапия препаратами эстриола с низкими и ультранизкими дозами (0,3 мг и менее 0,1 мг) в сочетании с лактобактериями, селективными модуляторами эстрогеновых рецепторов (оспемифен), а также терапия комбинацией конъюгированных эстрогенов и базедоксифена – селективного модулятора эстрогеновых рецепторов, известной как тканевой селективный эстрогенный комплекс (TSEC), эффективный в соотношении 20 мг/ 0,625 мг.
Таким образом, местная терапия имеет ряд преимуществ перед системным введением препаратов, позволяет избежать первичного метаболизма в лечении, максимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект. Учитывая патогенез вагинальной атрофии (дефицит не только эстрогенов, но и андрогенов, влияющих на качество мышечной ткани малого таза, сократительную способность мочевого пузыря) рекомендована также терапия с применением интравагинальных гелей (дегидроэпиандростерона), селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональных методов лечения, а также комбинированных препаратов, содержащих
ультранизкодозированный эстриол и лактобактерин.
Несмотря на то что эффективность лечения высока, не стоит забывать о профилактике заболевания: сохранение регулярной половой жизни очень важно в период менопаузы. При половом акте улучшается циркуляция крови, а семенная жидкость содержит половые стероиды, простагландины и незаменимые жирные кислоты, способствующие сохранению вагинальной ткани.
Оптимизация тактики ведения пациенток пожилого и старческого возраста с внутриматочными патологическими процессами
Клиническая больница Управления делами Президента РФ, г. Москва
Московский государственный медико-стоматологический университет имени А.И. Евдокимова
Введение. Согласно демографическим прогнозам к 2030 г. каждый пятый человек в мире будет старше 65 лет. Как и многие государства Европы, Россия относится к странам с высоким уровнем «демографической старости». В связи с этим большое значение приобретает изучение особенностей возникновения, течения, лечения и профилактики заболеваний у лиц пожилого возраста.
Уровень заболеваемости населения в пожилом возрасте (60-74 года) в 2 раза выше, а в старческом (старше 75 лет) – почти в 6 раз выше, чем у людей молодого возраста. В результате возникает высокая потребность в оказании амбулаторной и стационарной помощи лицам пожилого и старческого возраста [7]. В настоящее время считается необоснованным отказ пациентам старших возрастных групп в адекватной медицинской помощи, щадящая консервативная тактика, например, не отвечающая современным принципам онкопрофилактики [9,10].
Очевидна актуальность изучения особенностей патологических процессов постменопаузального периода жизни женщины. Постменопауза представляет собой закономерное физиологическое состояние, сопровождающееся гормональными сдвигами, которые, в свою очередь, часто являются предвестниками различных проблем со здоровьем и могут влиять не только на качество жизни, но и на ее продолжительность [12]. В структуре гинекологической заболеваемости женщин пожилого и старческого возраста наиболее часто встречается патология эндометрия [11,13].
По данным разных авторов частота встречаемости различной внутриматочной патологии в постменопаузе следующая: полипы эндометрия –39,2-69,3%; атрофия эндометрия –16,7-47,4%; гиперплазия эндометрия без атипии –3,3-4,9%; гиперплазия эндометрия с атипией –0,5-5,2%; аденокарцинома –0,5-14%; субмукозная миома матки – 3,6-8,5%; синехии 4,8-7,9%. Процент выявляемой патологии зависит от методики исследования, длительности постменопаузы и наличия маточного кровотечения (наиболее частый симптом в постменопаузе, заставляющий пациентку обратиться к врачу) [2, 6, 9, 14, 17, 21, 22].
Ведущим методом диагностики патологии органов репродуктивной системы, в том числе эндометрия, признано ультрасонографическое исследование [1,4,5]. Многие зарубежные и отечественные авторы в своих работах указывают на высокую эффективность, простоту выполнения, неинвазивность, низкую стоимость данного метода исследования, позволяющего в ряде случаев избежать использование агрессивных инвазивных процедур. Он считается скрининговым методом диагностики внутриматочной патологии [2, 9, 15, 18]. Одним из значимых критериев является симметричность и толщина эндометрия (показатель М-эха). За норму, в зависимости от длительности постменопаузы, принято считать показатель М-эха, равный 3-5 мм [15,17]. По мнению большинства авторов, толщина эндометрия в постменопаузе, превышающая 5 мм, рассматривается как ведущий эхографический признак патологии эндометрия [18,20].
Для дальнейшей верификации диагноза необходимо получить материал для патоморфологического исследования [3]. Это достигается прицельной биопсией или раздельным выскабливанием цервикального канала и полости матки с последующим гистологическим исследованием соскоба. Но при выскабливании слизистой оболочки матки «вслепую» часто пропускаются или удаляются не полностью полипы эндометрия, узлы миомы, участки гиперплазированного эндометрия и т.д. Поэтому на сегодняшний день «золотым стандартом» в диагностике и лечении внутриматочной патологии гинекологами всего мира признается гистероскопия с последующим патогистологическим исследованием биопсии эндометрия [2,6,9,10,14,19]. Однако выполнение данного вида вмешательства у пациенток пожилого и старческого возраста имеет свои особенности, возможно развитие как анестезиологических, так и хирургических осложнений.
У данной группы больных отмечается изменение основного обмена, снижение компенсаторных возможностей сердечно-сосудистой и дыхательной систем, а также функции печени и почек. Изменяется фармакокинетика препаратов: снижается метаболизм, повышается чувствительность к опиоидам, гипнотикам, ингаляционным анестетикам и мышечным релаксантам, замедляется выведение препаратов из организма. Таким образом, необходимо крайне осторожно титровать внутривенные гипнотики при «малых» гинекологических операциях до получения необходимого эффекта [8].
Процессы старения в организме женщины характеризуются атрофическими изменениями органов генитального тракта. Матка уменьшается в размерах, истончаются ее мышечный слой и эндометрий, ткани теряют эластичность. Наиболее частой проблемой, с которой сталкиваются гинекологи при лечении возрастных пациенток, является частичная или полная атрезия цервикального канала. Наличие всех этих факторов влечет за собой увеличение риска хирургических осложнений, таких как перфорация матки, «ложный ход», кровотечения [16,19].
Несмотря на актуальность проблемы, имеется лишь ограниченное число публикаций, посвященных правилам проведения анестезиологического пособия и хирургических методик «малых» гинекологических вмешательств у пациенток пожилого и старческого возраста.
Цель исследования. Анализ особенностей клинических проявлений внутриматочных патологических процессов в пожилом и старческом возрасте и определение оптимальной тактики ведения пациенток с данным видом патологии.
Материал исследования включал 288 женщин в периоде стойкой постменопаузы, поступивших в гинекологическое отделение ФГБУ «Клиническая больница» Управления делами Президента РФ с подозрением на внутриматочную патологию.
Все пациентки, поступившие в гинекологическое отделение с подозрением на внутриматочную патологию в плановом порядке, были полностью обследованы в прикрепленных поликлиниках. На амбулаторном этапе они проходили общеклиническое и лабораторное исследование, при экстренной госпитализации пациентки полностью обследовались в стационарных условиях. Учитывая наличие сопутствующей экстрагенитальной патологии, пациенткам проводились консультации профильных специалистов.
Цервикальный канал выскабливали кюреткой №1, затем выскабливали полость матки кюретками № 2,4,6. Соскобы помещали в отдельные пластиковые контейнеры для последующего гистологического исследования. Для гистерорезектоскопии использовали гистерорезектоскоп KARL STORZ, Germany, 26050 SL.
Средами для расширение полости матки с целью адекватной интраоперационной визуализации являлись 0,9%-й раствор натрия хлорида при гистероскопии и 5%-й раствор глюкозы при гистерорезектоскопии.
Возраст наступления менопаузы варьировал от 38 до 56 лет (в среднем – 44,9±6,8 лет). При изучении социального статуса было установлено, что около половины обследованного контингента больных в постменопаузе являются служащими (145 пациенток, 50,35%), остальные (143 пациентки, 49,66%) – неработающими пенсионерами. Таким образом, очевидна важность обследования и лечения пациенток с внутриматочной патологией в постменопаузальном периоде как с медицинских, так и с социально-экономических позиций. Изучение анамнестических данных основывалось на анализе особенностей менструальной и репродуктивной функций (сроки наступления менархе и постменопаузы, начало половой жизни, число беременностей и их исход) перенесенных и сопутствующих гинекологических и экстрагенитальных заболеваний в различные периоды жизни.
При анализе репродуктивной функции обследованных больных были получены следующие данные: беременность не наступала у 28 пациенток, живущих половой жизнью, остальные (260 пациенток) имели однократные роды –120 женщин, двое родов – 116, трое – 11, четверо – 2 пациентки. Наиболее часто в анамнезе встречались миома матки (21,53%), патология эндометрия (16,32%), псевдоэрозия шейки матки (16,67%) с последующей диатермокоагуляцией ввиду неэффективности консервативной терапии, а также воспалительные заболевания гениталий (16,67%). Реже диагностировались в прошлом кисты яичников (2,43%), полип цервикального канала (1,05%), неполное выпадение матки (2,78%) и эктопическая беременность (4,17%). У многих пациенток отмечалось сочетание различных гинекологических заболеваний.
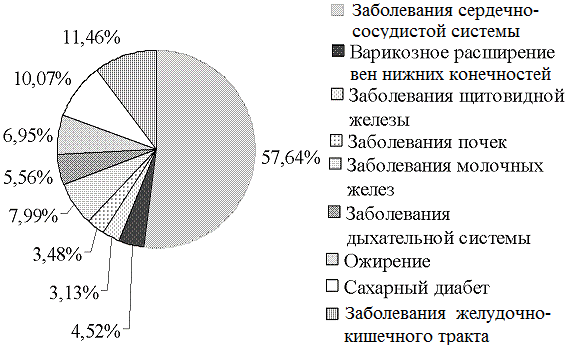
При анализе сопутствующих заболеваний было отмечено, что наиболее часто встречается патология сердечно-сосудистой системы – у 166 пациенток (57,64%), представленная ишемической болезнью сердца (ИБС), гипертонической болезнью в сочетании с другими заболеваниями или изолированно.
Варикозное расширение вен нижних конечной, в том числе с оперативным лечением, встретилось в 4,52% случаев, патология щитовидной железы – в 3,13%, мочекаменная болезнь – в 3,48%, патология молочных желез, в том числе рак молочной железы – в 7,99%. Патология органов дыхания была представлена бронхиальной астмой (3,13%) и хронической обструктивной болезнью легких (ХОБЛ) в стадии ремиссии (2,43%). У многих пациенток имелись эндокринные нарушения: ожирение 2-4 степени у 6,95%, сахарный диабет 2 типа –у 10,07% больных. Патология желудочно-кишечного тракта отмечена у 11,46% обследованных пациенток (рис. 1).
Рис. 1. Частота экстрагенитальной патологии у пациенток пожилого и старческого возраста
Не подлежит сомнению тот факт, что пожилому и старческому возрасту свойственна компелляция хронических заболеваний. У большинства больных отмечалось сочетание различной экстрагенитальной патологии. У многих больных в анамнезе были оперативные вмешательства по поводу различных заболеваний.
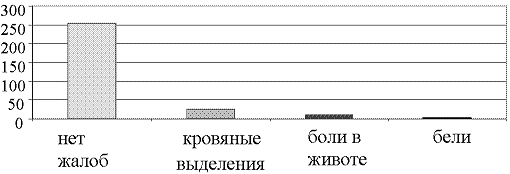
Рис. 2. Структура жалоб у госпитализированных женщин пожилого и старческого возраста с подозрением на внутриматочную патологию
Следует отметить, что у 237 пациенток каких-либо особенностей при гинекологическом осмотре не отмечено. У 38 больных выявлена атрезия наружного зева на фоне длительной постменопаузы, у 13 –при осмотре шейки матки в зеркалах обнаружен полип цервикального канала, в 18 случаях отмечено увеличение матки до 8-9 недель беременности в связи с наличием миомы матки, у 22 больных выявлено опущение стенок влагалища.
Всем пациенткам (n=288), поступившим в гинекологическое отделение с подозрением на внутриматочную патологию в пожилом и старческом возрасте, выполнено раздельное диагностическое выскабливание матки под контролем гистероскопии с последующим патоморфологическим исследованием полученного материала.
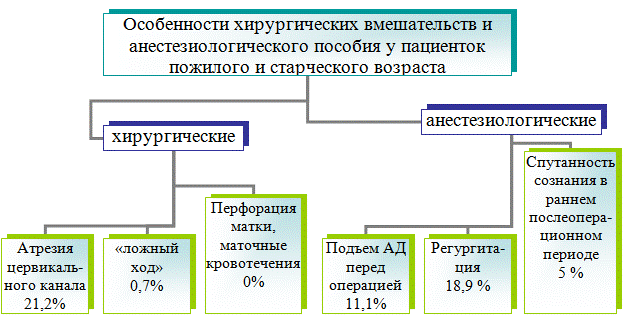
У 38 пациенток при гинекологическом осмотре отмечалась атрезия наружного зева, еще у 23 – атрезия внутреннего зева, выявленная при зондировании матки во время оперативного вмешательства. Таким образом, затруднения при расширении цервикального канала были отмечены у 61 пациентки (21,2%). С целью прохождения цервикального канала и определения длины полости матки выполняли форсированное зондирование по предполагаемому ходу цервикального канала, исходя из результатов гинекологического осмотра и ультразвукового сканирования. Также применяли водную диссекцию при цервикоскопии. В 17 случаях (5,9%) при невозможности прохождения цервикального канала зондом расширение проводили эндоскопическими щипцами или ножницами под гистероскопическим контролем. У одной пациентки инструментально не удалось пройти цервикальный канал. У двух пациенток сделан «ложный ход» (диагностика этого осложнения основана на данных гистероскопии и УЗИ малого таза). В 3-х описанных случаях вмешательство прекращено ввиду высокого риска перфорации матки. Пациентки выписаны из стационара под наблюдение гинеколога поликлиники с динамическим ультразвуковым скринингом. При отрицательной динамике планировалась повторная госпитализация в стационар.
285 пациенткам выполнено раздельное диагностическое выскабливание с предварительной диагностической гистероскопией. Гистероскопическая картина полости матки характеризовалась наличием полипов различной величины и локализации, неоднородным локальным утолщением эндометрия, наличием субмукозных или интерстициально-субмукозных узлов миомы, синехий в полости матки, признаков атрофии эндометрия и хронического эндометрита. Затем, при необходимости, была выполнена оперативная гистероскопия с использованием эндоскопических щипцов и ножниц (38) – в том числе для удаления небольших полипов из трубных углов, гистерорезектоскопия (7) –удаление миоматозных узлов, а также аблация эндометрия (3). Заметим, что дополнительную деструкцию эндометрия проводили пациенткам, у которых в анамнезе были указания на внутриматочные вмешательства в период постменопаузы.
При патогистологическом исследовании патологические изменения эндометрия были обнаружены у 200 из 283 пациенток (70,7%). Их структура представлена в табл. 1.
Таблица 1. Структура внутриматочной патологии у женщин пожилого и старческого возраста
У 69 пациенток из 285 (24,2%) гистологически была выявлена лишь атрофия эндометрия, а у 16 (5,6%) – субмукозные миомы матки.
Таким образом, наиболее частая патология эндометрия у пациенток пожилого и старческого возраста – железисто-фиброзные полипы (92%). Обращает на себя внимание высокий процент атрофических процессов эндометрия, что обусловлено постменопаузальными изменениями, а также высокая частота злокачественных новообразований эндометрия в пожилом и старческом возрасте. Представляет интерес и отсутствие гиперплазии эндометрия в изученной группе наблюдений.
Интраоперационно, а также в ранний и поздний послеоперационный периоды маточных кровотечений не отмечалось. Перфорации матки не было ни у одной пациентки из наблюдаемой группы.
32 пациенткам (11,1%) отложено оперативное лечение ввиду повышенных цифр артериального давления, выявленных при осмотре анестезиологом. Эта группа пациенток консультирована кардиологом, проведена коррекция гипотензивной терапии, к лечению добавлены седативные препараты. Через 1-2 суток у 28 пациенток цифры артериального давления не превышали 140/90 мм рт. ст., им было выполнено оперативное лечение под внутривенным наркозом.
Четверым пациенткам потребовался перевод в кардиологическое отделение для детального дообследования и подбора гипотензивных препаратов, после чего больные возвращались снова в гинекологическое отделение на оперативное лечение без выписки из стационара.
Особое внимание при ведении пациенток пожилого и старческого возраста с различной внутриматочной патологией уделялось анестезиологическому пособию при «малых» гинекологических операциях.
Для внутривенной анестезии использовали комбинацию препаратов пропофол + кетамин в сочетании 4:1 (Пропофол 200 мг + Кетамин 50 мг).
Индукция в/в анестезии методом титрования по 3 мл смеси до исчезновения ресничных рефлексов при сохранении спонтанного дыхания. На фоне ингаляции увлажненного кислорода через носовой катетер, сатурация кислорода не опускалась ниже 90%.
Во время проведения анестезии регургитация выявлена в 43 случаях (18,9%), аспирации не отмечалось ни у одной пациентки. Данное осложнение связано как со скоплением желудочного сока при длительном ожидании операции, так и несоблюдением режима голода пациентками.
Более половины наблюдаемых пациенток (57,6%) страдали гипертонической болезнью, что объясняет высокие цифры артериального давления перед анестезией, обусловленные волнением (32 пациенткам отложено оперативное лечение ввиду необходимости медикаментозной коррекции), а также отмечались низкие цифры АД после индукции анестезии.
Интраоперационное снижение артериального давления у лиц, страдающих гипертонической болезнью, связано с сочетанным применением препаратов для внутривенного наркоза и постоянного приема гипотензивных препаратов.
В течение раннего послеоперационного периода следует отметить замедленный выход из анестезии по сравнению с пациентками более ранних возрастов, а также в 5% случаев наличие кратковременной спутанности сознания, как индивидуальной реакции на применение кетамина.
В позднем послеоперационном периоде осложнений, связанных с наркозом, не наблюдали.
Особенности хирургических вмешательств и анестезиологического пособия у пациенток пожилого и старческого возраста по результатам исследования представлены на рис. 3.
Все пациентки в послеоперационном периоде получали антибактериальную терапию с целью профилактики воспалительных осложнений: ципрофлоксацин 500 мг 2 раза в день, метронидазол 500 мг 3 раза в день. Курс лечения составлял 5-7 дней, зачастую пациентки начинали прием препаратов в гинекологическом отделении и продолжали в амбулаторных условиях после выписки из стационара. Также больным проводили физиотерапетические процедуры в противоспалительном и сокращающем режимах (амплипульс-терапия, магнитотерапия, электрофорез с йодидом калия и антибиотиками). Тепловые факторы лечения не использовали до получения результатов гистологического исследования ввиду онконастороженности.
Результаты патоморфологического исследования материала, полученного при выскабливании цервикального канала и полости матки, направляли в поликлинику с целью коррекции дальнейшей тактики ведения пациенток.
Так как все пациентки, поступившие в плановом порядке в гинекологическое отделение из поликлиник для раздельного диагностического выскабливания матки и гистероскопии, были полностью обследованы амбулаторно, предоперационный период был непродолжительным: сроки оперативного лечения составили от 1 до 5 суток, в среднем 1,64±0,67 суток. Средний койко-день пребывания пациенток в стационаре составил 3,45±1,62. Данная система преемственности амбулаторного и стационарного звена позволяет значительно снизить медико-экономические затраты и повысить эффективность лечения пациенток с внутриматочной патологией.
Рис. 3. Особенности хирургических вмешательств и анестезиологического пособия у пациенток пожилого и старческого возраста
Выводы. Особенностью внутриматочных патологических процессов у больных пожилого и старческого возраста является их преимущественно бессимптомное течение, и диагноз может быть поставлен на основании ультразвукового скрининга.
Анатомическими особенностями матки у больных пожилого и старческого возраста, создающими сложности при операции, являются ее малые размеры, атрофические изменения тканей и частичная или полная атрезия цервикального канала.
Наиболее частой патологией эндометрия у женщин пожилого и старческого возраста являются железисто-фиброзные полипы эндометрия, повышена частота эндометриальных аденокарцином.
Учитывая возрастные изменения органов малого таза, наличие сопутствующей экстрагенитальной патологии, часто выраженную эмоциональную лабильность, высокий риск осложнений, целесообразно
1. Тщательно корректировать сопутствующую патологию на догоспитальном этапе.
2. Для исключения аспирации желудочного содержимого более ответственно отслеживать соблюдение пищевого режима.
3. Проводить операцию с применением седативной премедикации для исключения повышения артериального давления.
4. В связи с высоким риском перфорации матки операция должна выполняться только высококвалифицированным хирургом.
5. Для снижения риска травматизации шейки матки использовать гистероскопические щипцы и ножницы для расширения цервикального канала при полных и частичных атрезиях последнего.
6. Крайне важная роль для поддержания здоровья женщин должна быть отведена преемственной работе системы поликлиника-стационар, а также диспансерному обследованию наблюдаемого контингента.
Список использованных источников:
1. Ашрафян Л.А., Киселев В.И. Опухоли репродуктивных органов (этиология и патогенез). – М.: Компания «Димитрейд График Групп», 2008. –216 с.
2. Бреусенко В.Г., Голова Ю.А., Каппушева Л.М., Шилина Е.А., Климова И.В. Внутриматочная патология в постменопаузе: диагностика и лечение// Акушерство и гинекология. – 2003. – № 2. – С. 36-40.
3. Горных О.А., Самойленко В.В., Биштави А.Х., Каниболоцкий А.А., Манухин И.Б., Табакман Ю.Ю. Гиперплазия и предрак эндометрия// Опухоли женской репродуктивной системы. –2011. –№4. –С. 59-63.
4. Девятовская А.Г. Применение трехмерной эхографии в мониторинге лечения гиперпластических процессов эндометрия: Дис. … канд. мед. наук.- М., 2009, 117 с.
5. Демидов В.Н., Гус А.И. Патология полости матки и эндометрия. ВМК. Эхография органов малого таза у женщин. Практическое пособие. – М., 2001. – 138 с.
7. Журавлева Т.П. Основы гериатрии: учебное пособие. – М.: ФОРУМ: ИНФРА-М, 2007. – 288 с.
9. Мартиросян К.А. Пролиферативные процессы эндометрия у пациенток старше 60 лет. Современные технологии в диагностике и хирургическом лечении: Автореф. дис. … канд. мед. наук. – М., 2012. – 26 с.
11. Стрижова Н.В., Сухих Г.Т., Соболева Г.М., Холодова Ж.Л., Рейснер Е.А. Сравнение сывороточной активности матриксной металлопротеиназы-2 у больных с железистой и железисто-кистозной гиперплазиями эндометрия в перименопаузе// Проблемы репродукции. – Спец. выпуск. –2008. –С. 312-313.
12. Сухих Г.Т., Адамян Л.В. Репродуктивное здоровье семьи// Проблемы репродукции. –2008. – Спец. выпуск. –С. 5-10.
13. Торчинов А.М., Умаханова М.М., Фидарова Т.В., Габараева М.Р. Пролиферативная активность железистого эпителия полипов эндометрия в период пери- и постменопаузы// Матер. IX Всеросс. науч. форума «Мать и дитя». – 2007. – С. 540-541.
14. Хитрых О.В. Отдаленные результаты и оптимизация тактики лечения полипов эндометрия в постменопаузе: Автореф. дис. … канд. мед. наук. – М., 2009. – 18 с.
15. Щеглова Е.А. Ультразвуковая диагностика гиперпластических процессов эндометрия у женщин различных возрастных периодов: Автореф. дис. … канд. мед. наук. – М., 2009. – 26 с.
16. Brand A.H. The woman with postmenopausal bleeding// Aust. Fam. Physician. 2007; 36 (3): 116-20.
17. Dreisler E., Sorensen S.S., Ibsen PH. Prevalence of endometrial polyps and abnormal uterine bleeding in a Danish population aged 20-74 years// ultrasound Obstet Gynecol. 2009; 33 (1): 102-108.
18. Goldstein S.R. Significance of incidentally thick endometrial echo on transvaginal ultrasound in postmenopausal women// Menopause. 2011; 18 (4): 434-6.
19. Hefler L.L. The intraoperative complication rate of nonobstetrics dilation and curettage// Obstetrics & Gynecology 2009; 113 (6): 1268-71.
20. Kasraeian M., Asadi N., Ghaffarpasand F., Karimi A.A. Value of transvaginal ultrasonography in endometrial evaluation of non-bleeding postmenopausal women// Climacteric. 2011; 14 (1): 126-31.
21. Mossa B., Torcia F., Avenoso F. Occurrence of malignancy in endometrial polyps during postmenopause// Eur J Gynaecol Oncol. 2010; 31 (2): 165-8.
22. Raouf S.A., Gupta P., Papaioannou S., Pradhan P. Endometrial thickness for invasive investigations in women with postmenopausal bleeding// Climacteric. 2011; 14 (1): 117-20.
23. Svirsky R., Smorgick N., Rozovski U. Can we rely on blind endometrial biopsy for detection of focal intrauterine pathology?// Am J Obstet Gynecol. 2008; 199 (2): 115. e 1-3.
24. Wethington S.L., Herzog T.J., Burke W.M. Risk and predictors of malignancy in women with endometrial polyps// Ann Surg Oncol. 2011; 18 (13): 3819-23.
25. Wolfman W., Leyland N., Heywood M. Asymptomatic endometrial thickening// J. Obstet Gynaecol Can. 2010; 32 (10): 990-9.