ацк при беременности что такое
Обследование и ведение беременных пациенток с наследственной предрасположенностью к тромбофилическим осложнениям и тромбофилиями различного генеза
Тромбофилия не является заболеванием, ее стоит рассматривать скорее как патологическое состояние или синдром, возникающие под воздействием комбинации постоянных или временных факторов риска, вызывающих тромбозы [3].
Показанием к обследованию пациенток является возникновение идиопатических тромбозов, инсультов, инфарктов, наличие выкидышей, тяжелого гестоза, преждевременной отслойки нормально расположенной плаценты, преждевременных родов на сроках до 34 недель, синдрома задержки роста плода при предыдущих беременностях, тромбозов, возникших на фоне приема контрацептивных препаратов или заместительной гормональной терапии (ЗГТ) [2]. Показаниями к лабораторной диагностике тромбофилии у пациентки является наличие следующих общих признаков патологии:
первая манифестация тромбоза в возрасте 13–20–30 лет;
артериальные и венозные тромбозы (от тромбоза поверхностных вен до ТЭЛА);
тромбоз на фоне применения непрямых антикоа- гулянтов (варфарин – снижение витамина К);
у новорожденных: неонатальная коагулопатия, фульминантная пурпура как причина смерти. Сведения о патологических состояниях получают прежде всего из анамнеза.
КОМПЛЕКСНОЕ ОБСЛЕДОВАНИЕ
Таким образом, обследование беременной в I триместре при постановке на учет либо пациентки, планирующей беременность, начинают именно со сбора подробного анамнеза, который включает в себя семейный анамнез: семейный акушерский, семейный тромботический (в том числе сведения о заболеваниях матери и отца в трудоспособном возрасте, такие как гипертония (ГБ), ишемическая болезнь сердца (ИБС), острое нарушение мозгового кровообращения (ОНМК) и др. Также важны анамнез экстрагенитальных заболеваний пациентки, диагностированных до или во время беременности (ГБ, СД, СКВ и др.), и оценка репродуктивной функции пациентки.
При привычном невынашивании беременности рекомендуются дополнительные виды исследований, такие как Д-димер, растворимый фибрин-мономерный комплекс (РФМК), тромбоэластография, уровень ингибитора активатора плазминогена, исследование на антифосфолипидный синдром (АФС) с интервалом 6 недель:
IgM и IgG кардиолипину, фосфолипидам, гликопротеиду;
Высокоинформативным является анализ на полиморфизм генов тромбофилии. Причем приказом МЗ РФ № 572-Н предусмотрены исследования на определение уровня протромбина, протеинов С и S. Дополнительно к приказу рекомендуется назначить исследование на гомоцистеин.
Оценить вероятность предтромботического состояния и развития тромбоза, а также эффективность и безопасность терапии в тромбоцитарном звене позволит определение количества тромбоцитов (PLT). В норме PLT составляет 180 – 320 х 109 /л, при тромбоцитозе более 350 х 109 /л и тромбоцитопении менее 100 х 109 /л.
СРЕДНИЙ ОБЪЕМ ТРОМБОЦИТОВ (MPV) СОСТАВЛЯЕТ 3,6–9,4 МКМ. ОТ РАЗМЕРА ТРОМБОЦИТА ЗАВИСЯТ СОДЕРЖАНИЕ В НЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЕГО СКЛОННОСТЬ КЛЕТОК К АДГЕЗИИ. СЛЕДУЕТ ПОМНИТЬ, ЧТО ОБЪЕМ ТРОМБОЦИТОВ ИЗМЕНЯЕТСЯ ПЕРЕД АГРЕГАЦИЕЙ, И ЧЕМ БОЛЬШЕ ОБЪЕМ ТРОМБОЦИТОВ, ТЕМ ОНИ «МОЛОЖЕ» [1]. ПРЕОБЛАДАНИЕ В КРОВИ МОЛОДЫХ ФОРМ ТРОМБОЦИТОВ НАБЛЮДАЕТСЯ ПРИ КРОВОПОТЕРЕ И СВИДЕТЕЛЬСТВУЕТ ОБ УСИЛЕННОЙ РЕГЕНЕРАЦИИ. УВЕЛИЧЕНИЕ УРОВНЯ СТАРЫХ И УМЕНЬШЕНИЕ СОДЕРЖАНИЯ ЗРЕЛЫХ ТРОМБОЦИТОВ ХАРАКТЕРНЫ ДЛЯ РАЗЛИЧНЫХ ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ, ИНТОКСИКАЦИЙ, ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ.
ОЦЕНКА ФУНКЦИОНИРОВАНИЯ СИСТЕМЫ КОАГУЛЯЦИИ
Агрегация тромбоцитов. Для определения исходной функции тромбоцитов, эффективности антиагрегантной терапии назначается исследование спонтанной агрегации тромбоцитов или исследование с применением индукторов: аденозиндифосфатом (АДФ), адреналином, коллагеном ристоцетином.
ОПРЕДЕЛЕНИЕ ДЛИТЕЛЬНОСТИ КРОВОТЕЧЕНИЯ – ВАЖНЫЙ И ИНФОРМАТИВНЫЙ ТЕСТ, КОТОРЫЙ ПОЗВОЛЯЕТ ОДНОВРЕМЕННО КАЧЕСТВЕННО ОЦЕНИТЬ КОЛИЧЕСТВО ТРОМБОЦИТОВ В КРОВИ, ИХ АДГЕЗИВНЫЕ И АГРЕГАЦИОННЫЕ СВОЙСТВА, ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ СТЕНКИ КРОВЕНОСНЫХ СОСУДОВ, А ТАКЖЕ ВЫРАЖЕННЫЙ ДЕФИЦИТ ПЛАЗМЕННЫХ ФАКТОРОВ СВЕРТЫВАНИЯ. В НОРМЕ ДЛИТЕЛЬНОСТЬ КРОВОТЕЧЕНИЯ СОСТАВЛЯЕТ 4–8 МИНУТ.
Агрегация тромбоцитов с АДФ показывает количество высвобождающихся собственных агонистов, содержащихся в гранулах тромбоцитов. Определение агрегации тромбоцитов с ристоцетином показано для диагностики болезни фон Виллебранда (увеличение времени кровотечения при нормальном количестве тромбоцитов и отсутствие явных причин для дисфункции тромбоцитов).
Удлинение времени кровотечения отражает на- рушение гемостаза вследствие тромбоцитопений, тромбоцитопатий врожденного и приобретенного генеза (нарушения функций тромбоцитов – адгезии и агрегации), нарушений сосудистой стенки или сочетания этих факторов. Время кровотечения мо- жет увеличиться при применении антиагрегантной терапии, синдроме диссеминированного внутрисосудистого свертывания (ДВС), синдроме «массивных» трансфузий. Увеличение длительности кровотечения при нормальном количестве тромбоцитов в крови позволяет предположить нарушение их функций.
Укорочение времени кровотечения характерно для гиперагрегации тромбоцитов.
Информативным для лечащего врача является также определение активированного частичного тромбопластинового времени (АЧТВ), которое при беременности в норме колеблется от 25 до 40 секунд. Удлинение АЧТВ свидетельствует о дефиците плазменных факторов коагуляции ниже 10–25 %, применении антикоагулянтов. Укорочение АЧТВ говорит о гиперкоагуляции, характерной для ДВС, а значит, необходимо решить вопрос о назначении антикоагулянтной терапии. При проведении терапии гепаринами осуществляется обязательный контроль АЧТВ: удлинение АЧТВ более чем в 2,5 раза от нормы перед очередным введением гепарина свидетельствует о высокой чувствительности к гепаринотерапии и требует снижения дозы.
ПРОТРОМБИНОВОЕ ВРЕМЯ (ПТВ) ПОЗВОЛЯЕТ ПРОИЗВЕСТИ ОЦЕНКУ ВНЕШНЕГО ПУТИ СВЕРТЫВАНИЯ КРОВИ 1 ФАЗЫ. В НОРМЕ ПТВ СОСТАВЛЯЕТ 12–16 СЕК. ЕГО УКОРОЧЕНИЕ ПОКАЗЫВАЕТ АКТИВАЦИЮ ВНЕШНЕГО ПУТИ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА, А УДЛИНЕНИЕ – ДЕФИЦИТ, ЧТО ОЗНАЧАЕТ НЕОБХОДИМОСТЬ НАЗНАЧЕНИЯ ЛЕЧЕНИЯ ФАКТОРАМИ ПРОТРОМБИНОВОГО КОМПЛЕКСА (ПРОТРОМПЛЕКС, НОВОСЕВЕН И ДР).
Удлинение ПТВ наблюдается при заболеваниях печени и желчного пузыря, нарушениях эвакуации желчи, циркуляции ВА, дефиците или аномалии факторов протромбинового комплекса [5].
В процессе коагуляции важна концентрация фибриногена, которая в норме составляет 2–4 г/л. Ее повышение может наблюдаться в последние месяцы беременности, после родов и хирургических операций, в период воспалительных и неопластических заболеваний, при легких формах гепатитов, в I-й фазе ДВС.
СНИЖЕНИЕ КОНЦЕНТРАЦИИ ФИБРИНОГЕНА ХАРАКТЕРНО ДЛЯ ТЯЖЕЛЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ, НАСЛЕДСТВЕННЫХ ГИПО-, АФИБРИНОГЕНЕМЙ, ПЕРВИЧНОГО ФИБРИНОЛИЗА, II И III СТАДИЙ ДВС, ПРИЧЕМ В ПОСЛЕДНЕМ СЛУЧАЕ ВАЖНЫ НЕ СТОЛЬКО ПОКАЗАТЕЛИ, СКОЛЬКО ДИНАМИКА, СКОРОСТЬ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ.
При активации системы фибринолиза (взаимо- действие плазмина с фибриногеном и фибрином) образуются растворимые комплексы мономеров фибрина (РФМК), которые не должны превышать 10 мг/л. РФМК расценивается как ранний признак ДВС. О хроническом ДВС свидетельствует постоянная циркуляция мономерных комплексов в крови.
Исследование на Д-димеры используется для диагностики ДВС. При добавлении специфической сыворотки определяется количество Д-димеров, по которым судят о фибринолизе. Д-димер не повышается у пациентов с дефицитом тканевого активатора плазминогена или высокой активностью ингибитора активатора плазминогена часто даже при тромбозе глубоких вен (ТГВ) и тромбозе легочной артерии (ТЭЛА).
Информативно исследование на определение процента активности белка-антикоагулянта антитромбина III, нормальный показатель – 80–120 %. Любое изменение концентрации (как снижение, так и повышение) может указывать на наличие генетических мутаций в гене антитромбина III. Уменьшение характеризует заболевания печени, причем в этом случае снижение концентрации АТ III пропорционально тяжести заболевания. Кроме того, более низкие значения возможны при введении пациенту нефракционированного гепарина (НФГ), который при низкой концентрации АТ III не дает ожидаемого эффекта. Снижение концентрации также может наблюдаться при шоковых состояниях (например, при острой почечной недостаточности (ОПН) и активации ингибиторов АТ III в крови).
Следует помнить, что показатели содержания АТ III снижаются в середине менструального цикла, в послеоперационном периоде, при синдроме ДВС, приеме оральных контрацептивов, эстрогенов.
Повышение концентрации АТ III характерно для вирусного гепатита, холестаза, может наблюдаться при дефиците витамина К, приеме антикоагулянтов непрямого действия (например, варфарина) или во время менструации.
ЗАКЛЮЧЕНИЕ
Для получения точной информации о состоянии пациентки лабораторные методы исследований дополняются инструментальными: УЗИ, ЭКГ и УЗДГ сосудов нижних конечностей. В соответствии с приказом Министерства здравоохранения Российской федерации УЗИ рекомендуется проводить:
при постановке на учет;
на сроке 11–14 недель;
на сроке 18–21 неделя;
на сроке 30–34 недели;
планово с 33 недель КТГ;
Желательно получить информацию максимально рано, чтобы принять решение для назначения лечения: при пренатальном обследовании, обследовании в I триместре беременности, при возникновении осложнений во время настоящей беременности.
1. Агаркова Т. А., Трифонова Е. А., Габитова Н. А. Анализ генетических маркеров наследственной тромбофилии и эндотелиальной дисфункции при осложненном течении беременности. Всероссийский научный форум «Мать и дитя», 11-й. Материалы. М 2010; 6–7.
2.Баркаган З. С. Руководство по гематологии. М: Ньюдиамед, 2005; 3: 416.
4. Ройтберг Г. Е., Струтынский А. В. Лабораторная и инструментальная диагностика заболеваний внутренних органов – М.: ЗАО «Издательство БИНОМ», 1999 г. – 622 с.
6.Clark P., Brennand J., Conkie J. at al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy // Thromb Haemost.. – 1998. – Вып. 79. – С. 1166–1170.
Холестаз при беременности — что это такое?
Гестационный холестаз — заболевание, которое может появиться ближе к концу беременности. Обычно это проявляется желтухой и стойким зудом. Заболевание проходит после родов, но часто повторяется при последующих беременностях. Требует симптоматического лечения и частого наблюдения за плодом.
Холестаз при беременности — что это такое?
Холестаз, представляет собой набор биохимических нарушений и клинических симптомов, которые проявляются при нарушении секреции желчных кислот в печени или затруднении оттока желчи по желчным путям. Обычными причинами холестаза являются отложения желчных камней или наличие опухолей в брюшной полости, таких как опухоли поджелудочной железы. У некоторых беременных холестаз может возникнуть спонтанно.
Основными причинами гестационного холестаза являются высокий уровень эстрогена в конце беременности и повышенная чувствительность клеток печени к этому гормону. Заболевание обычно проявляется в третьем триместре. Очень редко симптомы проявляются на ранних сроках беременности. Генетические факторы играют важную роль в случае холестаза во время беременности. Появление холестаза при первой беременности несет в себе высокий риск возникновения при второй и последующих беременностях.
Холестаз при беременности и последствия для ребенка
Первым симптомом обычно является кожный зуд. Он может быть очень стойким и значительно снижает качество жизни. Кожный зуд часто усиливается вечером и ночью. Через несколько недель появляются другие симптомы гестационного холестаза, такие, как пожелтение кожи и слизистых оболочек, а также более темная моча и изменение цвета стула. Иногда возникает жировая диарея. Эти симптомы, хотя и могут беспокоить, обычно не представляют значительной угрозы для здоровья матери.
Однако холестаз может быть опасен для ребенка. Наиболее частым осложнением являются преждевременные роды, влекущие, например, риск гипоксии.
К менее частым осложнениям относятся: снижение частоты сердечных сокращений плода и синдром аспирации мекония. В самых тяжелых случаях плод может погибнуть.
Холестаз при беременности — диагностика
Заподозрить холестаз беременной следует при появлении кожного зуда между 25 и 32 неделями беременности. О застое желчи свидетельствуют в основном биохимические нарушения. Лабораторные анализы крови показывают повышенные уровни желчных кислот и билирубина, а также повышенные уровни ферментов печени, в основном АЛТ, АСТ и щелочной фосфатазы (ЩФ). Эти показатели могут быть повышены при многих других заболеваниях печени и желчевыводящих путей.
Правильная интерпретация результатов важна. Холе стаз при беременности подтверждается повышенной концентрацией конъюгированного билирубина и превышением верхнего предела активности щелочной фосфатазы как минимум в два раза. Дифференциальный диагноз должен включать холестаз при вирусном гепатите и желчекаменной болезни. Эти заболевания следует особенно учитывать при появлении дополнительных симптомов или желтухе на ранних сроках беременности или в послеродовом периоде.
Холестаз при беременности — как лечить?
Урсодезоксихолевая кислота является основным препаратом, применяемым при лечении холестаза беременных. Этот препарат считается наиболее эффективным в борьбе с зудом. Также используются холестирамин и стероиды, в основном дексаметазон. Стероидные препараты также ускоряют созревание легких малыша, что важно в случае преждевременных родов.
Холестаз беременных требует частого наблюдения за беременностью, включая частоту сердечных сокращений и движений плода. При тяжелом холестазе с повышенным уровнем билирубина в крови некоторые врачи рекомендуют индукцию родов после того, как легкие ребенка достигают зрелости. Как правило, такая попытка делается на 36 неделе беременности.
Диета при холестазе при беременности
Желчь участвует в переваривании жиров. Нарушение секреции желчи также означает ухудшение всасывания жиров, в том числе незаменимых жирных кислот и жирорастворимых витаминов. Лучшие источники витаминов A и D — жирные молочные продукты, жирная морская рыба и печень. В случае тяжелых симптомов непереносимости жирной пищи может потребоваться соблюдение печеночной диеты с пониженным содержанием жира при холестазе.
В природе витамин A и D содержится в моркови, помидорах, тыкве и зеленом горошке. Листовые овощи, такие как шпинат, салат и петрушка, являются естественным источником витаминов Е и К. Несмотря на повышенное количество этих витаминов в рационе, может потребоваться их добавление. Добавки витамина К особенно важны, так как они необходимы для правильного свертывания крови. Использование любых витаминов в виде БАД или лекарств необходимо согласовывать с врачом.
Холестаз при беременности — последствия
Что такое преэклампсия (гестоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дубовой А. А., акушера со стажем в 13 лет.
Определение болезни. Причины заболевания
Преэклампсия — осложнение второй половины беременности, при котором из-за увеличения проницаемости стенки сосудов развиваются нарушения в виде артериальной гипертензии, сочетающейся с потерей белка с мочой (протеинурией), отеками и полиорганной недостаточностью. [1]
По сути, причиной преэклампсии является беременность: именно при ней возникают патологические события, в конечном счете приводящие к клинике преэклампсии. У небеременных преэклампсии не бывает.
В научной литературе описывается более 40 теорий происхождения и патогенеза преэклампсии, а это указывает на отсутствие единых взглядов на причины ее возникновения. Установлено, что преэклампсии чаще подвержены молодые и нерожавшие женщины (от 3 до 10%). [2] У беременных с планируемыми вторыми родами риск ее возникновения составляет 1,4-4%. [3]
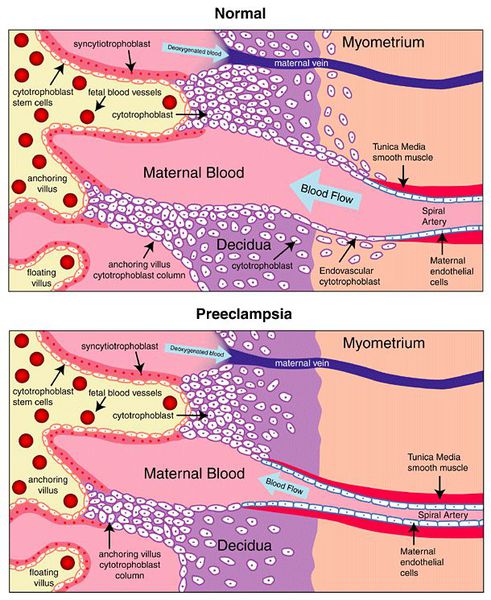
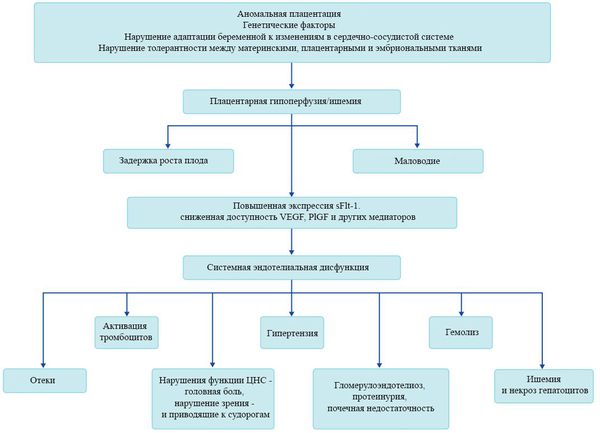
Пусковым моментом в развитии преэклампсии в современном акушерстве считается нарушение плацентации. Если беременность протекает нормально, с 7 по 16 неделю эндотелий (внутренняя оболочка сосуда), внутренний эластичный слой и мышечные пластинки участка спиральных артерий, вытесняется трофобластом и фибриносодержащим аморфным матриксом (составляющие предшественника плаценты — хориона). Из-за этого понижается давление в сосудистом русле и создается дополнительный приток крови для обеспечения потребностей плода и плаценты. Преэклампсия связана с отсутствием или неполным вторжением трофобласта в область спиральных артерий, что приводит к сохранению участков сосудистой стенки, имеющей нормальное строение. В дальнейшем воздействие на эти сосуды веществ, вызывающих вазоспазм, ведет к сужению их просвета до 40% от нормы и последующему развитию плацентарной ишемии. При нормальном течении беременности до 96% из 100-150 спиральных артерий матки претерпевают физиологические изменения, при преэклампсии же — всего 10%. Исследования подтверждают, что наружный диаметр спиральных артерий при патологической плацентации вдвое меньше, чем должно быть в норме. [4] [5]
Симптомы преэклампсии
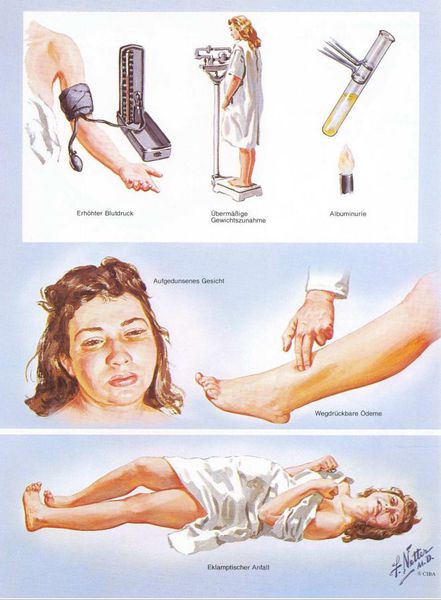
Раньше в отечественном акушерстве то, что сейчас называется термином «преэклампсия», называлось «поздний гестоз», а непосредственно под преэклампсией понимали тяжелую степень позднего гестоза. Сегодня в большинстве регионов России перешли на классификацию, принятую ВОЗ. Ранее говорили о так называемом ОПГ-гестозе (отеки, протеинурия и гипертензия).
1. Артериальная гипертензия
Преэклампсия характеризуется систолическим АД>140 мм рт. ст. и/или диастолическим АД>90 мм рт. ст., измеряется дважды с интервалом 6 часов. По меньшей мере два повышенных значения АД являются основанием для диагностики АГ во время беременности. Если есть сомнения, рекомендуется провести суточное мониторирование АД (СМАД).
2. Протеинурия
Чтобы диагностировать протеинурию, необходимо выявить количественное определение белка в суточной порции (в норме при беременности — 0,3 г/л). Клинически значимая протеинурия во время беременности определена как наличие белка в моче ≥ 0,3 г/л в суточной пробе (24 часа) либо в двух пробах, взятых с интервалом в 6 часов; при использовании тест-полоски (белок в моче) — показатель ≥ «1+».
Умеренная протеинурия — это уровень белка > 0,3 г/24 часа или > 0,3 г/л, определяемый в двух порциях мочи, взятой с интервалом в 6 часов, или значение «1+» по тест-полоске.
Выраженная протеинурия — это уровень белка > 5 г/24 часа или > 3 г/л в двух порциях мочи, взятой с интервалом в 6 часов, или значение «3+» по тест-полоске.
Чтобы оценить истинный уровень протеинурии, нужно исключить наличие инфекции мочевыделительной системы, а патологическая протеинурия у беременных является первым признаком полиорганных поражений. [1]
3. Отечный синдром
Триада признаков, описанная Вильгельмом Цангемейстером в 1912 г. (ОПГ-гестоз), сегодня встречается лишь в 25-39%. Наличие отеков в современном акушерстве не считается диагностическим критерием преэклампсии, но важно, когда нужно оценить степень ее тяжести. Когда беременность протекает нормально, отеки встречаются в 50-80% случаев, амбулаторное ведение безопасно для лёгкого отечного симптома. Однако генерализованные, рецидивирующие отеки зачастую являются признаком сочетанной преэклампсии (нередко на фоне патологии почек). [6]
Американский врач-хирург и художник-иллюстратор Фрэнк Генри Неттер, которого справедливо прозвали «Микеланджело медицины», очень наглядно изобразил основные проявления преэклампсии. [7]
Патогенез преэклампсии
В ответ на ишемию при нарушении имплантации (см. рисунок) начинают активно вырабатываться плацентарные, в том числе антиангиогенные факторы и медиаторы воспаления, повреждающие клетки эндотелия. [8] Когда компенсаторные механизмы кровообращения на исходе, плацента с помощью прессорных агентов активно «подстраивает» под себя артериальное давление беременной, при этом временно усиливая кровообращение. В итоге этого конфликта возникает дисфункция эндотелия. [9]
При развитии плацентарной ишемии активируется большое количество механизмов, ведущих к повреждению эндотелиальных клеток во всем организме, если процесс генерализуется. В результате системной эндотелиальной дисфункции нарушаются функции жизненно важных органов и систем, и в итоге мы имеем клинические проявления преэклампсии.
Нарушение плацентарной перфузии из-за патологии плаценты и спазма сосудов повышает риск гибели плода, задержки внутриутробного развития, рождения детей малых для срока и перинатальной смертности. [10] Кроме того, состояние матери нередко становится причиной прерывания беременности на раннем этапе — именно поэтому дети, родившиеся от матерей с преэклампсией, имеют более высокий показатель заболеваемости респираторным дистресс-синдромом. Отслойка плаценты очень распространена среди больных преэклампсией и связана с высокой перинатальной смертностью.
Классификация и стадии развития преэклампсии
Эклампсия – состояние, при котором в клинических проявлениях преэклампсии преобладают поражения головного мозга, сопровождаемые судорожным синдромом, который не может быть объяснен другими причинами, и следующим после него периодом разрешения. Эклампсия может развиться на фоне преэклампсии любой степени тяжести, а не является проявлением максимальной тяжести преэклампсии.
Осложнения преэклампсии
Основные осложнения преэклампсии:
Диагностика преэклампсии
Диагностика преэклампсии заключается прежде всего в установлении наличия указанных выше симптомов. В ряде случаев представляет сложность дифференциальная диагностика преэклампсии и существовавшая до беременности артериальная гипертензия.
Дифференциальная диагностика гипертензивных осложнений беременности
| Клинические признаки | Хроническая гипертензия | Преэклампсия |
|---|---|---|
| Возраст | часто возрастные (более 30 лет) | часто молодые ( [1] |
2. Антигипертензивная терапия
Цель лечения — поддерживать АД в пределах, которые сохраняют на нормальном уровне показатели маточно-плодового кровотока и снижают риск развития эклампсии.
Антигипертензивную терапию следует проводить, постоянно контролируя состояние плода, потому что снижение плацентарного кровотока провоцирует у него прогрессирование функциональных нарушений. Критерием начала антигипертензивной терапии является АД ≥ 140/90 мм рт. ст.
Основные лекарственные средства, используемые для лечения АГ в период беременности:
3. Профилактика и лечение судорог
Для профилактики и лечения судорог основным препаратом является сульфат магния (MgSO4). Показанием для противосудорожной профилактики является тяжелая преэклампсия, если есть риск развития эклампсии. При умеренной преэклампсии — в отдельных случаях решает консилиум, потому что при этом повышается риск кесарева сечения и есть ряд побочных эффектов. Механизм действия магния объясняется нарушением тока ионов кальция в гладкомышечную клетку.
Кроме того, необходимо контролировать водный баланс, уделять внимание лечению олигурии и отека легких при их возникновении, нормализации функции ЦНС, реологических свойств крови, улучшение плодового кровотока.
Прогноз. Профилактика
Сегодня до 64% смертей от преэклампсии предотвратимы.
Основные факторы качественной и своевременной помощи:
К сожалению, сегодня нет достаточно чувствительных и специфичных тестов, которые бы обеспечивали раннюю диагностику/выявление риска развития преэклампсии.
Факторы риска развития преэклампсии: [2]
1. антифосфолипидный синдром;
2. заболевания почек;
3. преэклампсия в анамнезе;
4. предстоящие первые роды;
5. хроническая гипертензия;
7. жительницы высокогорных районов;
8. многоплодная беременность;
9. сердечно-сосудистые заболевания в семье (инсульты/инфаркты у близких родственников);
10. системные заболевания;
12. преэклампсия в анамнезе у матери пациентки;
13. возраст 40 лет и старше;
14. прибавка массы тела при беременности свыше 16 кг.
Установлено, что для преэклампсии характерен недостаточный ангиогенез — процесс образования сосудов. [11] В нем участвуют около 20 стимулирующих и 30 ингибирующих ангиогенез факторов, их список постоянно пополняется. Наиболее изучен и представляют особый интерес с точки зрения исследования патогенеза преэклампсии два проангиогенных фактора: сосудисто-эндотелиальный фактор роста (VEGF) и плацентарный фактор роста (PlGF), антиангиогенный фактор — Fms-подобная тирозинкиназа (Flt-1) и ее растворимая форма (sFlt-1).
Повышение содержания этого sFlt-1 с одновременным снижением VEGF и PlGF начинается за 5-6 недель до клинических проявлений преэклампсии. [12] Данный факт позволяет прогнозировать развитие преэклампсии у женщин из группы риска в первом триместре беременности. Однако другими исследователями отмечено, что несмотря на высокую чувствительность теста (96%), изолированное определение sFlt-1 не может быть использовано при диагностике преэклампсии из-за низкой специфичности. Таким образом, обнаружение изменений в соотношении уровня PlGF и sFlt-1 в течение беременности может сыграть важную вспомогательную роль для подтверждения диагноза преэклампсии.
Сегодня существуют коммерческие наборы, которые позволяют проводить иммуноферментное исследование, чтобы определить вероятность развития преэклампсии, на основании определения содержания PlGF (DELFIA Xpress PlGF kit, PerkinElmer; США), предложены скрининговые тесты для прогнозирования и ранней диагностики преэклампсии, основанные на определении соотношения sFlt-1 и PlGF (Elecsys sFlt-1/PlGF, Roche, Швейцария).
Из-за нарушения инвазии трофобласта увеличивается сосудистое сопротивление в маточной артерии и снижается перфузия плаценты. Повышение пульсационного индекса и систолодиастолического отношения в маточной артерии в 11-13 недель беременности является лучшим предиктором преэклампсии, и его настоятельно рекомендуется использовать в клинической практике у беременных из группы риска.
Из-за того, что исчерпывающая информация об этиологии и патофизиологии преэклампсии отсутствует, разработка эффективных профилактических мер представляет определенные трудности.
Сегодня доказан прием только 2 групп препаратов для профилактики преэклампсии: [1] [2]
• Аспирин в низких дозах (75 мг в день), начиная с 12 недель до родоразрешения. При этом необходимо брать письменное информированное согласие пациентки, поскольку согласно инструкции по применению, прием аспирина противопоказан в первом триместре.
• Беременным с низким потреблением кальция (