исследование костного мозга при онкологии молочной железы
Инновационный метод ранней иммунологической диагностики метастазов – тест на циркулирующие опухолевые клетки!
МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» обладает уникальными инновационными лабораторными исследованиями, позволяющими установить наличие циркулирующих опухолевых клеток, провоцирующих образование метастазов.
Людмила Гривцова – к.м.н, д.б.н., заведующая отделом лабораторной медицины, лаборатории клинической иммунологии МРНЦ имени А.Ф. Цыба.
Это важно знать пациентам с онкологическим диагнозом!
Что такое ЦОК?
Появление метастазов значительно ухудшает прогноз для онкологического больного и снижает благоприятный исход лечения. Поэтому раннее выявление метастазов уже существующего рака – очень важная составляющая для прогноза заболевания и лечения пациента.
Циркулирующие Опухолевые Клетки (ЦОК), иными словами клетки опухоли, присутствующие в периферической крови – одна из важных причин рецидива болезни и возникновения отдаленных метастазов. Современные лабораторные методы позволяют определять, как количество ЦОК, так и оценивать их качество и жизнеспособность, то есть факторы, связанные с вероятностью формирования отдаленных клинически значимых метастазов болезни.
Это важно знать!
Есть еще один отрицательный момент, единичные ЦОК по кровеносным и лимфатическим сосудам попадают в мозг, легкие, печень, костную ткань, позвоночник, почки и т. д., где могут сохраняться в дремлющем состоянии продолжительное время или при определенном стимуле могут достаточно быстро оседать в органах-мишенях и формировать метастаз
Считается, что эти клетки устойчивы (т. е. резистентны) к химиолучевой терапии. Поэтому важна комплексная оценка ЦОК в динамике, то есть вовремя и после проведенного комплексного лечения. При выявлении ЦОК больной может быть условно отнесен в группу высокого риска метастазирования.
При каких заболеваниях можно выявить ЦОК?
Циркулирующие опухолевые клетки можно выявить в большинстве эпителиальных опухолей (аденокарцином), а также при меланоме. Их наибольшая прогностическая значимость на данное время определена для опухолей молочной железы, рака простаты и колоректальных раков. Пороговыми значениями считаются Контактная информация
+7 (495) 150-11-22 многоканальный телефон (Москва) – с 08.-20.00
+ 7 (484) 399–31–30 многоканальный телефон – с 08.-20.00, г. Обнинск
КОМПЛЕКС ПО ПРЕДОСТАВЛЕНИЮ МЕСТ ДЛЯ ВРЕМЕННОГО ПРОЖИВАНИЯ
249036, Калужская область, г. Обнинск, ул. Королёва, д. 4
ФГБУ «НМИЦ радиологии»
МНИОИ им. П.А. Герцена
тел.:+7 (495) 150-11-22
НИИ урологии и интервенционной
радиологии им. Н.А. Лопаткина
тел.:+7 (499) 110-40-67
© 2021 — Официальный сайт «НМИЦ радиологии» Минздрава России.
Политика конфиденциальности
Что нужно знать о метастатическом раке груди в кости
Костные метастазы рака груди — это вторичные злокачественные очаги. Они возникают в костной ткани после попадания в нее опухолевых клеток молочной железы. Такому онкологическому заболеванию всегда присваивается четвертая стадия по степени тяжести.
Причины метастазов рака груди
Раковые опухоли груди — вторая по частоте встречаемости онкопатология у женщин. Изредка это заболевание поражает и мужчин. В молочной железе оно способно давать метастазы — отдельные опухолевые клетки, которые отрываются от первичного очага и с током крови или лимфы переносятся в другие, иногда достаточно отдаленные, органы и ткани. Там они оседают и дают рост вторичным опухолевым очагам.
Рак молочных желез наиболее часто метастазирует в:
При этом костная ткань — наиболее частая мишень для распространения метастазов из опухолей груди. Примерно 80% всех костных метастазов происходят из молочных желез, а также из раковых опухолей предстательной железы и легких. Конкретная локализация вторичных очагов в костях может быть различной. Однако они образуются преимущественно в:
Высокая частота распространения метастазов в кости обусловлена тем, что костная система постоянно подвергается ремоделированию. Старые ткани постепенно отмирают и заменяются новыми на протяжении всей жизни человека. Опухолевые клетки, попадая в эту динамическую биологическую среду с хорошим кровоснабжением, быстро начинают активный рост. В зависимости от конкретной зоны кости, где развился вторичный опухолевый очаг, он может приводить к разрушению костных структур или к патологическому перепроизводству ткани.
Симптомы костных метастазов
Обычно первыми проявлениями этой патологии становятся внезапные переломы, возникающие при очень слабых физических воздействиях. Если опухоль сдавливает нервные пути, проходящие рядом с костями, это может вызывать локальную болезненность или нарушения чувствительности. Тип и тяжесть симптоматики может меняться в зависимости от того, где именно возникла метастатическая опухоль и какие размеры она имеет.
Иногда метастазы в костях обнаруживают еще до того, как будет поставлен диагноз. Однако вторичные костные очаги могут выявлять и через несколько лет после успешного лечения рака молочных желез.
Диагностика костных метастазов
Для обнаружения метастазов используют различные методы визуализации:
Из лабораторных исследований значение имеет анализ крови. В нем может наблюдаться увеличение концентрации кальция и щелочной фосфатазы. Наконец, используется пункционная биопсия. Взятый материал отправляют на гистологическое исследование, которое и устанавливает окончательный диагноз.
Лечение костных метастазов
К сожалению, вторичные опухолевые очаги в костях очень плохо поддаются лечению. Обычно основные усилия врачей направлены на замедление роста опухоли, а также улучшение состояния пациента при помощи паллиативной терапии. Используемые препараты позволяют:
Кроме того, в некоторых случаях показаны лучевое лечение метастазов, гормональная терапия и проведение хирургических вмешательств.
Прогноз при метастатическом раке костей
Вторичные опухолевые очаги в костях обычно имеют неблагоприятный прогноз. Однако некоторые люди после постановки такого диагноза продолжают жить полноценной жизнью. Ее качество для пациента будет зависеть от ряда факторов, основные из которых — это:
Некоторые исследования показывают, что средняя годовая выживаемость людей с метастатическим раком костей составляет 40–60%. Так, исследование, проведенное в 2017 году в Дании, продемонстрировало, что годовая выживаемость среди людей с метастатическим раком костей немного выше, если источником заболевания является рак груди, а не простаты или легких. Среднюю выживаемость таких пациентов ученые определили в промежутке между 12 и 33 месяцами после обнаружения метастазов в костной ткани.
Лечение костных метастазов рака груди в Турции
Врачи турецкой клиники «Анадолу» проводят диагностику и лечение злокачественных опухолей молочной железы и их метастазов в соответствии со строгими мировыми стандартами. Здесь используется наиболее современное оборудование и лечебные методики, врачи широко применяют:
Для лечения костных метастазов онкологи «Анадолу» используют высокоточные методы диагностики, гормонотерапию, химиотерапию в соответствии с протоколами, утвержденными ВОЗ, лечение при помощи установки КиберНож и других современных методов лучевой терапии.
Психологическая поддержка
Онкологическое заболевание — это всегда серьезная стрессовая ситуация, связанная с сильным негативным эмоциональным потрясением. Человека, который столкнулся с этим заболеванием, должны окружать его родные и близкие, оказывать ему всестороннюю поддержку. Кроме того, важна и профессиональная психологическая помощь, получить которую можно в специальных группах и у специалистов в форме консультирования. Главное, чтобы человек не оставался со своим заболеванием один на один. Врачи «Анадолу» прекрасно знают о важности психологической поддержки, поэтому пациент всегда может рассчитывать на заботливое и внимательное отношение.
Материал подготовлен по согласованию с врачом «Анадолу» терапевтом и медицинским онкологом Ешим Йилдырим.
Перспективы исследования популяционного состава лимфоцитов костного мозга при наличии в нем микрометастазов рака молочной железы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Реферат. Диагностика метастазов рака молочной железы в костный мозг является трудной задачей при классическом цитологическом исследовании миелограмм у больных с локализованными формами рака молочной железы. Применение новых технологий, включая исследование состояния иммунологии костного мозга, является перспективным в диагностике микрометастазов рака молочной железы в костный мозг.
Ключевые слова: рак молочной железы, костный мозг, микрометастазы, CD4, CD8, CD25, +СD45, СD326, HCA-DR, NK-клетки, TCRγδ-лимфоциты, рецепторы стероидных гормонов, Her-2/neu, пролиферативная активность, проточная цитометрия, врожденная противоопухолевая резистентность.
Рак молочной железы (РМЖ) является самой распространенной злокачественной опухолью среди женщин в России и большинстве стран мира. В России в 2008 г. РМЖ был диагностирован у 51 865 женщин. Стандартизованный показатель заболеваемости РМЖ в России составил 42,7 на 100 тыс. женщин. В 2008 г. в России от РМЖ умерло 23 064 больных (17,4% в структуре смертности) [1].
Достоверное определение стадий РМЖ до начала лечения остается важной задачей, поскольку позволяет оценить прогноз, обсудить варианты терапии, прямые терапевтические стратегии и в целом сделать обзор возможностей лечения.
Результаты лечения РМЖ нельзя признать удовлетворительными. При длительном наблюдении (5 и более лет) отдаленные метастазы развиваются примерно у трети больных. В последние годы доказано, что диссеминация опухолевого процесса может происходить уже на ранних стадиях РМЖ. Это доказано на основании обнаружения циркулирующих в крови и диссеминированных в костном мозге опухолевых клеток. Именно эти клетки являются причиной развития гематогенных метастазов спустя годы после, казалось бы, радикального оперативного вмешательства.
Благодаря успехам биохимии и молекулярной биологии в настоящее время в арсенале исследователей и клиницистов имеется огромное количество биологически значимых показателей, которые могут помочь в определении прогноза РМЖ и выборе терапии. Однако пока основными прогностическими факторами остаются наличие и число пораженных метастазами лимфоузлов, а также размеры первичной опухоли, степень ее дифференцировки, иммуногистохимическое исследование рецепторов стероидных гормонов, экспрессия Her-2/neu, пролиферативная активность опухоли, возраст и менструальная функция больной.
Методы адъювантной терапии постоянно совершенствуются, в ежедневной практике используются новые препараты, в клинических исследованиях изучаются различные режимы химиотерапии. Однако, несмотря на это, значительная частота отдаленного метастазирования в различные сроки после адъювантной химиотерапии (особенно у больных из группы высокого риска) свидетельствует или о неспособности современной химиотерапии искоренить все скрытые микроочаги рака, или о недостаточно индивидуальном подборе вида системного лечения в связи с ограниченными возможностями современных прогностических факторов. Поэтому поиск новых маркеров, свидетельствующих о ранней диссеминации опухолевого процесса и позволяющих назначить индивидуальное, целевое системное лечение и оценить его эффективность, представляется актуальным направлением исследований. Одним из таких показателей могло бы стать содержание опухолевых клеток в костном мозге.
Диссеминированные опухолевые клетки находятся в костном мозге в так называемом «дремлющем состоянии», когда обменные процессы замедлены, и клетка не пролиферирует. Подобные клетки практически нечувствительны к химиотерапии. Вместе с тем доказано, что иммунная система костного мозга препятствует развитию метастазов из диссеминированных в костном мозге опухолевых клеток. Костный мозг все чаще в исследованиях последних лет называют главным органом противоопухолевого иммунитета.
В ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН накоплен определенный опыт по изучению диссеминированных в костном мозге опухолевых клеток при РМЖ. В работе О.В. Крохиной и соавт. (2005) заложены основы оценки влияния диссеминированных опухолевых клеток и микрометастазов РМЖ на кроветворение. Показано, что на ранних, операбельных стадиях РМЖ частота обнаружения опухолевых клеток в костном мозге составляет 30%, в то время как цитологически эти клетки обнаруживаются лишь в 5% случаев. Особенности костномозгового кроветворения при наличии диссеминированных опухолевых клеток состоят в изменении клеточности, процентного содержания лимфоцитов и моноцитов в миелограмме, а также кластеров плазматических клеток. Вместе с тем состояние иммунной системы костного мозга не изучалось.
Учитывая то, что на сегодняшний день отсутствуют методы селективного воздействия на опухоль, а также то, что именно иммунные клетки способны препятствовать развитию явных метастазов, представляется целесообразным исследование иммунной системы костного мозга, поиск особенностей, связанных с микрометастатическим поражением.
Считаем важным и своевременным проведение исследования субпопуляционного состава лимфоцитов, выделенных из материала костного мозга у больных РМЖ, с использованием иммуномагнитного обогащения эпителиальных клеток костного мозга и общеэпителиальных антител СD326 (EpCAM), меченных иммуномагнитными частицами, проточно-цитометрическое определение диссеминированных опухолевых клеток в костном мозге на основе EpCAM +СD45 фенотипа [Тупицын Н.Н., 2009].
В настоящее время известны, по крайней мере, две крупные работы по изучению субпопуляционного состава зрелых лимфоцитов костного мозга при его опухолевом поражении. В работе О.П. Колбацкой и Н.Н. Тупицына (2011) показано, что состав Т-лимфоцитов взаимосвязан с вариантом острого лейкоза и различается при острых миелобластных и острых лимфобластных лейкозах. В работе Т.В. Горбуновой и соавт. (2012) установлены особенности иммунной системы костного мозга у детей, больных саркомами, в сравнении с нормой, а также особенности эффекторных клеток в зависимости от гистогенеза саркомы (саркома Юинга, рабдомиосаркома). Одним из наиболее важных фактов, установленных в этих работах, является обнаружение дефектов врожденного иммунитета (NK-клеток, TCRγδ-лимфоцитов) по мере опухолевой прогрессии и развития метастазов. Эти факты на новом уровне подтверждают экспериментальные работы Г.И. Дейчман (1982) и открывают перспективы развития иммунотерапии солидных новообразований человека.
В отношении РМЖ подобные вопросы разработаны мало, и актуальность поиска механизмов активации противоопухолевой иммунной защиты, препятствующих развитию метастазов из диссеминированных в костном мозге опухолевых клеток, представляется совершенно очевидной.
Является также актуальной комплексная оценка иммунологического выявления диссеминации РМЖ в костном мозге с уточнением степени гематогенного распространения РМЖ при различных клинических стадиях его развития и оценкой показателей костномозгового кроветворения у больных при наличии и отсутствии микрометастазов. Важнейшим материалом для выявления микрометастазов в костный мозг являются показатели иммунологического статуса костного мозга – врожденный иммунитет, Т-клеточный иммунитет. Наряду с детальным морфологическим исследованием миелограмм и оценкой клеточности костного мозга обязательными являются иммуномагнитное обогащение эпителиальных клеток костного мозга с использованием общеэпителиальных антител СD326 (EpCAM), меченных иммуномагнитными частицами, и проточно-цитометрическое определение диссеминированных опухолевых клеток в костном мозге на основе EpCAM +СD45 фенотипа [8].
Субпопуляционный состав интратуморальных лимфоцитов у больных раком молочной железы имеет важное клиническое значение. Известно, что при операбельном раке молочной железы с учетом субпопуляционного состава интратуморальных лимфоцитов можно выделить группы пациенток с благоприятным и неблагоприятным прогнозом [6, 7].
Для оценки субпопуляций лимфоцитов костного мозга планируется использовать метод трехцветной проточной цитометрии. При этом будут изучены субпопуляции зрелых Т-лимфоцитов (СD4, СD8), активация антигена СD25, HCA-DR, Т-клеточные рецепторы (TCR)gd и ab, В-лимфоциты, а также натуральные киллеры.
Таким образом, исследование костного мозга позволяет установить особенности клеточного состава и особенности иммунной системы костного мозга у больных с наличием диссеминированных опухолевых клеток. Обнаружение микрометастазов в костном мозге у больных РМЖ будет способствовать более точному стадированию РМЖ. Оценка иммунологических показателей поможет установить звенья иммунодефицита для разработки в дальнейшем методов иммунокоррекции, направленных на стимуляцию эффекторных звеньев противоопухолевого иммунитета в костном мозге.
Исследование костного мозга при онкологии молочной железы
В структуре онкологической заболеваемости женского населения России РМЖ устойчиво занимает первое ранговое место, составляя при этом 20,4 % [5]. Средняя продолжительность жизни больных диссеминированным РМЖ не превышает 24 месяцев. По данным B. Fisher, около 35 % больных РМЖ во время выявления первичной опухоли имеют клинически определяемые метастазы, кроме того, еще 30–35 % больных имеют микрометастазы, которые в дальнейшем клинически манифестируют [7]. В итоге результаты лечения больных РМЖ остаются неудовлетворительными (прирост грубого показателя смертности за последние 10 лет составил 7,56 %) [5].
Диагностика гематогенного распространения эпителиальных опухолей на ранних стадиях – одна из главных проблем онкологии. Морфологически единичные разрозненные опухолевые клетки не определяются – требуется применение высокочувствительных иммунологических методов. К ним в настоящее время относятся иммуноцитологические (иммуноцитохимический, проточная цитометрия) методы и молекулярно-биологические (RT-PCR) методы. Иммунологические методы исследования костного мозга значительно различаются по своей чувствительности и специфичности, технической сложности и стоимости. Для того чтобы контролировать эффективность воздействия лекарственных средств на микрометастазы нужно, в первую очередь, стандартизировать методы количественной оценки единичных диссеминированных опухолевых клеток. Речь идет об иммунологическом стадировании рака [4]. В клинической практике пока не найдено рутинных методов обнаружения микрометастазов. Методы исследования костного мозга нуждаются в дальнейшем развитии. Однако уже накапливаются данные о том, что количественное определение и характеристика диссеминированных опухолевых клеток позволяют получить важную прогностическую информацию и проводить мониторинг эффективности терапии. По мере того как методы исследования станут стандартизированными, с приемлемой чувствительностью и специфичностью, это позволит сделать еще один шаг к индивидуализации антиметастатической терапии [1].
В связи с тем, что диссеминированные опухолевые клетки присутствуют в костном мозге в малых количествах, для увеличения чувствительности иммунологических методов исследования были разработаны методы обогащения популяции клеток-мишеней. Техника обогащения включает большую панель технологий, в основе которых лежат различные свойства диссеминированных опухолевых клеток, отличающие их от нормальных гематопоэтических клеток. Стандартной процедурой считается метод градиентной сепарации Ficoll. Кроме того, большинство современных технологий основано на экспрессии молекулы адгезии эпителиальных клеток (EpCAM). Применение, в частности, метода иммуномагнитного обогащения клеток и проточной цитометрии позволяет оценивать до 50 млн миелокариоцитов у одного больного. Для сравнения ‒ иммуноцитологически на цитоцентрифужных препаратах можно оценить обычно 1–2 млн миелокариоцитов [1].
Ранее нами было проведено исследование, в котором изучался костный мозг у 50 больных РМЖ с помощью цитологического, гистологического и иммуноцитохимического методов. От общего числа больных, включенных в исследование, микрометастазы в костный мозг были обнаружены у 19 (38 %) пациенток. Комбинация различных методов диагностики существенно не повысила вероятность выявления опухолевых клеток в костном мозге. Наиболее информативными в плане определения оккультных метастазов в костный мозг были иммуноцитохимический (63,2 %) и гистологический (57,9 %) методы. Таким образом, чтобы максимально повысить вероятность диагностики метастазов в костный мозг, целесообразно одновременно пользоваться обоими методами. Что становится весьма актуальным для правильного стадирования опухолевого процесса и составления дальнейшего плана лечения [3].
Целью настоящей работы явилось установление степени гематогенной диссеминации РМЖ на основании обнаружения диссеминированных опухолевых клеток высокочувствительным иммуноцитологическим методом с применением моноклональных антител к эпителиальным антигенам.
Материалы и методы исследования
В работе использованы материалы клинического, морфологического, иммуноцитологического обследования 28 больных РМЖ, находящихся на лечении в ГУЗ «Областной клинический онкологический диспансер» с ноября 2011 г. по настоящее время. На проведение данного исследования было получено разрешение этической комиссии ФГБОУ ВПО «Ульяновский государственный университет». Исследования проводились с соблюдением законодательства РФ, этических норм и принципов Декларации Хельсинки (1964) со всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериалах, полученных от людей, а также международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Все первичные данные пациенток были обезличены в соответствии с требования п. 3 ст. 6 действующего Федерального закона РФ 152-ФЗ «О персональных данных».
В исследуемую группы вошли женщины в возрасте от 33 до 74 лет. Средний возраст составил 56 ± 11,0 лет. На момент постановки первичного диагноза пациентки распределились по стадиям следующим образом: I стадия была диагностирована у 1 (3,6 %) больной, IIА – у 7 (25 %), IIВ – у 3 (10,7 %), IIIА – у 6 (21,4 %), IIIВ – у 3 (10,7 %), IIIC – у 4 (14,3 %), IV – у 4 (14,3 %). Наиболее частым гистологическим вариантом был инфильтративный смешанный рак (42,9 %). Отмечена достаточно высокая частота инфильтративного протокового рака (28,6 %). Реже встречались инфильтративный дольковый рак (21,4 %) и другие формы рака (медуллярный, папиллярный, тубулярный) – 7,1 %. Больным было проведено стандартное клиническое обследование. Исследование костного мозга до начала лечения выполнялось как стандартными цитологическим и гистологическим методами, так и методом проточной цитометрии с применением МКА к цитокератинам EpCAM (CD326). Материал для цитологического исследования и проточной цитометрии получали с помощью стернальной пункции. Объем костномозгового пунктата не превышал 0,5 мл, т.к. при большем объеме возможно разбавление образца периферической кровью. Проточная цитометрия проводилась на базе лаборатории иммунологии гемопоэза ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН (руководитель – д.м.н., проф. Н.Н. Тупицын). Исследование проводилось в координатах CD45/CD326. Предварительно было проведено иммуномагнитное обогащение клеток, связывающих антитела CD326 (EpCAM). Это позволило оценивать до 50 млн миелокариоцитов у одного больного. Подсчет клеток миелограммы и их анализ производился в клинической лаборатории. Для гистологического исследования выполнялась трепанбиопсия задне-верхней ости подвздошной кости с двух сторон.
Результаты исследования и их обсуждение
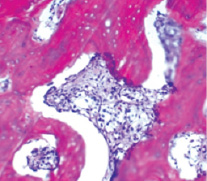
При стандартном цитологическом исследовании метастазы в костный мозг не были выявлены ни у одной из 28 пациенток. У 5 из 28 больных в микропрепаратах были обнаружены «единичные недифференцированные клетки неясного происхождения, возможно, негемопоэтической природы». При проточной цитометрии у 2 из этих 5 пациенток выявлены микрометастазы в костном мозге. При гистологическом исследовании трепанобиоптатов лишь у 1 (3,6 %) пациентки были обнаружены метастазы в костный мозг (рис. 1). Исходная стадия у этой пациентки была расценена как T4N3aM0 (IIIC), после гистологического обнаружения метастазов в костный мозг стадия была изменена на IV. При дополнительной остеосцинтиграфии у этой пациентки были выявлены множественные остеопластические метастазы в кости, не подтвержденные рентгенологически. Метастазы в костный мозг в данном случае были подтверждены методом проточной цитометрии.
Рис. 1. Микрофото метастаза инфильтрирующего рака молочной железы в костном мозге больной Д., 58 лет. Окр. гематоксилином и эозином, ×200
У 3 из 28 больных в трепанобиоптатах были обнаружены единичные клетки, подозрительные на раковые, что не было подтверждено иммуноцитологически. Еще у 7 больных в трепанобиоптатах были обнаружены единичные плазматические клетки или микроочаговое их скопление, что является косвенным признаком поражения костного мозга. При проточной цитометрии у 2 из этих 7 пациенток были обнаружены микрометастазы.
Эпителиальные (опухолевые) клетки в образцах костного мозга были выявлены у 24 (89,3 %) из 28 пациенток с помощью проточной цитометрии с применением моноклональных антител ЕрСАМ (CD326). Важно то, что количество опухолевых клеток, определяемых иммуноцитологически, было очень низким и варьировалось от 1 до 118 клеток в образце, что в 82,2 % случаев составило менее 1 клетки на 1 млн миелокариоцитов. Лишь у 5 (17,8 %) из 28 больных было выявлено ≥ 1 (максимум – 10) эпителиальных клеток на 1 млн миелокариоцитов. У двух пациенток была установлена IV стадия РМЖ (T4N3сM1). У одной имелись метастазы в позвоночнике, грудине, легких, плевре. У другой было выявлено поражение селезенки, внутрибрюшных, забрюшинных лимфатических узлов, яичников. Костный мозг обеих пациенток, как показали миелограммы и трепанобиоптаты, был гипоклеточным (особенно это касалось красного ростка). У двух других пациенток изначально была диагностирована IIA стадия РМЖ. Еще у одной больной изначально была диагностирована IIIB стадия, причем у нее были выявлены метастазы в трепанобиоптате, что потребовало проведения рестадирования – была выставлена IV стадия заболевания (об этом было сказано ранее).
Если считать положительной реакцию при наличии 1 метастатической клетки среди 1 миллиона мононуклеарных клеток (МНК) костного мозга (сумма количества лимфоцитов, моноцитов и плазматических клеток), то число таких пациенток составило 21 (75 %) из 28. При этом только у 3 (10,7 %) из 28 больных число клеток было ≥ 10. У двух больных было выявлено наибольшее число клеток на 1 млн МНК – 32 и 35 соответственно.
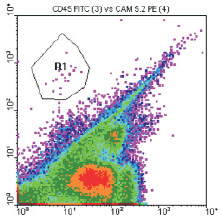
Четкий кластер опухолевых клеток при проведении проточной цитометрии был диагностирован у 4 (14,3 %) из 28 пациенток (рис. 2).
При этом число клеток в образцах костного мозга было очень низким: у одной пациентки (IIA стадия) число опухолевых клеток на 1 млн миелокариоцитов равнялось одной, у трех остальных (IIB, IIIA и IIIB стадии) – менее одной клетки. При пересчете на 1 млн МНК это число составило 6, 2, 6 и 4 клетки соответственно.
Полагая, что обнаружение одной изолированной опухолевой клетки может быть диагностически незначимым, ряд исследователей попытался количественно определить «критическую» опухолевую нагрузку, превышение которой достоверно было бы связано с ростом частоты рецидива заболевания. Было показано, что количество рецидивов рака молочной железы резко возрастает при обнаружении в костном мозге 10 или 15 изолированных опухолевых клеток [6]. В нашем исследовании не была прослежена общая и безрецидивная выживаемость в связи с небольшим сроком от начала исследования. Однако одна больная с IV стадией РМЖ, у которой были подтверждены микрометастазы в костный мозг, погибла от прогрессирования заболевания во время проведения ей второго курса химиотерапии.
Рис. 2. Цитограмма больной раком молочной железы Б., 74 лет, IIB стадия, с микрометастазом в костном мозге, выявленным методом проточной цитометрии. Область R1 – это «кластер» из 20 CD45-негативных клеток (ось абсцисс), положительных в реакции с антителами к молекуле адгезии эпителиальных клеток EpCAM (CD326) – ось ординат
В работе Крохиной О.В. и соавт. (ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН) было сделано предположение, что к наиболее ранним проявлениям реакции костного мозга на присутствие отдельных опухолевых клеток можно отнести следующие изменения кроветворения по данным миелограмм: гипоклеточность костного мозга, скопления плазматических клеток, обнаружение крупных клеток с гиперхромным ядром и множественными нуклеолами, повышение лейко-эритробластического отношения, повышенные средние значения количества моноцитов и лимфоцитов [2].
В нашем исследовании в целом у пациенток были обнаружены следующие изменения в миелограммах: снижение клеточности костного мозга (28,6 %), повышение, а также снижение лейко-эритробластического соотношения (25,0 % и 14,3 %, соответственно), повышенные значения количества моноцитов (42,9 %), лимфоцитов (46,4 %) и плазмацитов (10,7 %). У 5 (17,9 %) пациенток из 28 были обнаружены «единичные недифференцированные клетки неясного происхождения, возможно, негемопоэтической природы». У 2 из них были выявлены микрометастазы. Поскольку все эти изменения кроветворения с различной частотой имелись как у пациенток с микрометастазами, так и без них, мы пока не можем утверждать об ассоциации этих признаков с присутствием отдельных опухолевых клеток в костном мозге.
Возможность выявления единичных опухолевых клеток в костном мозге вследствие большей чувствительности является главным преимуществом метода проточной цитометрии в диагностике диссеминированных опухолевых клеток рака молочной железы в костный мозг по сравнению с морфологическими методами исследования: в 5 (17,8 %) и 1 (3,6 %) случаях из 28 соответственно. Следовательно, метод проточной цитометрии позволяет более точно судить о степени гематогенной диссеминации РМЖ в костный мозг, чем стандартные морфологические методы. В то же время обнаружение малого количества опухолевых клеток при проведении проточной цитометрии сложно трактовать в тех случаях, где они не формируют четкого кластера. При наличии такого кластера микрометастазы могут быть констатированы даже при наличии менее 1 опухолевой клетки на 1 миллион миелокариоцитов. Пока остается неясным диагностически значимое пороговое значение количества единичных опухолевых клеток в костном мозге у больных РМЖ. Нет четких данных о том, какова «критическая» опухолевая нагрузка костного мозга, превышение которой было бы связано с ростом частоты рецидива заболевания. На основании анализа миелограмм пока не удалось выявить косвенные признаки присутствия опухолевых клеток рака молочной железы. Работа в данном направлении будет продолжена.
Представленные нами данные демонстрируют необходимость внедрения в клиническую практику иммунологического исследования костного мозга, особенно на ранних стадиях рака молочной железы, для оценки распространенности опухолевого процесса. Методы исследования костного мозга нуждаются в дальнейшем развитии, а оценка значимости обнаружения диссеминированных опухолевых клеток и микрометастазов в костном мозге возможна после анализа результатов общей и безрецидивной выживаемости у данных больных.
Авторы заявляют об отсутствии каких бы то ни было конфликтов интересов с кем бы то ни было в отношении идеи, планирования, выполнения и опубликования результатов настоящего исследования и их последующего использования в коммерческих или иных целях.
Работа поддержана гос. заданием Минобрнауки РФ. Шифр гос. задания 4. 1219. 201.
Рецензенты:
Чарышкин А.Л., д.м.н., профессор, заведующий кафедрой факультетской хирургии, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Хайруллин Р.М., д.м.н., профессор, заведующий кафедрой анатомии человека, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.