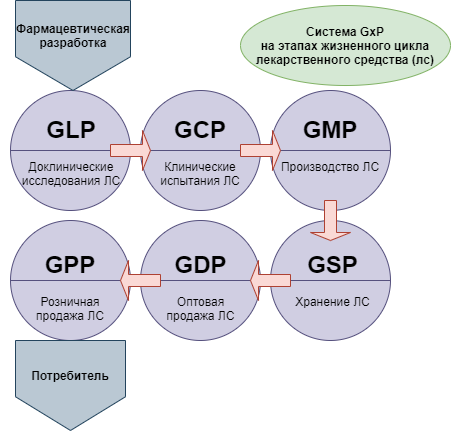
к международным стандартам надлежащих практик в области фармацевтической деятельности относятся
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
Принятие решения о выдаче заключения по результатам инспекционного отчета
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Ответы на тест НМО «Основы системы управления качеством в аптеке»
1. В иерархии документации системы управления качеством в аптеке главным документом должен быть
1) политика в области качества;+
2) регистрирующие документы;
3) руководство по качеству;
4) технологическая документация.
2. В соответствии со стандартами ISO серии 9000:2000 качество – это
1) отличные характеристики продукции и отсутствие жалоб потребителя;
2) соответствие процесса или продукции нормативной документации;
3) степень соответствия характеристик продукции, процесса или системы существующим или предполагаемым потребностям;+
4) то, что удовлетворяет потребителя.
3. Валидацией называются
1) действия, приводящие к высокой степени уверенности в том, что методика, процесс, процедура выполнены по заранее установленным критериям приемлемости;
2) действия, регистрирующие выполнение методики, процесса, работы с оборудованием, материалами, операциями или системами;
3) документально оформленные действия персонала, дающие высокую степень уверенности в том, что порученная им работа была выполнена надлежащим образом;
4) документально оформленные действия, дающие высокую степень уверенности в том, что методика, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование будет постоянно приводить к результатам, соответствующим заранее установленным критериям приемлемости.+
4. Внедрение системы управления качеством в аптечной организации должно начинаться
1) выбором методов для управления качеством процессов;
2) выбором методов достоверной оценки показателей качества выполнения процессов;
3) разработкой системы аттестации персонала в сфере управления качеством в аптечной организации;
4) специальным обучением персонала, ответственным за внедрение и эффективную работу системы управления качеством.+
5. Входит ли аудит поставщиков в полномочия Уполномоченного по качеству аптечной организации?
1) в соответствии с договором;
2) входит;+
3) не входит;
4) при разрешении поставщика.
6. Входит ли в задачи системы управления качеством в аптеке установление последовательности и взаимодействия процессов, необходимых для обеспечения системы качества, в зависимости от их влияния на безопасность, эффективность и рациональность применения лекарственных препаратов?
1) входит обязательно;+
2) входит только в случае доказанной последовательности и взаимодействия процессов, необходимых для обеспечения системы качества;
3) не входит, потому что аптека не рассматривается как система;
4) не входит, так как между процессами и качеством нет взаимосвязи.
7. Должен ли провизор осуществлять консультирование и информирование посетителя аптеки по правилам льготного отпуска лекарственных средств?
1) должен в полном объеме;+
2) должен, но только в том случае, если посетитель запросит данную информацию;
3) не должен, так как это функция лечащего врача;
4) не должен, так как это функция органов социальной защиты населения.
8. За качество реализуемых товаров аптечного ассортимента несет ответственность
1) аптечная организация;+
2) провизор, отпускающий товар покупателю;
3) производитель товаров;
4) транспортная компания.
9. Идеи и положения теории всеобщего менеджмента качества изложены в стандартах
1) ISO серии 6000;
2) ISO серии 7000;
3) ISO серии 8000;
4) ISO серии 9000.+
10. Имеет ли право Уполномоченный по качеству аптечной организации инициировать проверку надлежащей эксплуатации помещений, оборудования, ведения документации системы управления качеством в аптеке на соответствие с утвержденными нормам и правилам?
1) имеет;+
2) имеет, если есть предписание уполномоченной надзорной организации;
3) имеет, если персонал аптечной организации согласен на проверку;
4) не имеет.
11. К внешним субъектам управления качеством работы аптечной организации относятся
1) государственные контрольно-надзорные органы;+
2) законодательные органы;+
3) руководитель организации;
4) центры сертификации.+
12. К внутренним субъектам управления качеством работы аптечной организации относятся
1) Росздравнадзор;
2) руководитель организации;+
3) уполномоченный по качеству аптечной организации;+
4) центры сертификации.
13. К задачам самоинспекции в аптечной организации относятся
1) дисциплинарные воздействия в отношении персонала;
2) инспекция вопросов качества аптечной организации или его отдельного подразделения в части выполнения лицензионных требований; работы персонала; эксплуатации помещений, зданий и оборудования; процессов и стандартных операционных процедур; ведения документооборота и т.д. на соответствие установленным нормам;+
3) проведение корректирующих мероприятий по устранению выявленных отклонений от установленных норм;+
4) усовершенствование системы управления качеством работы предприятия на основании результатов проведенной самоинспекции.+
14. К международным стандартам надлежащих практик в области фармацевтической деятельности относятся
1) надлежащая аптечная практика (Good Pharmacy Practice);+
2) надлежащая дистрибьюторская практика (Good Distribution Practice);+
3) надлежащая лабораторная практика (Good Laboratory Practice);
4) надлежащая практика хранения фармацевтической продукции (Guide to good storage practices for pharmaceuticals).+
15. К объектам управления качеством относятся
1) персонал;+
2) помещения и здания;+
3) потребитель;
4) процессы.+
16. К принципам надлежащей аптечной практики относятся
1) обеспечение населения лекарственными средствами и другими товарами аптечного ассортимента;+
2) постановка диагноза;
3) регистрация нежелательных побочных явлений при применении лекарственных препаратов и информирование надзорных органов о зарегистрированных фактах (фармаконадзор);+
4) фармацевтическое консультирование и информирование пациентов и медицинских работников.+
17. К регистрирующим документам системы управления качества в аптеке относятся
1) журналы;+
2) инструкции выполнения стандартных операционных процедур;
3) распоряжения и приказы руководства;
4) стеллажные карты.+
18. Качеством труда работника является
1) выполнение работы в установленные сроки;
2) степень соответствия его выполнения нормативным требованиям, установленным для его проведения;
3) степень соответствия компетенциям, требованиям к выполнению трудовых функций, должностных инструкций и других норм, предусмотренных профессиональными стандартами и трудовым законодательством;+
4) степень соответствия оказания услуги нормативным или договорным требованиям, утвержденным для данной услуги.
19. Лицензионный контроль в сфере фармацевтической деятельности осуществляется на основании
1) Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»;
2) Федерального закона от 26 декабря 2008 года № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»;+
3) Федерального закона от 27.12.2002 № 184-ФЗ «О техническом регулировании»;
4) Федерального закона от 4 мая 2011 года № 99-ФЗ «О лицензировании отдельных видов деятельности».+
20. Лицом, ответственным за внедрение и обеспечение системы качества в аптечной организации, назначаемым администрацией является
1) провизор;
2) провизор-аналитик;
3) санитарка-мойщица;
4) уполномоченный по качеству.+
21. Могут ли условия хранения и транспортирования привести к отклонениям показателей качества лекарственных препаратов от установленных норм?
1) могут при несоблюдении требований к правилам, срокам и условий хранения и транспортирования;+
2) могут при несоблюдении требований к правилам, срокам и условий хранения, но транспортирование не оказывает влияние на качество лекарственных препаратов;
3) не могут при хранении, но могут при транспортировании;
4) не могут, так как все складские помещения проходят проверку при лицензировании.
22. Обязаны ли фармацевтические работники гарантировать квалифицированное обслуживание пациенту?
1) не обязаны;
2) обязаны;+
3) обязаны в случае заключения контракта с пациентом;
4) обязаны, только для пациентов, находящихся в стационарах.
23. Ответственным за качество работы аптечной организации является
1) исполнитель;
2) провизор-аналитик;
3) руководитель аптечной организации;+
4) уполномоченный по качеству, назначенный руководителем предприятия.
24. Относится ли фармацевтический работник, участвующий в изготовлении лекарственного препарата, к субъектам внутреннего контроля качества в аптечной организации?
1) не относится, так как его действия проверяет провизор-технолог;
2) не относится, так как контроль должен проводить провизор-аналитик;
3) относится, если проверяет работу другого сотрудника;
4) относится, так как обязан проводить самоконтроль выполняемой им процедуры.+
25. Под контролем качества работы предприятия подразумевают
1) комплекс мероприятий, направленных на предупреждение отклонений показателей качества от утвержденных норм;
2) обеспеченность предприятия ресурсами для качественного выполнения порученной работы;
3) проверку показателей качества на соответствие утвержденным нормам;+
4) разработку документации по управлению качеством.
26. Под обеспечением качества работы предприятия подразумевают
1) комплекс мероприятий, направленных на предупреждение отклонений показателей качества от утвержденных норм;+
2) обеспеченность предприятия ресурсами для качественного выполнения порученной работы;
3) проверку показателей качества на соответствие утвержденным нормам;
4) разработку документации по управлению качеством.
27. Политика и цели в области качества аптечной организации представляет собой
1) документ, отражающий общие намерения и направления деятельности аптечной организации, включая цели, необходимые для достижения и задачи, требующие решения;+
2) документ, подробно описывающий систему управления качеством предприятия и мероприятия, необходимые для решения поставленных задач и достижения целей политики качества;
3) документ, разработанный государственными уполномоченными органами или вышестоящей организацией, регламентирующие нормы, правила в области системы управления качеством;
4) документ, разработанный уполномоченными лицами аптечной организации, регламентирующий нормы, правила и порядок в области системы управления качеством на предприятии.
28. Предметом внутреннего контроля в аптечной организации могут быть
1) качество сырья, полупродуктов, лекарственных препаратов, изготовленных в аптеке;+
2) мотивация персонала;
3) надлежащее выполнение процессов и стандартных процедур норм;+
4) соблюдение персоналом установленных санитарно-гигиенических и квалификационных.+
29. Предполагают ли основные принципы международного стандарта надлежащей аптечной практики GPP максимально тесное взаимодействие врача и работника аптечного учреждения?
1) допустимо, но только с разрешения пациента;
2) не предполагают;
3) подобное взаимодействие не допустимо;
4) предполагают обязательное взаимодействие.+
30. Провизоры аптечной организации должны выполнять трудовые функции в соответствии со следующими профессиональными стандартами
1) профессиональный стандарт «Провизор-аналитик», утвержденный приказом Министерства труда и социальной защиты Российской Федерации от 22 мая 2017 г. № 427н;+
2) профессиональный стандарт «Провизор», утвержденный приказом Министерства труда и социальной защиты Российской Федерации от 9 марта 2016 г. № 91н;+
3) профессиональный стандарт «Специалист в области управления фармацевтической деятельностью», утвержденный приказом Министерства труда и социальной защиты Российской Федерации от 22 мая 2017 г. № 428н;+
4) профессиональный стандарт «Специалист по промышленной фармации в области производства лекарственных средств», утвержденный приказом Министерства труда и социальной защиты Российской Федерации от 22 мая 2017 г. № 430н.
31. Руководство по качеству аптечной организации представляет собой
1) документ, отражающий общие намерения и направления деятельности аптечной организации, включая цели, необходимые для достижения и задачи, требующие решения;
2) документ, подробно описывающий систему управления качеством предприятия и мероприятия, необходимые для решения поставленных задач и достижения целей политики качества;+
3) документ, разработанный государственными уполномоченными органами или вышестоящей организацией, регламентирующие нормы, правила в области системы управления качеством;
4) документ, разработанный уполномоченными лицами аптечной организации, регламентирующий нормы, правила и порядок в области системы управления качеством на предприятии.
32. Система внутреннего аудита и самоинспекции в аптечной организации является
1) задачей системы управления качеством;
2) механизмом обеспечения качества;+
3) результатом оценки системы управления качеством;
4) целью системы управления качеством.
33. Система обеспечения качества в аптечной организации охватывает
1) качество оказания услуг посетителям;+
2) качество оформления внешней регламентирующей документации;
3) качество реализуемых товаров аптечного ассортимента;+
4) качество условий хранения лекарственных препаратов и других товаров аптечного ассортимента.+
34. Система фармаконадзора предполагает
1) контроль за работой фармацевтических работников;
2) надзор уполномоченных органов за фармацевтической деятельность аптечной организации;
3) регистрацию нежелательных побочных явлений при применении лекарственных препаратов и информирование надзорных органов о зарегистрированных фактах;+
4) самоинспекцию в аптечной организации.
35. Составляющими системы управления качеством в аптечной организации являются
1) документооборот качества;
2) контроль качества;+
3) обеспечение качества;+
4) персонал.
36. Стандарт ISO «Системы менеджмента качества. Основные положения и словарь» представлен серией
1) ISO 9000:2000;+
2) ISO 9001:2000;
3) ISO 9004:2000;
4) ISO 9011:2000.
37. Уполномоченное лицо по качеству подчиняется
1) только Росздравнадзору;
2) только провизору-аналитику;
3) только провизору-технологу;
4) только руководителю организации.+
38. Федеральный государственный надзор в сфере обращения лекарственных средств в Российской Федерации осуществляется на основании
1) Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»;
2) Федерального закона от 4 мая 2011 года № 99-ФЗ «О лицензировании отдельных видов деятельности»;
3) постановления Правительства РФ от 15.10.2012 № 1043 «Об утверждении Положения о федеральном государственном надзоре в сфере обращения лекарственных средств»;+
4) приказа Минпромторга России от 14.06.2013 № 916 «Об утверждении Правил надлежащей производственной практики».
39. Целью деятельности организации международной организации по стандартизации International Organization for Standardization (ISO) является
1) введение общих требований к выполнению процессов при товарообмене;
2) исключение из экономического сообщества государств, не соблюдающих требования стандартов ISO;
3) разработка единых стандартов в области интеллектуальной, научной, технической и экономической деятельности;
4) содействие развитию стандартизации в мировом масштабе для облегчения международного товарообмена и взаимопомощи, а также для расширения сотрудничества в области интеллектуальной, научной, технической и экономической деятельности.+
40. Целью создания системы управления качеством является комплекс
1) дисциплинарных мер по отношению к персоналу;
2) жесткого контроля качества лекарственных средств, реализуемых в аптеке;
3) мероприятий обеспечения качества лекарственных средств, реализуемых в аптеке;
4) обеспечения и контроля качества, гарантирующий обеспечение населения качественными, эффективными и безопасными товарами аптечного ассортимента.+
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.