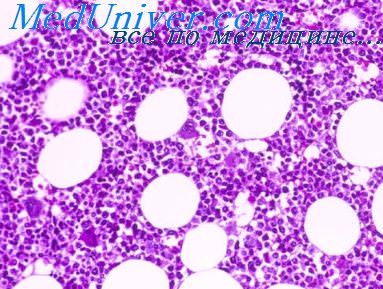
как омолодить костный мозг
Омолаживающий орган
Одно из главных устремлений медицины как науки – это сделать так, чтобы человек омолодился. Существует много различных теорий относительно того, как стать моложе, но к этому вопросу нужно подходить с научной точки зрения.
Чем старше человек становится, тем медленнее протекает процесс регенерации клеток в его организме. Этот процесс обновления осуществляется благодаря определённому органу. Можно ли в таком случае назвать этот орган «омолаживающим»? Давайте разберёмся.
Секрет омоложения
Сразу же приоткроем завесу тайны относительно этого «волшебного органа» – это костный мозг. Это тот орган, который буквально позволяет нам омолаживаться. Основная его функция – это регенерация клеток организма, а основная особенность, способствующая этому – наличие стволовых клеток. Костный мозг напрямую влияет на продолжительность жизни человека и его уязвимость к заболеваниям.
Все знают про этот орган, но не всем известны его безграничные возможности. И когда речь заходит об омоложении, мало кто обращает внимания на костный мозг в данном контексте.
Важно понимать, что все регенераторные способности нашего организма начинаются с костного мозга. Наш организм постоянно обновляет за счёт клеток, которые продуцируются костным мозгом, и именно о костном мозге мы должны заботиться, если хотим поддерживать свой организм в оптимальном состоянии и не болеть.
Стволовые клетки
Кровь человека состоит из эритроцитов, лейкоцитов и тромбоцитов. Они в свою очередь вырастают из родительских клеток, которые именуются стволовыми клетками. Они делятся на два вида:
Стволовая клетка способна генерировать около миллиона клеток-потомков. Когда кровяные клетки созревают в костном мозге, они становятся частью кровеносной системы. Кроме лимфоцитов – они после созревания становятся полностью рабочими клетками и уходят в лимфатическую систему (селезёнка, миндалины и т. д.).
Созревшие клетки крови имеют непродолжительный период жизни – около 8-12 дней. Исключение составляют лишь эритроциты, чей срок жизни достигает 4 месяцев. Из-за этого организм потребляет невероятно большое количество крови. В течение дня в человеческом организме погибает несколько миллиардов клеток.
Поэтому задача костного мозга в целом и стволовых клеток в частности – создавать новые клетки на смену погибшим, чтобы организм мог питаться ими и выполнять свои естественные функции.
Строение костного мозга
Костный мозг – это питательная губчатая ткань, которая располагается в полостях костей и составляет около 4.6% всей массы тела человека. Он состоит из двух частей:
Давайте рассмотрим детальнее каждую из этих составляющих.
Красный костный мозг
Красный (он же кроветворный) костный мозг – это та часть костного мозга, которая отвечает за то, чтобы в нашем теле постоянно образовывались новые клетки, вследствие чего внутренние органы будут обновляться. С течением возраста скорость этого обновления, и, соответственно, производства новых стволовых клеток, снижается. В итоге красный костный мозг уменьшается в объёме и его замещает жёлтый костный мозг.
Красный костный мозг расположен у человека внутри следующих костей:
Состоит он из двух тканей:
Красный костный мозг развивается на начальных периодах развития эмбриона, когда хрящевой скелет только начинает образовываться (происходит это примерно на седьмой неделе). В это время в его костях образуется полость, которую заполняет костный мозг. Он состоит из следующих частей:
Затем начинают появляться специальные гемопоэтические клетки и формироваться вокруг сосудов. Когда человек рождается, его костные полости заполнены красным костным мозгов (который с возрастом вытесняет жёлтый костный мозг).
Такое вытеснение не является вырождением костного мозга или какой-то аномалией – это естественный процесс, который протекает с возрастом. Однако это не значит, что данный процесс нельзя повернуть в обратную сторону и сделать так, чтобы жёлтый костный мозг постепенно заменялся красным.
Жёлтый костный мозг
Жёлтый (он же недеятельный) костный мозг – это скопление жировой ткани в костях человека, в состав которой входит множество адипоцитов (жировых клеток). Он выполняет следующие функции:
Субстанция, именуемая жёлтым костным мозгом, получила своё название благодаря жёлтому цвету, обеспеченному липохромами.
Чем моложе человек, тем больше баланс красного и жёлтого костного мозга у него склоняется к первому. У ребёнка до трёх лет жёлтого костного мозга почти нет, у человека к 25-ти годам этот баланс составляет примерно 50/50, а далее, с течением возраста, жёлтый костный мозг начинает постепенно вытеснять красный.
Травматизация
Интересной особенностью организма является то, что когда он получает травмы, в процессе которых происходит потеря крови, жёлтый костный мозг даёт возможность красному костному мозгу увеличить свою продуктивность (то есть увеличиться в объёме). Поэтому постоянная микротравматизация способствует тому, что наш красный костный мозг поддерживается за счёт ресурсов, которые производит жёлтый костный мозг, причём поддерживается в хорошем функциональном состоянии.
Но вы вряд ли захотите периодически пускать кровь и подвергать себя травмам, чтобы обеспечить более продуктивную работу красного костного мозга за счёт жёлтого. Делать это не обязательно, ведь существует множество других методов стимуляции нужного участка костного мозга.
Смотрите в видео совет от доктора Шишонина:
Подписывайтесь на доктора Шишонина в инстаграм и получайте больше полезных советов по здоровью:
Как омолодить костный мозг
После максимального опустошения костного мозга, когда фактически остаются одни ретикулярные клетки, наступает постепенное заполнение его новообразованными клетками крови. Последние вначале располагаются в виде очагов, степень выраженности которых широко варьирует [Краевский Н. А., 1957; Новикова М. И., 1975]. Чем позже после облучения производится микроскопическое исследование, тем больше бывает выражено заполнение ретикулярной стромы новообразованными клетками и больше среди них выявляются дифференцированные формы белой и красной крови.
Существенно, что активации миелопоэза всегда предшествует увеличение количества лимфоидных клеток [Щербова Е. Н., Груздев Г. П., Белоусова О. И., 1968]. Возможно, что лимфоидные клетки способствуют пролиферации и дифференцировке заселившихся в опустошенный костный мозг стволовых клеток или сами подвергаются трансформации и дифференцировке [Горизонтов П. Д., 1973]. Вместе с тем наблюдения показывают, что у животных, перенесших острую форму лучевой болезни, в течение долгого времени отмечается повышенное разрастание ретикулярных клеток, особенно по ходу костных балок [Шмелева Н. И., 1972]. По мнению авторов более поздних работ, лимфоциты не играют существенной роли в восстановлении грануло- и эритропоэза [Чертков К. С, 1972; Варакина Н. Ф., 1975].
У облученных крыс, например, первым восстанавливается эритроидный росток костного мозга, затем число лимфоцитов и потом уже содержание незрелых форм гранулоцитарного ростка [Гольдберг Е. Д., Карпова Г. В., 1979].
Гистологическая картина костного мозга у людей, перенесших острую лучевую болезнь 6—16 лет назад, свидетельствует о неполной регенерации кроветворной ткани. Она отличается высоким содержанием ретикулярных клеток, плазмоцитов и эозинофилов, меньшим числом мегакариоцитов, признаками прогрессирующего склероза ретикулярной стромы и кровеносных сосудов [Суворова Л. А., 1970; Вялова Н. А. и др., 1970; Грибова И. А., Солдатова В. П„ 1975]. Однако при поражении разными видами излучений наблюдаются некоторые отклонения.
При поражении быстрыми нейтронами, например, больше нарушается регенерация красной крови [Соколов В. В., 1957]. Вместе с тем последние электронно-микроскопические исследования показывают, что у крыс при острой лучевой болезни, вызванной облучением рентгеновскими лучами в дозе 750 Р, максимальные нарушения в клетках красной крови наблюдаются в период наиболее выраженного восстановления миелоидного ростка [Марков В. И., Пискарев Е. В. и др., 1978].
У людей, погибших через 3—6 нед после облучения в результате взрыва атомной бомбы, было выделено несколько типов регенерации костного мозга. В 1-й группе пострадавших костный мозг оставался апластичным. Пролиферация ретикулярных клеток, образование плазматических и так называемых лимфоидных клеток почти не наблюдались. Только в некоторых случаях обнаруживали деление ретикулярных клеток и переход их в плазматические формы. Дифференцировка миелоидных элементов почти отсутствовала. В единичных наблюдениях отмечалось сохранение островков эритропоэза. Во 2-й группе пострадавших очаговая гиперплазия была более выраженной.
В клеточных популяциях, помимо плазматических клеток, можно было видеть лимфоидные и миелоидные клетки. Пролиферация ретикулярных клеток наблюдалась вдоль трабекул кости. В отдельных участках костного мозга встречались лаброциты, островки эритропоэтической ткани, большие и малые клетки, напоминающие мегакарноциты. В 3-й группе пострадавших ииелась очаговая регенерация миелоидной ткани. Кроме того, отмечалась пролиферация ретикулярных клеток и появление большого количества плазматических клеток, лимфоцитов и мегакариоцитов. Наконец, в 4-й группе у всех пострадавших отмечалось разрастание миелоидного костного мозга; среди клеток последнего преобладали миелоциты и в некоторых случаях метамиелоциты.
Как омолодить костный мозг
Регенерация костной ткани за короткое время претерпела значительные изменения.
Она представляет область интереса для многих хирургических специальностей, включая челюстно-лицевую хирургию, пластическую хирургию, отоларингологию, нейрохирургию, общую хирургию и онкологию.
Костнозамещающие материалы для восстановления утраченной кости часто применяют в пародонтологии, ортодонтии, эндодонтии и общей стоматологической практике. Некоторые новинки оказались полезными, другие вызывают большое разочарование.
Значительная роль в последнее время принадлежит особой группе биологических веществ — стимуляторов регенерации костной ткани, которые вводят в состав новых материалов. Также внедряются физические методы стимуляции репаративных процессов, основанные на ультразвуковом или электромагнитном воздействии.
Дентоальвеолярные костные дефекты широко распространены, и представляют актуальную проблему в стоматологическом лечении и реабилитации.
Реконструкция костных дентоальвеолярных дефектов с использованием минимально инвазиных методов и стимуляторов регенерации может значительно улучшить успехи реконструктивной хирургии полости рта и челюстно-лицевой системы.
Многие пациенты только сейчас узнают, что жевательную функцию возможно полностью восстановить с помощью дентальных имплантатов. Большинство пациентов нуждаются в регенерации костной ткани, создавая спрос на дентоальвеолярную реконструкцию.
По данной причине в относительно небольшой анатомической области предпринято так много усилий по усовершенствованию методов реконструкции.
Однако пациенты, в лучшем случае, восприняли такие восстановительные процедуры с осторожностью. Во многом это связано тем, что и практикующие врачи, и сами больные воспринимают нынешние опции как болезненные и инвазивные.
Уменьшение болезненности и травматичности лечения может быть достигнуто за счет двух подходов: либо разработки менее инвазивных методов забора костных трансплантатов, либо отказа от забота аутокости с использованием костнозамещающих материалов или инновационных стимуляторов репаративных процессов.
Чрезвычайно привлекательным направлением являются гибридные материалы, которые базируются на использовании принципов и методов тканевой инженерии. Они достойны занять свое законное место в арсенале современного врача.
Структура, функции и физиология костной ткани
Кость представляет собой специализированную соединительную ткань с минерализованным внеклеточным матриксом, который необходим для формирования и поддержания прочности человеческого скелета, а также обеспечивает запас кальция для гомеостаза.
С эмбриологической точки зрения, кость формируется в ходе двух отдельных процессов развития, известных как внутримембранная и эндохондральная оссификация.
Если оссификация протекает напрямую, она описывается как внутримембранная. Эмбриональные мезенхимальные клетки с обильным кровоснабжением образуют локусы внутриклеточного осаждения коллагена. Остеобласты начинают формировать остеоид, который усиливается оседающими солями кальция.
Такое «прямое» формирование костной ткани отвечает за генезис черепного свода, лицевого скелета и части нижней челюсти, лопатки и ключицы.
Формирование эндохондральной кости проходит через хрящевую фазу, когда эмбриональные мезенхимальные стволовые клетки дифференцируются в примитивный гиалиновый хрящ. Кровеносные сосуды и остеогенные элементы резорбируют хрящ и заменяют его остеоидом при проникновении в матрикс.
Таким путем формируются нагруженные кости скелета, оканчивающиеся суставами. Считается, что большая часть основания черепа, а также часть нижней челюсти имеют эндохондральное происхождение.
Почему это важно? Эмбриологическую «историю» кости следует учитывать в контексте регенерации костной ткани и будущих попыток тканевой инженерии.
Костная ткань преимущественно состоит остеобластов, остеоцитов и остеокластов.
Остеобласты представляют собой кубоидные клетки, обладающие выдающимся аппаратом Гольджи и хорошо развитым эндоплазматическим ретикулумом, гистологическим признаком активного синтеза белка. Эти хорошо дифференцированные клетки синтезируют как коллаген I типа, так и неколлагеновые белки органического матрикса кости.
Остеобласты также способны регулировать минерализацию костного матрикса.
Считается, что остеоцит — это зрелый остеобласт, который попадает в костный матрикс. Хотя их основной функцией является структурная поддержка, они продемонстрировали способность как синтезировать, так и резорбировать кость.
Клетки костной выстилки — это плоские фузиформные клетки, покрывающие неактивные костные поверхности. Сегодня мало что известно о функционировании этих клеток, однако они могут быть предшественниками остеобластов.
Предполагается, что так называемые остеопрогениторные клетки запрограммированы на превращение в костные клетки, и их происхождение лежит в основе примитивных мезенхимальных стволовых клеток.
Остеокласты, в отличие от остальных клеток местного происхождения, возникают в результате слияния моноядерных предшественников, происходящих из кроветворных тканей. Они участвуют в резорбции костной ткани. Гистологически они характеризуются складчатой мембраной, где происходит резорбция костей.
Все вышеперечисленные элементы обеспечивают образование и резорбцию кости, поддерживаемую в тонком физиологическом равновесии.
Как только баланс нарушен, чрезмерная активность остеокластов может привести к таким проблемам, как остеопороз, в то время как повышенная активность остеобластов отражает рост костей, заживление или патологические реакции.
Архитектура кости такова, что внешняя оболочка, называемая кортикальной или же компактной костью, обеспечивает механическую поддержку. Метаболические функции кости контролируются расположенной в центре кортикальной и трабекулярной (губчатой) костью.
В отличие от плотно упакованных фибрилл кортикальной кости, матрикс губчатой кости организована слабо. С макроскопической точки зрения, она представляет собой ячеистую решетку, в которой расположены кроветворные элементы.
Кость по весу состоит из 65-70% кристаллических солей, преимущественно в виде гидроксиапатита, а остальные 30-35% состоят из органического матрикса.
Органический матрикс состоит из коллагена I типа (90-95%) с неколлагеновыми белками, такими как остеопонтин, костный сиалопротеин, остеокальцин, остеонектин и различные факторы роста — стимуляторы регенерации кости.
Физическая стимуляция регенерации костной ткани
Существует большое количество устройств, которые продаются под категорией «стимуляторы роста костей». Эти устройства привлекательны, поскольку что они менее инвазивные, а осложнения, связанные с забором костного трансплантата, отсутствуют.
В западной медицине основные категории методов физической стимуляции, используемые для лечения переломов, включают электромагнитные поля, низкоинтенсивный импульсный ультразвук и экстракорпоральную ударно-волновую терапию.
Электростимуляция костной ткани
Электростимуляция основана на теории, согласно которой механическое напряжение, приложенное к кости, ведет к генерации электрических потенциалов.
Сжатие приводит к возникновению электроотрицательных потенциалов, которые ведут к образованию кости. Растяжение, наоборот, ведет возникновению к электроположительных потенциалов, которые активируют процесс резорбции кости.
Теоретически, генерация электрического поля в участке повреждения должна усиливать образование костной ткани. В то время как ряд фундаментальных научных исследований продемонстрировали эффективность электростимуляции, дальнейшие клинические исследования дали противоречивые результаты.
В мета-анализе 11 рандомизированных контролируемых исследований (2008) авторы обнаружили, что из 4 испытаний, включающих 106 несрастающихся переломов, метод электромагнитной стимуляции ускоряет регенерацию в среднем на 76%.
Однако неоднородность полученных данных не позволяет утверждать, что методика действительно эффективна, и может применяться в клинической практике. Для этого необходимо провести более качественные клинические испытания.
Импульсный ультразвук низкой интенсивности
Второй категорией физической стимуляции служит импульсный ультразвук низкой интенсивности (LIPUS). Метод работает путем образования звуковых волн, которые генерируют микромеханическое напряжение в месте перелома.
Эти микромеханические стрессы стимулируют различные клеточные и молекулярные изменения, способствующие заживлению. LIPUS был в основном изучен у пациентов с переломами длинных костей, остеотомией и у курильщиков с переломами.
В недавнем крупном исследовании было продемонстрировано, что LIPUS является безопасным методом лечения свежих переломов длинных костей или несращений. Авторы отметили, что лечение занимает очень много времени: средняя продолжительность воздействия составляет по 20 минут в день в течение 5 месяцев.
Недавний метаанализ 13 рандомизированных контролируемых исследований указывает на противоречивость и ограниченность сведений об эффективности импульсного ультразвука низкой интенсивности при стимуляции регенерации костной ткани.
Интересен метаанализ 2014 года, который был проведен для косвенного сравнения электростимуляции с LIPUS в контексте заживления переломов.
У пациентов со свежим переломом исследование продемонстрировало предполагаемое, но незначительное преимущество LIPUS через 6 месяцев (ОР 1,17, 95% ДИ 0,97–1,41).
У пациентов с несращенным или застарелым переломом электрическая стимуляция также имела незначительный, но предполагаемый эффект через 3 месяца (ОР 2,05, 95% ДИ 0,99–4,24) по сравнению со стандартным лечением.
Имеются также низкокачественные данные, свидетельствующие о потенциальной пользе применения LIPUS по сравнению с электростимуляцией в повышении частоты заживления переломов через 6 месяцев при свежих переломах (ОР 0,76, 95% ДИ 0,58–1,01).
Экстракорпоральная ударно-волновая терапия
Экстракорпоральная ударно-волновая терапия использовалась для лечения застарелых и несращенных переломов, в том числе в челюстно-лицевой хирургии.
В процессе лечения аппликатор формирует ударные волны, которые представляют собой одиночные звуковые волны высокой амплитуды, генерируемые электрогидравлическими, электромагнитными или пьезоэлектрическими методами.
В экспериментах на животных эти ударные волны оказывают биологическое воздействие, образуя свободные радикалы и кислородные радикалы, что приводит к образованию ряда биологических факторов роста и ускорению репаративных процессов.
Zelle и соавт. провел систематический обзор влияния экстракорпоральной ударно-волновой терапии на лечение застарелых переломов и несращений. В 10 исследованиях, включающих 924 пациента, показатель эффективности составил 76% (ДИ 73–79%).
Авторы пришли к выводу, что экстракорпоральная ударно-волновая терапия может стимулировать процесс заживления при застарелых переломах костей и несращениях.
Поскольку исследования, включенные в анализ, предоставили только доказательства 4 уровня, для подтверждения эффективности метода нужны дополнительные данные.
Биологическая стимуляция регенерации костной ткани
Для реконструкции черепно-челюстно-лицевого скелета используют аутогенные костные трансплантаты, собираемые из локальных или отдаленных источников. В последнее время большую популярность приобрела аллогенная кость от другого человека, а также ксеногенные костные материалы от другого вида.
Поскольку при использовании аллогенных и ксеногенных материалов существует риск иммуногенных проблем, такие трансплантаты сначала подвергали замораживанию. Позднее были разработаны другие методы решения проблемы иммуногенности. Кроме того, появились синтетические костные материалы для стоматологии.
Для повышения эффективности лечения активно применяются стимуляторы регенерации костной ткани природного или синтетического происхождения. Многие из них фактически скопированы из живой природы — костные морфогенетические белки (ВМР).
Различные факторы роста широко используются для лечения костных дефектов и остеоиндукции. Некоторые, в том числе фактор роста эндотелия сосудов (VEGF), TGF-β, PDGF и BMP, такие как BMP-2, BMP-7 и IGF, присутствуют в матриксе здоровой кости и экспрессируются во время регенерации костной ткани.
Эти факторы регулируют васкуляризацию, вызывают пролиферацию и дифференцировку остеобластов и их предшественников, благодаря чему находят клиническое применение.
Локальные факторы регенерации костной ткани
Существуют локальные факторы, которые можно использовать для восстановления и регенерации кости. Они классифицируются по механизму биологического действия на остеогенные, остеокондуктивные, остеоиндуктивные факторы
Остеогенными факторами считают те, которые содержат жизнеспособные клетки (остеогенный предшественник) и способны к образованию кости. Это может быть аутологичный костный мозг либо аутологичная костная ткань.
Остеокондуктивные материалы выполняют функцию структурной основы для формирования новой кости. Среди них такие материалы, как сульфат кальция, фосфат кальция, аллотрансплантат, ксеногенные костные материалы и керамика.
Остеоиндуктивные материалы — это материалы, которые могут вызывать дифференцировку в костные клетки. Группа включается костные морфогенетические белки (BMP) и белки Wnt.
Факторы восстановления тканей играют важную роль в регенерации и заживлении ран в различных тканях и не являются специфичными для заживления или перелома костей.
Двумя наиболее важными факторами восстановления тканей, которые изучали в контексте заживления переломов, являются фактор роста фибробластов и фактор роста тромбоцитов.
Аутологичный костный мозг
Костный мозг из гребня подвздошной кости содержит клетки-предшественники, которые обладают как остеогенными, так и ангиогенными свойствами. Эти клетки являются самовосстанавливающимися и способны продуцировать такие факторы, как BMP и сосудистый эндотелиальный фактор роста (VEGF).
Эффект аспирата костного мозга может быть усилен путем центрифугирования для дальнейшего концентрирования числа клеток и путем объединения костного мозга с трансплантатами для обеспечения структурной поддержки.
Hernigou и соавт. использовали аутологичный костный мозг для лечения 60 пациентов с несращением переломов и достигли срастания костей у 53 из 60 участников исследования.
Авторы продемонстрировали корреляцию между количеством клеток-предшественников и скоростью заживления, определяемой объемом минерализованного каллуса через 4 месяца.
В то время как использование клеток костного мозга для заживления переломов является клинически эффективным и относительно дешевым, для совершенствования этого метода требуются дальнейшие работы как по забору, так и по подготовке клеток.
Аутологичная костная ткань
Для крупных дефектов многие хирурги предпочитают использовать аутологичный костный трансплантат, извлеченный из подвздошного гребня, вместо аутологичного костного мозга.
Исторически этот метод был связан с болью и различными осложнениями со стороны донорских участков (например, кровотечением и инфицированием раны).
Недавние отчеты показывают, что фактическая частота постоянных болей в месте забора костной ткани через 1 год после операции составляет Оцените статью