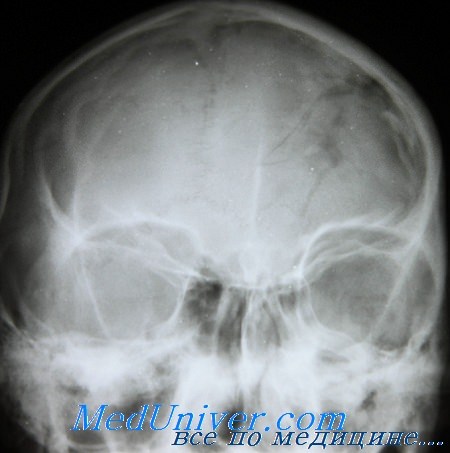
кальцинат серпа большого мозга
Кальцинат серпа большого мозга
Физиологические внутричерепные кальцификаты на снимках в переднезадней и боковой проекциях:
Эпифиз
Кальцифицированный эпифиз обнаруживают у 5% детей в возрасте младше 10 лет и почти у двух третей взрослых. Они имеют аморфный или кольцевидный вид и существенно варьируют по размеру, но обычно меньше 1 см. Кальцификат эпифиза, превышающий I см в диаметре, указывает на новообразование либо пинеалому или даже чаще на тератому.
Уздечка эпифиза
расположена на несколько миллиметров кпереди эпифиза и почти у трети пациентов кальцифицирована. Кальцифицированная уздечка принимает характерную форму буквы «С», открытой кпереди. Смещение уздечки внутричерепными объемными образованиями происходит тем же путем, что и смещение эпифиза.
Кальцификаты каменисто-клиновидной и межклиновидной связок
Кальцификаты каменисто-клиновидной и межклиновидной (диафрагма седла) связок часто возникают у пожилых. Первая лежит между кончиком спинки седла и вершиной каменистой части височной кости, тогда как последняя может формировать межклиновидный (седла) мостик.
Хориоидные сплетения
Хориоидные сплетения могут кальцифицироваться во всех желудочках, чаще всего это происходит в преддверной части боковых желудочков (соединение тела бокового желудочка с задним и височным рогами), проецирующейся в боковой проекции приблизительно на 2-3 см позади и немного ниже эпифиза. В переднезадней проекции кальцификаты сплетения проецируются приблизительно на 3 см от средней линии и обычно симметрично, хотя некоторое неравенство в размерах между разными сторонами иногда присутствует. Величина кальцификации может значительно варьировать и не имеет клинического значения. Распространенные кальцификаты сплетений могут обнаруживаться при нейрофиброматозе.
Кальцификация твердой мозговой оболочки
Кальцификация твердой мозговой оболочки, черепа и/или намета возникает приблизительно в 10% случаев, и каждый вариант имеет свои характерные признаки. Кальцификация твердой мозговой оболочки вокруг сагиттального синуса имеет V-образную форму у вершины на снимке в переднезадней проекции. Кальцификаты в этой области иногда могут быть вызваны кальцифицированными пахионовыми (паутинными) грануляциями (дивертикулоподобными выпячиваниями паутинного пространства, прободающими твердую мозговую оболочку и проецирующимися на просвет основных синусов и прилежащих венозных озер).
Кальцификаты серпа
В норме располагаются кпереди и четко видны как линейные полосы или пластинки на одном или обоих листках серпа. На снимках в переднезадней проекции кальцификаты по свободному краю намета имеют форму перевернутой буквы «V». Величина кальцификации твердой мозговой оболочки, серпа и намета обычно не имеет клинического значения, особенно когда кальцификация более или менее диффузная.
Кальцификаты серпа и твердой мозговой оболочки обнаруживают у двух третей пациентов с синдромом базально-клеточного невуса (Горлина—Гольтца), а распространенные кальцификаты твердой мозговой оболочки упоминают при эластической псевдоксантоме.
Из книги «Опухоли мозга. КТ- и МРТ-диагностика». Посмотреть/заказать
Обызвествление серпа мозга может приводить к формированию локальных крупных кальцинатов, костной плотности, которые со временем могут приобретать структуру губчатой кости (головка стрелки на рис.1041,1042). Обызвествление так же может быть вытянутой стелящейся вдоль ТМО формы (стрелки на рис.1044) с характеристиками МР-сигнала подобными диплоическому веществу (рис.1044-1045). Кроме того, может встречаться дисэмбриогенетический жир вдоль серпа мозга (стрелки на рис.1043), о чём свидетельствуют отрицательная плотность на КТ. Петрификация ТМО появляться с возрастом и может возникать спустя годы после операции (рис.1046), отражая кровяное пропитывание и инкрустацию дуры.
Кальцификаты гипофиза
Кальцификаты гипофиза редко распознают на снимках черепа в отличие от гистологического исследования. На снимках черепа они могут иметь вид камней.
Артериосклеротические кальцификаты
Артериосклеротические кальцификаты внутренней сонной артерии часто видны в месте ее прохождения через пещеристые синусы. Такие кальцификаты могут варьировать по размеру от мелких хлопьев, достигая полной визуализации каротидного сифона. На снимках в боковой проекции такие кальцификаты накладываются на изображение турецкого седла, тогда как кольцевидные кальцификаты могут быть видны на одной из сторон седла на снимках в переднезадней проекции.
Кальцификаты базальных ганглиев
Кальцификаты базальных ганглиев обнаружива ют при многих заболеваниях, но чаще всего их обнаруживают случайно у здоровых взрослых людей. Они не имеют клинического значения. Кальцификаты различают по размеру от точечных до слившихся затемнений с характерным расположением: на снимках в переднезадней проекции кальцификаты располагаются симметрично парасагиттально, тогда как на снимках в боковой проекции они могут принимать незначительно изогнутую форму и примерно располагаться параллельно чешуйчатому шву. Склероз по ходу чешуйчатого шва на снимках в боковой проекции иногда имеет вид полосовидного затемнения не следует путать с кальцификатами базальных ганглиев.
Кальцификаты в зубчатых ядрах мозжечка встречаются реже, чем в базальных ганглиях, но обнаруживаются при тех же состояниях. На боковом снимке черепа такие кальцификаты часто маскируются воздушными ячейками сосцевидного отростка, но лучше всего они видны в окципитальной (Тауне) проекции в виде симметричных полулунных затемнений.
Кальцинат серпа большого мозга
Местные симптомы в свою очередь могут быть разделены на косвенные и прямые. Из косвенных признаков известное значение имеют обызвествления различных образований мозга, как, например, шишковидной железы, сосудистых сплетений боковых желудочков, твердой мозговой оболочки и сосудов мозга.
Большинство авторов считает эти обызвествления физиологическими, так как они встречаются весьма часто и при отсутствии каких-либо патологических явлений. Отложения же извести в опухолях, гематомах, в воспалительных очагах, туберкулах и в паразитах после их гибели относят к патологическим обызвествлениям.
Н. Н. Альтгаузен считает неправильным название «физиологические» обызвествления, так как они также, по его мнению, обусловлены патологическим процессом. Он полагает, что эти обызвествления, связанные с процессом старения, нарушения обмена и развития соединительной ткани, являются атрофическими, а остальные патологическими.
На технически хорошо выполненной рентгенограмме часто можно обнаружить обызвествленную шишковидную железу. На боковом снимке она проицируется на 4—5 см кзади и кверху от турецкого седла, а на сагиттальном — по средней линии. Большое диагностическое значение приобретает обнаруживаемое на рентгенограммах смещение шишковидной железы внутричерепной опухолью. В зависимости от смещения железы в ту или другую сторону можно сделать вывод о местоположении опухоли.
Сагиттальные снимки в этом отношении имеют большее значение, чем боковые, так как на них довольно легко обнаружить смещение железы от средней линии. На боковых снимках оно может быть установлено только при значительном смещении железы.
Значительно реже наблюдается отложение извести в сосудистых сплетениях боковых желудочков. На боковом снимке они проицируются несколько кзади от шишковидной железы. Редко наблюдаемое одностороннее обызвествление сосудистого сплетения может быть принято за смещенную шишковидную железу. Последняя дает все же более густую тень. На сагиттальных снимках обызвествленные сосудистые сплетения проицируются на одинаковом расстоянии от средней линии. Эти обызвествления также приобретают значение только в тех случаях, когда определяется их смещение внутричерепной опухолью.
Из обызвествленных сосудов головного мозга нас в первую очередь интересует внутренняя сонная артерия. Некоторые авторы придают такому обызвествлению определенное патологическое значение, считая, что оно может быть причиной образования экскавации соска зрительного нерва без повышения внутриглазного давления (псевдоглаукома). Однако подобного рода обызвествления часто обнаруживаются у старых людей и при отсутствии каких-либо патологических изменений на дне глаза, а также при воспалительной глаукоме.
Тень обызвествленной сонной артерии проицируется на боковом снимке в просвете турецкого седла в виде изогнутой трубки. Нередко наблюдается обызвествление обеих сонных артерий. Иногда обызвествленные артерии хорошо выделяются на сагиттальных снимках глазниц, где они имеют вид кружочков, расположенных у верхне-внутрен-ней стенки глазницы или в области верхней глазничной щели.
Кроме описанных выше так называемых физиологических обызвествлений, которые в соответствующих случаях могут быть использованы в качестве косвенных признаков внутричерепных опухолей, отложения извести могут происходить и в патологических образованиях мозга. Эти изменения приобретают особое значение для определения локализации опухоли или другого патологического процесса. Следует, однако, иметь в виду, что но одной величине очага обызвествления нельзя еще делать вывода о размерах опухоли.
Обызвествления могут наблюдаться как в опухолях (менингиомы, глиомы, краниофарингиомы и т. д.), так и в неопухолевых образованиях, в туберкулах, гуммах, гематомах и т. д. По мнению ряда авторов (Копылов, Альтгаузен, Шварц), в некоторых случаях по характеру и форме обызвествления можно делать вывод и о гистологической структуре обызвествленных опухолей.
К прямым признакам внутричерепных опухолей относятся также изменения в костях черепа, которые обусловлены прямым воздействием близлежащей опухоли. Эти изменения могут проявляться в виде истончения, узур, разрушения или гиперостоза кости. При наличии таких изменений можно с большой вероятностью установить местоположение, а в ряде случаев и характер опухоли, особенно, когда имеется гиперостоз кости.
Кальцинат серпа большого мозга
Иногда на рентгенограммах можно обнаружить обызвествления и инородные тела. Обызвествления в черепе детей могут быть физиологическими и патологическими. Физиологические располагаются на уровне сосудистых сплетений боковых желудочков, в шишковидной железе, серповидном отростке. У детей раннего возраста они встречаются редко и появляются постепенно с возрастом.
К патологическим обызвествлениям относятся опухолевые и неопухолевые. Из опухолей часто обызвествляются краниофарингиомы (70—85%), тератомы, хордомы, дермоиды; из глиальных опухолей — олигодендроглиомы, пинеаломы. При краниофарингиомах известковые массы находятся выше турецкого седла и несколько кзади. Локализация очень типична и не вызывает диагностических затруднений.
К неопухолевым относятся посттравматические, постинфекционные, паразитарные и дизонтогенетические обызвествления.
Дизонтогенетические обызвествления наблюдаются при внутричерепных ангиомах, энцефалотригеминальном ангиоматозе, туберозном склерозе. Ангиоматозные сосуды выглядят как нежные червеобразные обызвествления. При энцефалотригеминальном ангиоматозе обнаруживаются двуконтурные линейные тени обызвествлений, располагающиеся по ходу мозговых извилин, преимущественно в заднетеменных и затылочных областях мозга. Множественные, округлые и тяжистые обызвествления в поверхностных отделах мозга наблюдаются при туберозном склерозе.
К посттравматическим обызвествлениям у новорожденных и грудных детей относятся кефалогематомы. По верхнему контуру кефалогематомы обызвествляется твердая мозговая оболочка в виде тонкой полоски-скорлупы, позже известь можно найти и в толще бывшей гематомы. Иногда кефалогематома оссифицируется и имеет вид костной опухоли.
При эпидуральных гематомах наряду с участками обызвествления наблюдаются истончения внутренней костной пластинки, а иногда — образование участков рассасывания кости. Если ребенок перенес тяжелую черепно-мозговую травму, протекавшую с субдуральным или внутримозговым кровоизлиянием, то при возникновении гематом могут образоваться обширные обызвествления, плоские в виде серпа или полулуния. Субдуральная гематома представляет собой инкапсулированное скопление крови в субдуральном пространстве. Гематома плоская и чаще всего односторонняя. При внутримозговых гематомах наблюдаются единичные множественные «коралловые» петрификаты.
Черепно-мозговая травма, перенесенная в раннем детском возрасте, при которой были отмечены переломы костей и подоболочечные гематомы, может привести к образованию участков рассасывания кости.
Подобные изменения можно наблюдать уже через 3—4 нед после травмы. Костные дефекты в результате рассасывания костей образуются, если травма произошла в возрасте до 3 лет. Это объясняется особенностями кровоснабжения костей черепа в этом возрасте.
К постинфекционным относятся обызвествления у детей раннего возраста после менингоэнцефалита, туберкулезного менингита, абсцесса мозга. Они могут быть единичные и групповые, крапчатого пли кораллового строения.
Паразитарные обызвествления у детей раннего возраста встречаются при токсоплазмозе и цитомегалии. Известковые включения в черепе при токсоплазмозе обнаруживаются у 40—50% больных, а при микроскопическом исследовании — у 85%. Петрификаты бывают множественные, полиморфные и располагаются в разных отделах мозга: теменно-затылочной, височно-лобной, мозжечке, сосудистых сплетениях. Размеры их колеблются от 2 до 10 мм в диаметре, форма — в виде узелков, палочек, черточек, гроздей. В связи с тем что при токсоплазмозе часто поражается орган зрения, кальцификаты можно обнаружить и в пораженном глазу. При цитомегалии обызвествления такие же, как при токсоплазмозе.
У новорожденных иногда можно обнаружить так называемый лакунарный череп. На краниограммах в области костей свода видны крупные овальные истончения, разделенные костными перегородками, напоминающие лакуны.
Лакунарный череп возникает в результате повышения внутричерепного давления или глубоких расстройств костеобразования во внутриутробный период. После рождения процесс не прогрессирует.
Лакунарный череп следует отличать от лакунарного остеопороза. Последний встречается у здоровых новорожденных и в клинике известен как «мягкий череп». Кости свода черепа при пальпации податливы, голова не увеличена в размерах. На краниограммах выражены ячеистые просветления на фоне нормальной картины свода черепа, рисунок костных перегородок между лакунами отсутствует. В возрасте 2—3 мес очаги лакунарного остеопороза исчезают.
Кальцинат серпа большого мозга
Процессы, протекающие в головном мозге, вероятно, относятся к самым сложным для изучения. Патологические изменения, происходящие в его структурах, являются наиболее труднодиагностируемыми, несмотря на наличие современного оборудования и обширных познаний врачей в данной области. Болезнь Фара относится к редким и малоизученным заболеваниям, которые затрагивают преимущественно базальные ганглии, мозжечок и полушария головного мозга.
Болезнь Фара – идиопатическая неатеросклеротическая симметричная интрацеребральная кальцификация коры полушарий, базальных ганглиев и зубчатых ядер мозжечка, связанная с отложением солей кальция и железа в стенках мелких артерий и артериол, а также в вещество головного мозга. Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен [1].
Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140–400 мкм [2].
Впервые синдром (или болезнь) Фара был диагностирован в конце 1930 г. немецким врачом-неврологом Карлом Теодором Фаром. Это редкое дегенеративное заболевание, его распространенность составляет, как было сказано ранее, порядка 1 случая на 1 млн населения. При этом мужчины болеют приблизительно в 2 раза чаще.
Разнообразие симптоматики данного заболевания объясняет сложность постановки диагноза. Клинически болезнь может протекать как совершенно бессимптомно, так и с яркими экстрапирамидными нарушениями в виде мышечной ригидности, тремора, судорог, схожими с таковыми при болезни Паркинсона [3, 4]. Для больных характерны гиперкинезы, головокружения, шаркающая походка. Именно схожесть с другими распространенными заболеваниями затрудняет своевременное выявление данной патологии [5, 6].
На современном этапе развития системы здравоохранения с увеличением доступности компьютерной томографии в рутинной неврологической практике диагностика феррокальциноза постепенно увеличивается, однако, по литературным данным, в большинстве случаев обнаружение кальцинатов является находкой, а не диагностической необходимостью.
Этиология болезни Фара установлена не до конца. Возможными причинами считают гормональные нарушения при патологии щитовидной и паращитовидной желез, что ведет к дисбалансу ионов кальция и фосфора: чаще всего – первичный или вторичный гиперпаратиреоз, реже – псевдогиперпаратиреоз при продукции паратгормона опухолевой тканью (при бронхогенном раке, раке молочной железы); при локализации опухоли в костной ткани (множественная миелома, метастазы в кости). Еще одним из механизмов возникновения предполагают дыхательный алкалоз, компенсируемый фосфатной буферной системой: внутриклеточная концентрация фосфатов увеличивается, в то время как в плазме крови возникают относительная гиперкальциемия и абсолютная гипофосфатемия [7, 8].
Указывается, что гипоксия мозга при гипертонической болезни и атеросклерозе церебральных артерий может приводить к локальному увеличению концентрации ионов кальция в веществе мозга и вызывать петрификацию нейронов базальных ганглиев, но, по мнению авторов, данная гипотеза является исключительно теоретической, а на практике – безосновательной.
Также предполагают возможность генетического характера патологии с локализацией нарушений в четырнадцатой (локус 14q13), второй (локус 2q37) хромосомах, хромосомном участке q21.1-q11.23 восьмой хромосомы. Были установлены варианты, когда болезнь наследовалась аутосомно-доминантным и Х-сцепленным путем [9]. Важно отметить, что имели также место и случаи, в которых семейный характер патологии не прослеживался.
Имеется описание дебюта болезни Фара у пациентки на фоне пневмонии, вызванной SARS-CoV-2 (COVID-19) [10].
Диагностировать болезнь Фара позволяет проведение биохимического анализа крови. Производятся определение электролитов крови: кальция, фосфора, железа, натрия; определение уровня паратгормона; ПЦР-исследования для выявления токсоплазмы, цитомегаловируса и других инфекционных агентов, способных вызывать воспалительные изменения тканей мозга с образованием кальцификатов.
Ключевое значение в диагностике болезни Фара имеют инструментальные методы исследования – УЗИ щитовидной и паращитовидных желез, компьютерная томография и рентгенография.
Лечение заболевания проводят только симптоматически. При симптомах паркинсонизма назначают предшественники дофамина (леводопу), при гиперкинезах – холинолитики (циклодол), в случае эпилептических состояний – барбитураты (фенобарбитал) и бензодиазепины (феназепам, лоразепам, клоназепам). С целью улучшения обменных процессов применяют стимуляторы тканевого метаболизма (глютаминовую кислоту, никотинамид), цитопротекторы (рибофлавин, янтарную кислоту).
В работе нами был проанализирован случай диагностики болезни Фара по результатам аутопсии. Пациентка женского пола М., 1949 года рождения, поступила в ГБУЗ СГКБ № 1 им. Н.И. Пирогова с жалобами на общую слабость, головокружение, мышечные спазмы, тошноту, рвоту, повышенную температуру. При поступлении состояние средней тяжести. При осмотре кожные покровы бледные, видимые слизистые физиологической окраски, зев гиперемирован. Дыхание везикулярное, ЧДД – 12 в минуту, ЧСС – 79 в минуту, пульс ритмичный, АД – 135/75 мм рт. ст., температура 37,4°C. Пациент в сознании, на контакт идет, внимание рассеянное, лицо симметричное, походка неуверенная, наблюдается тремор верхних конечностей. В отделении проведено обследование в полном объеме.
Результаты анализов на ВИЧ, гепатиты B и C отрицательны. В общем анализе крови отклонений от нормы не выявлено. В ходе биохимического анализа крови обнаружены следующие изменения: гипергликемия (глюкоза – 9,2 ммоль/л), гиперкальциемия (кальций – 3,1 ммоль/л), гипокалиемия (калий – 3,2 ммоль/л).
Компьютерная томография головного мозга: геморрагический инсульт в области базальных ядер справа и слева, двусторонняя симметричная кальцификация базальных ганглиев, таламусов, зубчатых ядер и белого вещества больших полушарий.
Макроскопическая картина центральной нервной системы по результатам аутопсии
Кости свода и основания черепа целые. Твердая мозговая оболочка не напряжена, гладкая, сероватая. Мягкая мозговая оболочка отечная, полнокровная. Полушария мозга симметричны. Мозг весом 1410 г. Борозды незначительно углублены. Сосуды основания мозга с единичными атеросклеротическими бляшками на интиме, стенозирующими просвет до 20%. В области базальных ядер головного мозга справа – участок дрябловатой ткани мозга диаметром 1 см с единичными кровоизлияниями диаметром до 1 мм. Выражено полнокровие мелких сосудов. Желудочки мозга незначительно расширены, эпендима гладкая, в просвете прозрачный ликвор. На миндалинах мозжечка следы давления краев большого затылочного отверстия. Во всех других отделах анатомический рисунок строения вещества головного мозга хорошо выражен, с четкой границей и обычным соотношением серого и белого вещества. Ткань мозга на разрезе влажная, блестящая; в области базальных ядер – издает характерный хруст – звон.
Гистологическое исследование головного мозга
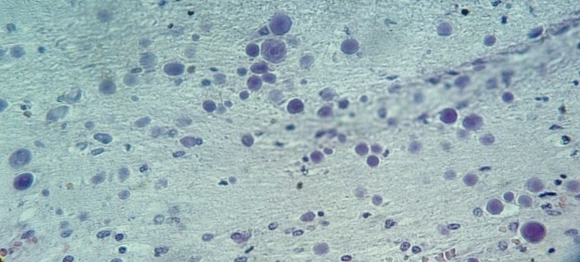
В микропрепарате коры головного мозга – многочисленные зернистые шары (рис. 1).
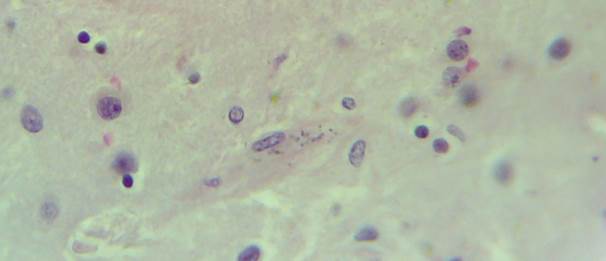
В микропрепаратах базальных ганглиев – неравномерное кровенаполнение, диапедезные кровоизлияния вокруг сосудов (рис. 2А), умеренный периваскулярный и перицеллюлярный отек (рис. 2А-Б).
Стенки сосудов деформированные (рис. 3А), со множественными консолидированными (рис. 3А) и пылевидными (рис. 3Б) кальцинатами в виде концентрических преимущественно равномерно распределенных колец между адвентицией, средней оболочкой и пограничной мембраной глии.
Рис. 1. Препарат коры головного мозга пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Многочисленные зернистые шары. Окраска гематоксилин-эозином. Увеличение х200
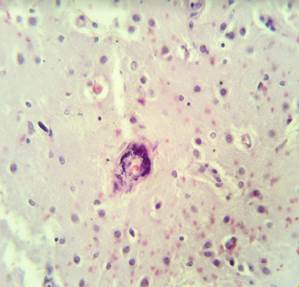
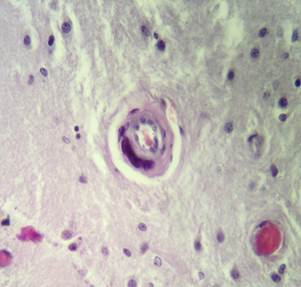
Рис. 2. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – диапедезные кровоизлияния вокруг кальцинированных сосудов с деформированной стенкой, умеренный перицеллюлярный отек. Б – кальцинированный сосуд, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
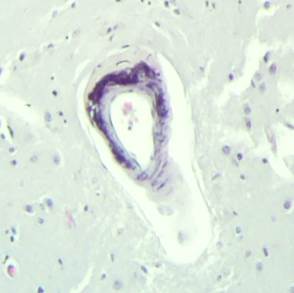
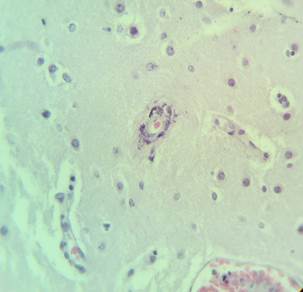
Рис. 3. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные кальцинаты в стенке сосуда, выраженный периваскулярный отек. Б – пылевидные кальцинаты в стенке сосуда, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
Кальцинаты обнаружены в артериях мелкого и среднего калибра, а также в единичных венах (рис. 4А-Б). В веществе мозга и перинейронально имеются кальцинаты в форме различных по размерам глыбок округлой формы (рис. 4Б – крупные кальцинаты, рис. 5 – пылевидные кальцинаты в веществе мозга). Отдельные нейроны кальцинированы.
Со стороны сердечно-сосудистой системы определена концентрическая гипертрофия миокарда (масса сердца 360 г, толщина стенки левого желудочка 1,7 см, правого – 0,4 см, гистологически – гипертрофия мышечных волокон, диффузное разрастание мелких полос соединительной ткани), атеросклероз аорты и ее ветвей, стенозирующий атеросклероз коронарных артерий (III стадия, 3-я степень, стеноз до 30% правой и левой коронарных артерий).
В правом надпочечнике макроскопически определяется округлое образование диаметром 1,2 см, на разрезе равномерного желтовато-оранжевого цвета, гистологически – светлоклеточная аденома надпочечника.
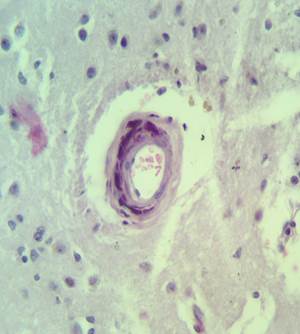
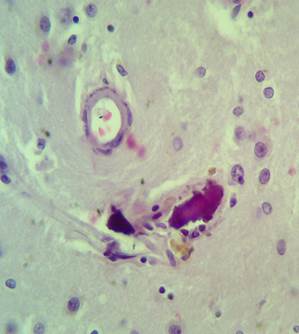
Рис. 4. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные и пылевидные кальцинаты в стенке сосуда, выраженный периваскулярный и умеренный перицеллюлярный отек. Б – пылевидные кальцинаты в стенке сосуда, крупный перинейрональный кальцинат, слабый перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х250
Рис. 5. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Пылевидные кальцинаты в веществе головного мозга. Окраска – гематоксилин-эозином. Увеличение х400
При анализе данного клинического случая мы склонны считать болезнь Фара и артериальную гипертензию важнейшими сочетанными нозологическими единицами, безусловно повлиявшими на танатогенез. Повышение давления в кальцинированных сосудах мелкого калибра, не обладающих должной эластичностью, приводит к развитию очаговых кровоизлияний.
В связи с разнообразной неспецифической неврологической симптоматикой, а часто и полным отсутствием каких-либо проявлений болезнь Фара остается одним из малоизученных нейродегенеративных заболеваний.
Разработанные и в целом доступные методы диагностики позволяют выявлять феррокальциноз пациентов, однако ограниченность серьезных генетических и лабораторных методов диагностики, низкая приверженность к назначению компьютерной томографии пациентам без клиники острого нарушения мозгового кровообращения объясняют позднюю выявляемость данной патологии; наличие специфической макроскопической и микроскопической картины обусловливает выявление болезни Фара почти исключительно по данным аутопсии.