кариотипирование клеток костного мозга что это
Кариотипирование при онкогематологических заболеваниях
Общая характеристика
Цитогенетический анализ клеток костного мозга (кариотип) или стандартное кариотипирование клеток костного мозга, стандартная цитогенетика в метафазных пластинках – это исследование, целью которого является оценка количества и структуры хромосом клеток кроветворной ткани. Материал для кариотипирования костного мозга получают путем аспирации костного мозга методом стернальной пункции или трепанобиопсии подвздошной кости. Большинство опухолей кроветворной системы связаны с возникновением генетических изменений в гемопоэтической клетке, которые приводят к её злокачественной трансформации и появлению опухолевого клона. Определенные генетические нарушения специфичны для определенного заболевания, поэтому их обнаружение считается достоверным диагностическим критерием. Кроме того, наличие некоторых генетических аномалий может влиять на прогноз заболевания, его чувствительность к тем или иным способам лечения и, соответственно, помогает выбрать наилучшую тактику ведения пациента и тактику терапии. Стандартное цитогенетическое исследование клеток костного мозга представляет собой изучение количества и структуры хромосом клеток и позволяет выявить геномные (нарушения в количестве хромосом) и хромосомные (изменения в их структуре) мутации.
Хромосомы – это структуры в ядре клетки, в которых компактно собрана генетическая информация в виде ДНК. Когда клетка находится в состоянии покоя, хромомосы упакованы в клеточном ядре и визуально различить их друг от друга невозможно. Однако в одну из фаз деления клетки, которая называется метафаза, хромосомы выстраиваются в одну плоскость в центре клетки, формируя так называемую метафазную пластинку. Именно такие метафазные пластинки и изучаются в процессе цитогенетического исследования. Кроветворные клетки костного мозга постоянно делятся, поэтому часть из них во время взятия как раз будет находиться в метафазе своего деления. Преимущество такого метода цитогенетического исследования в том, что оно не требует дополнительных воздействий на клетки для стимуляции деления и получения метафаз. После обработки биоматериала различными химическими веществами клетки фиксируют на предметных стеклах и производят окраску. Существует несколько методов окраски хромосом, каждый из которых позволяет лучше дифференцировать те или иные особенности их строения. Хромосомы анализируется как с помощью микроскопа, так и с использованием компьютерных аналитических систем, которые существенно повышают качество и скорость исследования.
Кариотипирование проводится как минимум на двадцати хорошо окрашенных, полных метафазных пластинках с хорошим разбросом хромосом. Исследователь подсчитывает их количество и проводит оценку структуры каждой путем сопоставления двух аналогичных хромосом и сравнения их с цитогенетическими картами.
Что такое цитогенетическое исследование или кариотипирование?
Это анализ, позволяющий установить изменения в хромосомном аппарате клеток, прежде всего, аномалии числа хромосом и наличие структурных перестроек. Цитогенетический анализ используется в диагностике многих врожденных и приобретенных заболеваний.
Обнаруженная хромосомная патология может являться причиной первичного мужского и женского бесплодия, а также тяжелых хромосомных заболеваний у детей, например, синдром Дауна (дополнительная 21 хромосома в кариотипе). Нарушения могут затрагивать и половые хромосомы. Так при синдроме Клайнфельтера в кариотипе мужчины имеется дополнительная Х хромосома.
Зачем это делается?
Цитогенетическое исследование проводятся для того, чтобы:
Многие наследственные патологии могут не проявляться на протяжении нескольких поколений. Поэтому оптимально – сдавать анализы всем супругам на этапе планирования беременности даже при отсутствии показаний.
Показания для кариотипирования
В случае наличия хотя бы одного из приведенных ниже факторов рекомендуется сдать кровь на цитогенетический анализ:
Как правильно сдавать?
Для анализа необходимы кровяные клетки. Поэтому исключают влияние разных факторов, осложняющих их рост. В противном случае результаты получаются неинформативными. Не допускается сдача крови при наличии острых заболеваний или обострении хронических. Примерно за 2 недели до предполагаемой даты отказываются от приема любых медикаментозных препаратов, в особенности антибиотиков. Употребление алкоголя, а также курение тоже нужно исключить.
Как долго проводится цитогенетический анализ?
Цитогенетический анализ обычно проводится в течение 20-30 дней с момента поступления образца в лабораторию. По результатам анализа обязательно получить консультацию врача-генетика, который даст Вам исчерпывающую информацию по данным проведенного исследования.
Цитогенетическое исследование (кариотип) (кровь венозная)
Хромосомы в обычном состоянии клетки в ядре не видны, они становятся видны под микроскопом только на определенных фазах деления клеток. Для изучения кариотипа используются клетки в метафазе митоза.
Для проведения исследования у пациента берут кровь и выделяют из нее лимфоциты. Далее с помощью специальных веществ заставляют лимфоциты делиться. Через несколько дней деления культура обрабатывается специальным веществом, которое останавливает процесс деления клеток именно на той стадии, когда видны хромосомы. Из клеток культуры готовятся специальные мазки на стеклах, которые используются для исследования. В лаборатории «ГЕМОХЕЛП» просматривают митозы под световым микроскопом OLYMPUS BX 43F с использованием цифровой камеры высокого разрешения аппаратно-программного комплекса CytoLabView.
Выделяют две стадии данного исследования.
Первой стадией анализа ограничиваются большинство цитогенетических лабораторий. Специалист генетик анализирует под микроскопом 11-15 клеток (митозов) на предмет выявления количественных и структурных аберраций (мутаций, изменений).
В результате данного исследования выдаются результаты, где может быть указано: 46, ХХ (нормальный женский кариотип), 46, ХY (нормальный мужской кариотип), 45, ХО (синдром Шерешевского-Тернера), 45, XX, der (13; 14)(q10; q10) (робертсоновская транслокация) и др.
Аберрации могут носить регулярный и нерегулярный характер. Регулярные аберрации обнаруживаются в большом проценте клеток или во всех клетках. Они передаются от родителей, возникают в момент зачатия или в первые дни после зачатия. Нерегулярные мутации чаще всего являются свидетельством воздействия на организм неблагоприятных факторов (радиация, химические вредности и пр.).
Заболевания, обусловленные нарушениями в кариотипе.
Кариотипы
Болезнь
Комментарии
47,XXY; 48,XXXY
Синдром Клайнфельтера
Полисомия по
X-хромосоме у мужчин
45X0; 45X0/46XX;
45,X/46,XY; 46,X iso (Xq)
Моносомия по
X-хромосоме,
в т. ч. и мозаицизм
47,ХХX; 48,ХХХХ;
49,ХХХХХ
Полисомии по
X хромосоме
47,ХХ,+21; 47,ХY,+21
Болезнь Дауна
Трисомия по
21-й хромосоме
47,ХХ,+18; 47,ХY,+18
Синдром Эдвардса
Трисомия по
18-й хромосоме
47,ХХ,+13; 47,ХY,+13
Синдром Патау
Трисомия по
13-й хромосоме
46,XX, 5р-
Синдром кошачьего крика
Делеция короткого плеча
5-й хромосомы
Для выяснения следов действия вредных факторов на геном анализа 11-15 клеток бывает недостаточно.
В лаборатории «ГЕМОХЕЛП» проводится лишь первая стадия исследования.
Показания к назначению исследования:
Кариотипирование клеток костного мозга что это
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Разрешающая способность «интерфазной цитогенетики» на два порядка выше, чем классической цитогенетики.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
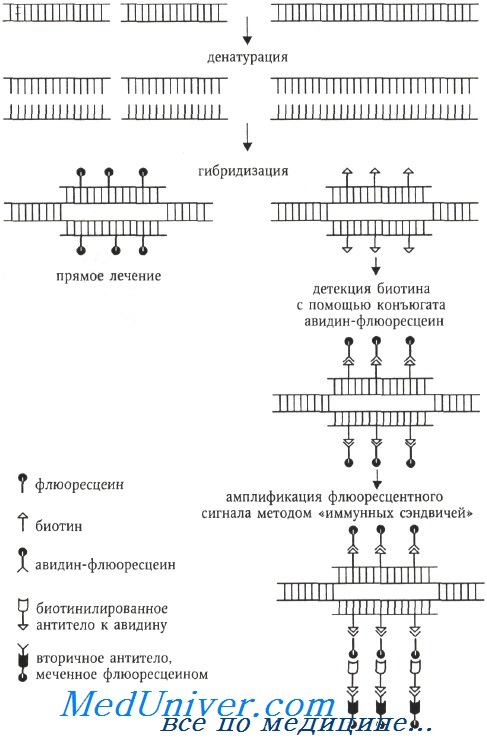
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Для амплификации флюоресцентного сигнала применяется метод «иммунных сэндвичей». Например, на препарат, изображенный на схеме, наносят биотинилированные антитела к авидину, а затем снова комплекс авидин-флюоресцеин. При необходимости цикл может быть повторен. Антитела в свою очередь выявляются с помощью ферментативного (например, авидинпероксидазы) или флюоресцентного детектора.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Анализ кариотипа лимфоцитов периферической крови (количественные и структурные аномалии хромосом), с фотографией в Москве
Приём и исследование биоматериала
Когда нужно сдавать анализ Анализ кариотипа лимфоцитов периферической крови (количественные и структурные аномалии хромосом), с фотографией?
1. Наличие в анамнезе 2 и более самопроизвольных выкидышей.
2. Бесплодие.
3. Олигозооспермия.
4. Необструктивная форма азооспермии.
5. Первичная (или вторичная) аменорея.
6. Замершая беременность.
7. Случаи детской смертности на первом году жизни или рождения в семье мертвого ребенка.
8. Рождение ребенка с врожденными сочетанными пороками.
9. Задержка развития малыша (как физического, так и умственного.
10. Генетические заболевания у родителей и близких родственников.
11. Подозрение на генетическую патологию по имеющимся внешним признакам (например: специфическая форма черепа, пальцев рук, аномалии наружных половых органов, глаз, носа и т.д.).
12. Обследование доноров генетического материала.
Подробное описание исследования
2,5%) с аномальными кариотипами донашивают до окончания беременности. Хромосомные аномалии у новорожденных являются причиной 45-50% множественных врожденных пороков развития, около 35% случаев умственной отсталости и 50% отсутствия менструации у женщин. У взрослых хромосомные аномалии клинически могут не проявляться и вовсе, или иметь место в стертых формах. Часто человек считает себя абсолютно здоровым и не подозревает о каких-либо генетических нарушениях. Но он не может иметь детей. Поэтому исследование кариотипа лимфоцитов крови рекомендуется обязательно делать всем бесплодным парам.
Другие названия этого исследования
Cariotip,Cariotyping,Chromosome Analysis,Karyotype analysis
Кариотип,Кариотипирование,Определение хромосомного набора,Синдром Дауна, Патау, Клайнфельтера, Шерешевского-Тёрнера,Хромосомные аномалии,Хромосомные риски,Хромосомы
Подготовка к исследованию
1. Cпециальной подготовки не требуется.
2. Исследование проводится на сытый желудок (1,5-2 часа после еды).
3. Биоматериал должен быть доставлен в лабораторию в день взятия. Хранение не допускается.
Противопоказания и ограничения
Факторы, влияющие на результаты исследований
1. Перед диагностикой не рекомендуется подвергать себя стрессовым ситуациям, принимать спиртные напитки и курить.
2. Рацион и прием лекарственных препаратов не влияет на результат исследования.