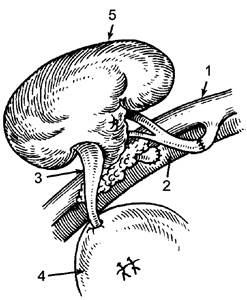
консервация органов и тканей
Консервирование тканей и органов.
Показания:ткани и органы людей, погибших в результате несчастных случаев (травм) или скоропостижно скончавшихся от различных причин (инфаркт миокарда, апоплексия мозга).
Противопоказания:смерть от отравления, СПИДА, злокачественных опухолей, малярии, туберкулеза, сифилиса и др.
Органы берут сразу после констатации смерти мозга. Ткани изымают и консервируют в первые 6 часов после смерти.
Изъятие проводят в специальных помещениях с соблюдением правил асептики и антисептики. Взятые ткани и органы отмывают от крови и тканевой жидкости.
Консервируют одним из следующих способов:
· Помещают в р-ры, содержащие антисептики или антибиотики, с последующим хранением в охлажденных р-рах, плазме или крови реципиента.
· Лиофилизация (замораживание с последующей сушкой в вакууме) при консервировании костей.
· Консервирование в р-рах альдегидов (формальдегид, глутаральдегид).
· Консервирование в стерильном парафине.
· Помещают р-р Евро-Коллинз при температуре 4-6 С.
БИЛЕТ № 6
1. Травматический токсикоз. Клиника, лечение.
Травматический токсикоз (синдром длительного раздавливания) – своеобразное патологическое состояние, обусловленное длительным (более 2-4 ч) и различным по интенсивности сдавливанием, преимущественно мягких тканей.
Возникает сразу после ликвидации воздействия механического ф-ра, т.е. после извлечения пострадавшего из-под обломков разрушенных зданий, завалов.
Синдром позиционного сдавления – под тяжестью собственного тела.
Клиника:
1) Нарастание отека и появление сосудистой нед-ти (1-3 сутки):
Бледность и сильные боли в освобожденной конечности, отек → конечность багрово-синюшная→ участки некроза, признаки нарушения кровообращения (тромбозы).
Жалобы: боли различного х-ра.
Общ.сост.- слабость, озноб, тахикардия, лихорадка.
При большом объеме повреждений – травматический шок.
2) Развитие острой почечной нед-ти (3-14 сутки):
Моча становится бурого цвета, ее количество резко ↓, в плазме ↑ концентрация ионов калия, креатинина, мочевины.
Конечность: появляются пузыри с серозным и геморрагическим содержимым, в мышечной ткани очаги некроза.
3) Выздоровление – восстановление ф-ций почек, жизнеспособности сдавленной конечности.
Лечение.
Первая помощь:
· Выше места сдавления кровоостанавливающий жгут (не более 2 ч)
· Конечность охладить, транспортная иммобилизация.
· Противошоковые мероприятия (наркотические анальгетики, плазмозамещающие, ощелачивающие р-ры).
В стационаре:
· Дезинтоксикационная терапия (в/в до 3-4 л кристаллоидных и низкомолекулярных декстранов в сутки), антибиотикотерапия терапия.
· В первом периоде: хирургическая об-ка ран, некрэктомия вплоть до ампутации конечности, новокаиновые блокады. Создание гипотермии конечности в течение первых 1-2 суток.
· Во втором периоде: максимальное удаление всех нежизнеспособных тканей конечности, дентоксикация организма (гемодиализ, электрофорез).
· Плановое лечение поврежденных мягких тканей и костных стр-р пораженной конечности.
2. Газовая гангрена. Этиология, патогенез. Ранние симптомы газовой гангрены.
Газовая гангрена – это тяжелое заболевание, вызванное патогенной анаэробной микрофлорой. Х-ся быстро наступающим некрозом ткани, с образованием газов, тяжелой интоксикацией и отсутствием воспалительных явлений.
Патогенез:
Ф-ры, способствующие развитию:
1) Местные:
· Обширные глубокие повреждения тканей и загрязнение их землей и обрывками одежды.
2) Общие:
БИЛЕТ № 7
1. Стерилизация металлических хирургических инструментов и инструментов, зараженных спороносной инфекцией.
Предстерилизационная подготовка:
· Обеззараживание.Инструменты погружают в дез.р-р. (3% р-р хлорамина – 40-60 мин, 6% р-р перекиси водорода). Промывают проточной водой.
· Мытье.Инструменты погружают в специальный моющий (щелочной р-р) = моющее ср-во (стиральный порошок) + пероксид водорода + вода. Т-ра 50-60 С, экспозиция 20 мин. После замачивания инструменты моют щетками в том же р-ре, а затем – в проточной воде.
· Высушивание. Естественным путем либо в сухожаровом шкафу при t 80 С в течение 30 мин.
Стерилизация:
· Нережущих металлических инструментов.Стерилизация горячим воздухом в сухожаровом шкафу или автоклаве при стандартных режимах. Некоторые виды простых инструментов (пинцеты, зажимы, зонды и др.), предназначенные для одноразового применения можно стерилизовать лучевым способом.
· Инструменты после операции с анаэробной инфекцией – ДРОБНАЯ СТЕРИЛИЗАЦИЯ.
1)Замочить на 1час в спец.р-ре, сост.6% р-ра перекиси водорода и 0,5% р-ра моющего ср-ва, вымыть щеткой и прокипятить 90 мин.
2)Подготовить к стерилизации обычным способом.
3)Дробная стерилизация – стерилизуют, оставляют при комнатной температуре, ч/з 24 часа подвергают автоклавированию или кипячению.
2. Профилактика и лечение газовой гангрены.
БИЛЕТ № 8
1. Растяжения и разрывы связок. Патогенез, клиника и лечение.
· Растяжение– при резком и внезапном сильном движении, превышающем пределы эластичности связок, но с сохранением их анатомической целостности.
Чаще растяжение связок голеностопного сустава (при подвертывании стопы), реже коленного сустава.
Клиника: локальная болезненность, припухлость, отек тканей, болезненность движения в суставе.
Лечение: покой, давящая повязка, холод в первые сутки (замораживание трихлорэтиленом – снимается боль, уменьшается кровоизлияние и отек), затем тепловые процедуры для рассасывания кровоизлияния.
· Разрыв –при переходе барьера эластичности с нарушением анатомической целостности.
1 ст. – разрыв (отрыв) отдельных волокон.
2 ст. – частичный разрыв связки.
3 ст. – полный разрыв связки.
Наиболее часто голеностопный и коленный суставы.
Клиника: боль, отек, гематома, ограничение ф-ции сустава. Гемартроз (в коленном суставе) – симптом баллотирования надколенника, на рентгене – расширение межсуставной щели.
Лечение:
1ст. первые сутки – покой, давящая повязка (8-миобразное плотное бинтование сустава), холод. С 3-х суток тепловые процедуры, массаж. Ф-ции сустава восстанавливаются ч/з 10-15 дней.
2 и 3 ст. – наложение гипсовой повязки. К осторожным движениям приступают ч/з 2-3 недели после травмы, постепенно увелиивая нагрузку. В особо тяжелых случаях – оперативное вмешательство (сшивание связок).
При гемартрозе – пункция сустава, затем наложить гипсовую повязку на 2-3 недели. При необходимости пункцию повторить.
2. Хирургическая обработка гнойной раны. Техника проведения. Усовершенствованные способы проведения хирургической обработки.
Хирургическая обработка:
1) Об-ка операционного поля антисептиком.
3) Раскрытия раны, иссечение некроза. ( Края раны не иссекаются. )
4) Дополнительные методы об-ки раны – цель снизить бактериальное число.
· Промывание раны под струей.
5) Дренирование раны.
6) В зависимости от фазы раневого процесса.
· Фаза воспаления: очищение раны от некротических масс – антисептики, протеолитические ферменты, сорбенты, мази на водорастворимой основе (левомиколь) – на 2-3 сутки. При необходимости ВХО (вскрытие гнойного очага и затеков, иссечение нежизнеспособных тканей, осуществление адекватного дренирования раны).
· Фаза регенерации: мази на жировой основе (5% и 10% метилурациловая мазь, хлорамфениковая, тетрациклиновая, гентамициновая мази), стероидные препараты (гидрокортизон – стимулирует регенерацию и улучшает региональное кровообращение).
· Фаза образования и реорганизации рубца: мази, лечебная физкультура, физиотерапия.
7) Вторичный шов: ранний – до 15 суток, поздний после 15 суток.
БИЛЕТ № 9
1. Пробы при переливании крови. Последовательность и техника проведения пробы.
Два направления консервации органов для трансплантации
Сейчас в России проводятся порядка 2 тыс. трансплантаций органов ежегодно. Ограничения на число трансплантаций накладывают как общая нехватка органов из-за отсутствия доноров, так и малая длительность хранения трансплантатов, ограничивающая их транспортировку.
Используемый в клинической практике метод сохранения донорских органов — статическая холодовая консервация — обеспечивает жизнеспособность трансплантатов при сроках консервации, не превышающих 24 часа для почки, 12 часов для печени и 6 часов для сердца. При таких сроках хранения — особенно сердца — становится крайне затруднена логистика донорских органов.
Пролонгация хранения органов существенно улучшила бы ситуацию с доступностью пересадок за счет более эффективной логистики, а разработка технологии долговременного — например, месячного — хранения в перспективе способствовала бы ликвидации дефицита донорских органов за счет создания соответствующих криобанков.
Сегодня хранение органов стандартно осуществляется в специальном консервирующем растворе в гипотермических условиях при 4°С (статическая холодовая консервация).
Рассматривая же проблему долговременного хранения органов, необходимо говорить о низкотемпературном замораживании, а не о гипотермии. Скорость протекания химических реакций экспоненциально падает с понижением температуры, и чтобы остановить метаболизм на требуемый месяц, необходимо глубокое охлаждение, до –70°С и ниже. Для макрообъектов, таких как массивы тканей и целые органы, проблема глубокого охлаждения не решена.
Таким образом, можно выделить два основных направления развития технологий консервации органов: разработка новых подходов к пролонгации гипотермического хранения и разработка способа низкотемпературного замораживания для долговременного хранения.
По первому направлению в Институте биофизики клетки РАН (Пущино) проведены исследования по консервации сердца в газовых смесях различного состава при 4°С и подобраны варианты сочетанного воздействия давления смеси газов на основе монооксида углерода и органопротекторных фармакологических субстанций, обеспечивающобеспечивающие эффективное восстановление активности изолированного сердца крыс после 24 и более часов гипотермического хранения. Высокая сохранность трансплантата показана в серии гистологических анализов, а приживляемость подтверждена на модели гетеротопической пересадки сердца крысы.
Также впервые газовая консервация успешно использована для сердца мини-свиньи (вес животных — 35 кг). Достигнуто восстановление сократительной активности после 20-часового хранения при температуре 4°С как на перфузионном стенде, так и на модели гетеротопической пересадки.
Предложенный подход по нескольким критериям превосходит активно разрабатываемые сегодня в мире системы для перфузионного хранения органов, основанные на нормотермической перфузии с оксигенацией кровью, когда донорский орган сохраняется в условиях, близких к физиологическим.
По второму направлению — низкотемпературному замораживанию органов — наиболее перспективным представляется перевод внутриклеточной воды в стекловидное состояние (витрификация), когда не образуется отдельных кристаллов льда — ключевого повреждающего фактора при глубоком охлаждении.
На практике витрификация требует высоких концентраций (до 70 весовых процентов) проникающих низкомолекулярных агентов (этиленгликоль, ДМСО), для того чтобы повысить вязкость среды и достичь критической температуры стеклования. Но такие концентрации оказывают токсический эффект на живые клетки.
В институте разработана и экспериментально обоснована на клеточной, тканевой и органной моделях концепция витрификации биологических объектов, обеспечивающая замораживание без кристаллизации в условиях сниженной на 20–30% суммарной концентрации витрифицирующих агентов. С ее помощью осуществлена успешная криоконсервация клеточных суспензий, аорты крысы, а также изолированного органа — сердца травяной лягушки (Ranatemporaria). Хранение сердца осуществляли при температурах –130°С и –196°С в течение времени, варьировавшегося от одних суток до полутора месяцев, с последующим восстановлением сократительной активности на перфузионном стенде.
Владимир Тесленко, кандидат химических наук; по материалам VI съезда биофизиков России
Владимир Тесленко, кандидат химических наук; по материалам VI съезда биофизиков России
Консервирование тканей и органов
Для трансплантации пригодны ткани и органы людей, погибших в результате несчастных случаев (травм) или скоропостижно скончавшихся от различных причин (например, инфаркт миокарда, апоплексия мозга). Противопоказаниями для изъятия и консервирования тканей и органов считают такие причины смерти, как отравления, СПИД, злокачественные опухоли, малярия, туберкулёз, сифилис и т.п. Целесообразно у потенциального донора брать внутренние органы сразу же после констатации смерти мозга. Ткани (кожу, сухожилия, роговицу и др.) изымают и консервируют в первые 6 ч после смерти.
Изъятие тканей и органов для трансплантации производят в специальных помещениях с соблюдением правил асептики и антисептики. Взятые ткани и органы тщательно отмывают от крови и тканевой жидкости и затем консервируют, используя для этого различные методы.
• Помещение в растворы, содержащие антисептические средства или антибиотики, с последующим хранением в охлаждённых растворах, плазме или крови реципиента.
• Лиофилизацию (замораживание с последующей сушкой в вакууме) применяют для консервирования костей.
• Погружение в парафин, растворы альдегидов (формальдегида, глутаральдегида). В специальных контейнерах ткани и органы из лаборатории доставляют в клинику, где они находятся в специальных растворах при температуре 4 °С.
Реакция трансплантационного иммунитета
В первые 4-5 сут после трансплантации происходит приживление пересаженной ткани, иммунокомпетентные клетки реципиента в этот период идентифицируют чужой антиген. С 4-5-х суток в пересаженной ткани нарушается микроциркуляция, развивается отёк, начинается инвазия пересаженного органа мононуклеарными клетками. Т-лимфоциты приобретают цитотоксические свойства, а система В-лимфоцитов синтезирует антитела, в результате аллотрансплантат или ксенотрансплантат отторгается. Повторная аллотрансплантация от одного и того же донора вызывает трансплантационную иммунную реакцию в 2 раза быстрее, поскольку организм уже сенсибилизирован.
Современная иммунологическая концепция пересадки тканей и органов связана с взаимодействием субпопуляций Т- и В-лимфоцитов, где ведущую роль отводят субпопуляции Т-лимфоцитов (хелперным, киллерным и супрессорным клеткам).
Каждый живой организм обладает определённым иммунным статусом, его оценка создаёт основу для типирования иммунной совместимости донора и реципиента. Согласно основным законам генетики, каждый индивид имеет антигены HLA-сублокуса, относимые к антигенам тканевой совместимости, они локализуются в клеточных мембранах. Наличие нескольких SD- и LD-детерминант HLA-комплекса определяет трудности, сопровождающие подбор совместимых донора и реципиента. Вероятность подбора идентичного генотипа составляет не более 1:640 000.
С целью повышения эффективности аллотрансплантации проводят различные мероприятия.
• Замена гематолимфоидной системы реципиента до аллотрансплантации путём тотального радиационного угнетения лимфоидной ткани с последующей пересадкой костного мозга донора.
• Селективная элиминация Т-киллерных клеток с одновременной стимуляцией активности Т-супрессорных клеток. Подобным избирательным действием характеризуется циклоспорин.
С точки зрения совместимости тканей идеальна трансплантация собственного органа или тканей.
Реплантация оторванной конечности или её фрагмента возможна в первые 6 ч после травмы при условии хранения оторванной конечности при температуре 4 °С, с перфузией её сосудов перед пересадкой. После первичной хирургической обработки восстанавливают кость, затем производят пластику вены и артерии, после этого сшивают нервы, мышцы, сухожилия, фасции, кожу. В послеоперационном периоде принимают меры для предупреждения синдрома травматического токсикоза, используя гипотермию, абактериальную среду.
После удаления печени реципиента аллогенную печень трансплантируют в нормальное ложе в правом верхнем секторе брюшной полости (ортотопическая трансплантация).
При гетеротопической трансплантации донорскую печень размещают в другой области брюшной полости реципиента.
Функции печени на непродолжительный период можно поддержать кратковременной экстракорпоральной перфузией печени трупа или животного (свиньи, теленка).
Трансплантацию сердца выполняют при тяжёлой сердечной недостаточности, связанной прежде всего с прогрессирующей кардиомиопатией, аневризмами левого желудочка сердца, некорригируемыми врождёнными пороками сердца, включающими двухкамерное сердце, атрезию правого предсердно-желудочкового (трёхстворчатого) клапана и др.
Обоснованием пересадки сердца в клинике послужили экспериментальные исследования А. Карреля (1905) и В.П. Демихова (1946-1960). А. Кантровиц в Нью-Йорке повторил подобную операцию у грудного ребёнка. Позже выяснилось, что первая попытка трансплантации сердца была сделана в 1964 г. в штате Миссисипи американцем Дж. Харди, выполнившим ксенотрансплантацию сердца шимпанзе 68-летнему больному.
Признаки отторжения сердца сначала выявляют на ЭКГ (тахикардия, экстрасистолия, уменьшение вольтажа зубцов). Повторные эндокардиальные биопсии сердца подтверждают диагноз.
Определённое значение имеет применение механического сердца. В настоящее время искусственное сердце с пневмоприводом используют для кратковременного замещения сердца при отсутствии донорского.
Трансплантация эндокринных желёз
В клинике используют пересадку щитовидной железы, гипофиза, надпочечников, яичка, поджелудочной железы.
Свободную пересадку эндокринных желёз выполняют давно, но функции желёз реализуются лишь до рассасывания имплантированных тканей. Трансплантация эндокринных желёз на сосудистой ножке сохраняет полностью структуру и функции железы.
Технические вопросы трансплантации органов в современных условиях решены, но абсолютный успех возможен лишь после разрешения проблемы тканевой совместимости.
Дата добавления: 2017-09-19 ; просмотров: 631 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Консервация органов и тканей
Современный подход к проблеме консервации органов характеризуется общебиологическими позициями, а также использованием кибернетических методов исследования. Выяснено, что чувствительность пересаживаемых органов к гипоксии настолько велика, что даже кратковременная ишемия приводит к той или иной степени их функционального повреждения. Главная задача консервации состоит в создании таких условий, при которых энергетические траты изолированных органов могли бы максимально продолжительное время адекватно восполняться.
На современном этапе существуют два основных, прямо противоположных пути решения этой задачи: во-первых, использование методов, напранленных на обратимое снижение всех видов обмена до возможно более низкого уровня; во-вторых, применение способов поддержания органного (а при консервации тканей или клеток — соответственно тканевого или клеточного) обмена на нормальном уровне с полным сохранением функциональной способности изъятых из организма органов и тканей. Среди методов, обеспечивающих реализацию первого пути, следует выделить три основных: 1) фармакологическое воздействие; 2) гипотермию и гипербарическую оксигенацию; 3) замораживание.
Фармакологическое воздействие на клеточный метаболизм возможно путем применения различных ингибиторов окисления (например таких, как анаболический стероид — анаболии), стимуляторов гликолитических процессов, веществ, акцентирующих протоны водорода, а также веществ, стабилизирующих внутриклеточные мембраны (например, магнезии). К сожалению, метод фармакологического воздействия при консервации органов еще мало изучен и почти неуправляем. Гораздо более перспективным является применение гипотермии (самостоятельно и в комбинации с гипербарической оксигенацней и перфузией).
В основе защитного действия гипотермии лежит снижение функциональной активности органов, ведущее к торможению обменных процессов и снижению потребности в кислороде. Применяются внутреннее охлаждение органа (путем перфузии через артериальную систему) и наружное охлаждение (путем погружения органа в охлажденный отмывающий раствор).
Однако исследования показали, что после консервации органа в условиях гипотермии уже через несколько часов наступают метаболические нарушения, вызванные ферментативным дисбалансом, что объясняется различными температурными характеристиками многочисленных клеточных ферментов. Кроме того, в условиях гипотермии снижается константа диссоциации органических кислот, что улучшает их диффузию через клеточные мембраны и усиливает их токсичность. Сложности методического порядка не позволяют пока определить оптимальный температурный режим и скорость охлаждения.
Все это заставляет сочетать гипотермию с другими методами: наибольшее распространение получили усиление (пролонгирование) защитного действия гипотермии с помощью фармакологических средств и в особенности (пока в основном в эксперименте) сочетание гипотермии, перфузии и гипербарической оксигенации.
Аппараты для консервации органов должны включать в себя протез сердца (насос), протез легких (оксигенатор), протез внутренней среды (нерфузат) н протез контуров регулирования (систему управления консервацией). Создание таких аппаратов связано с большими техническими сложностями, особенно при устройстве системы управления, и с рядом трудностей биологического характера. Тем не менее созданная в России система жизнеобеспечения консервируемых органон, включающая систему получения информации, обработки ее на математической модели, выбора оптимальных режимов управления насосом, оксигенатором, коррекции состава перфузата и анализатор жизнеспособности органа, уже позволила удлинить сроки консервации органов до 48 ч в эксперименте и до 24 ч в клинике.
В нашей стране разработан принципиально новый способ гипотермической консервации почки с помощью трансорганной газовой перфузии: газ (чистый кислород, кислородно-гелиевая и карбогенная смеси) непрерывным потоком под давлением, не превышающим 60 мм рт. ст., нагнетается в почку одновременно через артерию, вену и мочеточник, пронизывая весь орган; газ диффундирует по направлению к его наружной поверхности и свободно выходит в окружающую среду.
Разрабатываются методы консервации, основанные на замораживании органов и тканей. Достигнуты некоторые положительные результаты и области консервации с помощью низкой температуры таких тканей, как кожа, кости, костный мозг и аорта. Были предприняты попытки замораживания целых органов, таких, как сердце, печень, почка. При этом использовали криофилактики (растворы глицерина и диметилсульфоксида), оттаивание производили различными способами (в том числе с помощью микроволновой радиации). Однако метод консервации органов при помощи замораживания при всей своей перспективности еще далек от окончательной разработки.
Заготовка, консервирование и хранение органов и тканей



ТРАНСПЛАНТОЛОГИЯ
В зависимости от анатомической зоны, в которую помещают трансплантат выделяют ОРТОТОПИЧЕСКУЮ трансплантацию (орган помещают на свое анатомическое место) и ГЕТЕРОТОПИЧЕСКУЮ трансплантацию (орган перемещают в иное, не предназначенное ему природой место).
Помимо пересадки органов, в трансплантологии последних лет появилось новое перспективное направление клеточной трансплантации, когда с целью восстановления функции в организм реципиента пересаживаются культивированные клетки органа.
Источником тканей и органов для трансплантации являются практически здоровые люди погибшие от случайных причин (тяжелых травм не совместимых с жизнью) или скончавшиеся в результате остро развившихся тяжелых заболеваний (инфаркт миокарда, инсульт и т.п.). Наиболее оптимальным для трансплантологии источником являются близкие родственники пациента нуждающегося в пересадке органа или тканей. Это обусловлено тем, что при изогенной или сингенной трансплантации реакция тканевой несовместимости выражена мало и наступает достаточно быстрое выздоровление реципиента. Однако изогенная и сингенная трансплантация возможна только парных органов.
Другим, не менее важным источником для трансплантологии являются ткани трупа (кожа, сухожилия, кости, роговица и т.д.).
Несколько реже в качестве источника тканей для трансплантации используют животных.
Медицинским противопоказанием к изъятию тканей и органов для трансплантации являются все случаи смерти от инфекционных заболеваний, острых и хронических отравлений, злокачественных опухолей, туберкулеза, а также случаи смерти ВИЧ инфицированных пациентов и больных СПИД.
Важным моментом заготовки органов и тканей для аллотрансплантации являются не только медицинские, но и морально-этические и юридические аспекты. Забор органов и тканей должен производится с согласия родственников, после констатации врачебной комиссией смерти мозга потенциального донора. В состав этой комиссии входят: анестезиолог; хирург или нейрохирург; невропатолог; психиатр; лечащий врач. Критерием установления диагноза смерти мозга служат: 1.Глубокая безрефлекторная кома; 2.Отсутствие кашлевого рефлекса при эндотрахеальном отсасывании; 3.Полный центральный паралич дыхания; 4.Изоэлектрическая (нулевая линия) при электроэнцефалографии; 5.Интракраниальная остановка кровообращения (доказанная с помощью ангиографии). Констатация смерти мозга комиссией осуществляется в письменном виде с подписями всех ее членов.
Забор, консервирование и хранение органов и тканей для трансплантации производят при строгом соблюдении правил асептики и антисептики в специально оборудованных лабораториях-операционных центров трансплантологии, НИИ и их филиалов. Изъятие органов у донора выполняют сразу же после констатации комиссией смерти мозга, на фоне внутривенных вливаний донору растворов электролитов, диуретиков, ангиопротекторов, а также при проведении искусственной вентиляции легких. Эти мероприятия имеют цель сохранить функции донорских органов до конца операции их изьятия. не рекомендуется выполнять забор органов в период тепловой ишемии (период времени, когда циркуляция крови уже прекращена, а температура тканей еще близка к нормальной).
Ткани трупа изымают и консервируют в первые 6 часов после смерти. Консервирование тканей трупа возможно в течение первых суток при условии хранения их в специальных условиях при температуре 0 0 С.
После изъятия органы и ткани вначале тщательно отмывают от крови и тканевой жидкости в специальных растворах, а затем, в зависимости от предполагаемой длительности хранения, приступают к консервированию.
Существуют следующие методы консервирования тканей и органов:
2. Консервирование в специальных растворах, содержащих антибиотики или антисептики, с последующим хранением в плазме или крови реципиента или охлажденном растворе;
4. Консервирование в парафине;
5. Консервирование в растворе альдегида (глютаральдегид, формальдегид).
После консервирования материал хранят в специальных условиях в центрах и НИИ трансплантологии, создавая таким образом банк органов и тканей. Доставка органов для трансплантации в хирургические клиники и отделения осуществляется в специальных контейнерах в растворе при температуре +4 0 С.