кортико базальная дегенерация головного мозга симптомы и лечение
Кортико базальная дегенерация головного мозга симптомы и лечение
а) Терминология:
1. Сокращения:
• Кортикобазальная дегенерация (КБД)
2. Синонимы:
• Кортикобазальная ганглионарная дегенерация (СБГД)
• Кортикодентатонигральная дегенерация с ахромией нейронов
3. Определение:
• Кортикобазальная дегенерация (КБД):
о Прогрессирующее нейродегенеративное заболевание
о Характеризуется патологическим отложением тау-белка в коре и полосатом теле
1. Общие характеристики кортикобазальной дегенерации:
• Лучший диагностический критерий:
о Асимметричная атрофия коры больших полушарий (кора лобно-теменных отделов ± ножек мозга)
• Размеры:
о Атрофия
2. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ
• Совет по протоколу исследования:
о Аксиальные и корональные Т2-ВИ и FLAIR-изображения
3. КТ признаки кортикобазальной дегенерации:
• Бесконтрастная КТ:
о Асимметричная атрофия коры больших полушарий
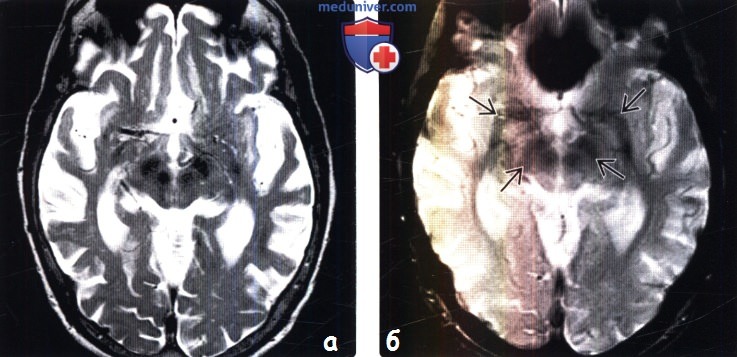
(б) MPT, Т2* GRE, аксиальный срез: у того же пациента наблюдается эффект «выцветание» изображения в области значительной степени минерализованных красных ядер, черной субстанции и нижних базальных ядер.
4. МРТ признаки кортикобазальной дегенерации:
• Т1-ВИ:
о Асимметричная атрофия коры больших полушарий:
— Кора задних отделов лобной доли, теменной доли
— ± ножки мозга, покрышка среднего мозга, мозолистое тело
• Т2-ВИ:
о Ассиметричное повышение интенсивности сигнала от субкортикального белого вещества (СКБВ)
о Выраженное снижение интенсивности сигнала от скорлупы, бледных шаров
• FLAIR:
о Асимметричное ↑ интенсивности сигнала от белого вещества лобных и/или теменных долей
— Наиболее часто встречается в более краниальных отделах головного мозга
• МР-спектроскопия
о Значительное ↓ отношения N-ацетиласпартат (NAAj/креатин в полуовальном центре у пациентов по сравнению с контрольной группой
о ↑ отношения NAA/холин в чечевицеобразном ядре и коре теменных долей
• DTI:
о Атрофия кортикоспинальных трактов
о ИКД
— ↑ в двигательных (латеральных) отделах таламусов, прецен-тральной/постцентральной извилинах (ипсилатерально по отношению к коре лобно-теменных отделов) и двустороннее повышение интенсивности сигнала от хвостатых ядер и дополнительной двигательной области (ДДО) коры
о ФА:
— ↓ в прецентральной извилине, ДДО, постцентральной извилине, поясной извилине
5. Радионуклидная диагностика кортикобазальной дегенерации:
• ПЭТ:
о с 18F-ФДГ: снижение поглощения препарата в коре и субкортикальных отделах (лобной, височной, сенсомоторной и теменной ассоциативной коры), хвостатых ядрах, чечевицеобразных ядрах и таламусах
о ПЭТ с 18F-ДОПА: снижение поглощения препарата в скорлупе, хвостатых ядрах
• ОФЭКТ:
о Асимметричная гипоперфузия в коре лобно-теменных отделов, базальных ганглиях (скорлупа), таламусах и полушариях мозжечка
о Зона гипоперфузии расположена контрлатерально по отношению к наиболее пораженной стороне
о Определение связывания DaT (транспортеры дофамина) при ОФЭКТ: ↓ пресинаптического связывания транспортеров дофамина в полосатом теле
о Определение распределения D2 рецепторов методом ОФЭКТ: ограниченное значение, нормальное или слегка сниженное связывание D2 рецепторов
в) Дифференциальная диагностика кортикобазальной дегенерации:
1. Прогрессирующий надъядерный паралич:
• Выраженная атрофия среднего мозга ± моста (симптом «силуэта пингвина»)
• Постуральная неустойчивость, паралич вертикального взора
• Наиболее частый синдром Паркинсон-плюс
• Повышение интенсивности сигнала от субкортикальных отделов полушарий отсутствует
2. Лобно-височная дегенерация:
• Нарушения поведения и расстройство личности
• Двусторонняя атрофия коры лобных, передних отделов височных долей
• Повышение интенсивности сигнала от субкортикальных отделов полушарий не наблюдается
3. Болезнь Альцгеймера:
• Атрофия теменно-височных отделов полушария (энторинальная кора, гиппокампы)
• Выраженные нарушения памяти и когнитивных функций
• Повышение интенсивности сигнала от субкортикальных отделов полушарий не наблюдается
• ПЭТ с определением амилоида: поглощение радиоактивной меченой Питтсбургской субстанции-В (PiB) в коре височно-теменных отделов
4. Деменция с тельцами Леви:
• Легкая диффузная атрофия головного мозга
• Повышение интенсивности сигнала от субкортикальных отделов полушарий не наблюдается
• ПЭТ: гипометаболизм в коре затылочных долей
5. Боковой амиотрофический склероз (БАС):
• Отсутствие значимой атрофии головного мозга
• Аномальное повышение интенсивности сигнала от кортикоспинальных трактов на Т2-ВИ/FLAIR
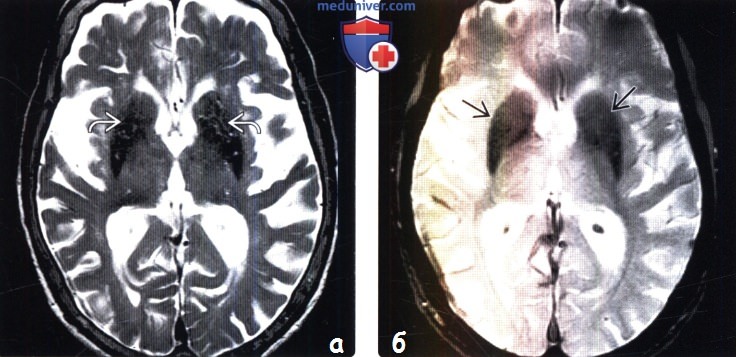
(б) МРТ, Т2* GRE, аксиальный срез: у этого же пациента отмечается выраженная минерализация скорлупы и бледных шаров. У данного пациента с клиническим диагнозом кортикобазальная дегенерация были выявлены прогрессирующее снижение памяти, дистония и миокпония конечностей.
1. Общие характеристики кортикобазальной дегенерации:
• Этиология:
о Накопление гиперфосфорилированного тау-белка
о Характерны аномальные нитчатевидные включения в нейронах, глии
• Генетика:
о Ген тау-белка расположен на 17 хромосоме (13 экзонов)
о Селективная агрегация 4R тау-белка происходит в БД коре больших полушарий
о Тау гаплотип Н1 связан как с КБД, так и с прогрессирующим надъядерным параличом
— Предположительно, аномалии гена тау-белка в 17 хромосоме являются причинами обеих болезней
2. Макроскопические и хирургические особенности:
• Выраженная локальная асимметричная атрофия коры:
о Перироландовая кора (кора задних отделов лобных долей, кора теменных долей)
о Относительная сохранность коры теменных, затылочных долей
• Стриатонигральная дегенерация: атрофия и изменение цвета черной субстанции
3. Микроскопия:
• Основные особенности:
о Локальная потеря нейронов коры, черной субстанции
о Тау-позитивные нейрональные, глиальные очаги поражения
— Бляшки и нитевидные структуры в астроцитах
— В коре, полосатом теле
• Дополнительные особенности:
о Атрофия коры, обычно с поверхностным спонгиозом
о Нейроны по типу воздушных шаров, в основном представленные в атрофически измененной коре
о Тау-позитивные спиралевидные тельца в олигодендроцитах
д) Клиническая картина кортикобазальной дегенерации:
1. Проявления:
• Наиболее частые признаки/симптомы:
о Односторонний или асимметричный паркинсонизм (обычно с нарушением функции руки), дистония, тремор
о Идеомоторная апраксия, феномен «чужой конечности», снижение когнитивных функций
• Другие признаки/симптомы:
о Депрессия, апатия
2. Демография:
• Возраст:
о Обычно 50-70 лет:
— Средний возраст = 63 года
• Пол:
о Половая предрасположенность отсутствует
• Эпидемиология:
о Истинная распространенность неизвестна (но, вероятно, 5-7 на 100000)
о 5% случаев паркинсонизма
4. Лечение кортикобазальной дегенерации:
• Радикальное лечение отсутствует
• Двигательные нарушения: возможен эффект от терапии леводопой и другими допаминергическими препаратами; инъекции ботули-нического токсина при сжиманиях кисти в кулак дистонического характера
е) Диагностическая памятка:
1. Обратите внимание:
• Предполагайте КБД в случае асимметричного паркинсонизма и дисфункции коры
2. Советы по интерпретации изображений:
• Выявленные при МРТ асимметричная атрофия коры головного мозга и ножки мозга могут быть полезными признаками
ж) Список литературы:
1. Booth ТС et al: The role of functional dopamine-transporter SPECT imaging in parkinsonian syndromes, part 2. AJNR AmJ Neuroradiol. 36(2):236-44, 2015
2. Josephs KA: Key emerging issues in progressive supranuclear palsy and corticobasal degeneration. J Neurol. 262(3):783—8, 2015
3. Shimohata T et al: [Criteria for the diagnosis of corticobasal degeneration.] Brain Nerve. 67(4):513-23, 2015
4. Grijalvo-Perez AM et al: Corticobasal degeneration. Semin Neurol. 34(2): 160-73, 2014
Редактор: Искандер Милевски. Дата публикации: 4.5.2019
Кортикобазальная дегенерация
Случай редкого нейродегенеративного заболевания в клинической практике.
Кортикобазальная дегенерация (КБД) – спорадическое дегенеративное заболевание ЦНС, поражающее кору лобной и теменной областей головного мозга, черную субстанцию. Реже поражается стриатум, вентролатеральный таламус, ядра среднего мозга, зубчатые ядра мозжечка, нижние оливы. Основными критериями диагностики КБД являются следующие признаки:
Для постановки диагноза КБД необходимо наличие трёх признаков.
КБД является редкой патологии, плохо знакомой многим врачам-неврологам и терапевтам. С этим связаны трудности в диагностике данного заболевания.
Пациентка М., 72 года.
ЭКГ: Синусовый ритм, тахикардия (ЧСС 96 в минуту) Отклонение ЭОС резко влево. Нарушение межпредсердной проводимости. Блокада передней ветви левой н. п. Гиса. Изменения миокарда левого желудочка
КТ органов грудной клетки: Свежих очаговых и инфильтративных изменений в легких не выявлено. Плевропульмональные спайки нижних долей обоих легких. Атеросклероз брюшной аорты. Коронаросклероз.
МРТ головного мозга: МР картина выраженной дисциркуляторной энцефалопатии. Преимущественно внутренняя атрофическая гидроцефалия.
ЦДС МАГ Атеросклероз внечерепных отделов брахиоцефальных артерий со стенозированием справа – устья подключичной артерии на 20%. S-образные извитости обеих внутренних сонных артерий. 3. Выраженная непрямолинейность хода позвоночных артерий между поперечными отростками шейных позвонков.
Консультация психиатра: Органическое расстройство настроения, обусловленное повреждением и дисфункцией головного мозга или соматическим заболеванием.
Проведённые ранее обследования не выявили причин когнитивных нарушений. В 1-м Неврологическом отделении КБ№1, учитывая клинику акинетико-ригидного синдрома, резистентного к препаратам леводопы, наличие феномена «чужой» руки, фокальной дистонии в конечностях, апраксии ходьбы, выраженных когнитивных нарушений, был поставлен диагноз: Нейродегенеративное заболевание по типу кортикобазальной дегенерации. Синдром нормотензивной гидроцефалии.
На фоне проведенного лечения пациентка стала доступна контакту, передвигается с ходунками несколько шагов, гемодинамика стабильная.
Особенность данного клинического случая – выявление редкой нейродегенеративной патологии (0, 45 на 100 тыс. населения).
Кортикобазальная дегенерация
Кортикобазальная дегенерация — это отдельная клиническая форма избирательного дегенеративного процесса с преимущественным поражением лобно-теменной коры и подкорковых ганглиев. Клинические проявления патологии полиморфны, включают паркинсонизм, расстройство праксиса, тремор, миоклонии, фокальные дистонии, речевые нарушения. Диагностируется кортикобазальная дегенерация по результатам неврологического осмотра, нейропсихологического тестирования, ПЭТ и МРТ головного мозга. Этиопатогенетическая терапия заболевания не разработана, лечение симптоматическое.
МКБ-10
Общие сведения
Кортикобазальная дегенерация (КБД) впервые описана в 1968 году. Заболевание получило название в связи с сочетанием дегенеративных изменений в церебральной коре и базальных (подкорковых) структурах. Наряду с болезнью Альцгеймера, прогрессирующим надъядерным параличом (ПНП), болезнью Пика, мультисистемной атрофией КБД относится к таупатиям, сопровождающимся накоплением тау-протеина в церебральных клетках. Поскольку одним из ведущих клинических симптомокомплексов выступает олигобрадикинезия, в клинической неврологии кортикобазальная дегенерация считается вариантом паркинсонизма-плюс. Точная распространённость КБД неизвестна, отдельные исследования указывают, что патология составляет 0,9% всех случаев паркинсонизма. Пик заболеваемости приходится на возраст 50-60 лет.
Причины
Этиологические факторы возникновения КБД, причины избирательного поражения корково-подкорковых структур не определены. Заболевание имеет спорадический характер, по неподтверждённым данным встречаются единичные семейные случаи. Отдельные исследователи предполагают связь патологического метаболизма отдельных внутриклеточных белков с изменениями в генетическом аппарате нервных клеток. Вероятен полиэтиологический характер развития болезни, при котором совокупное воздействие нескольких этиофакторов приводит к реализации генетически детерминированного нарушения.
Патогенез
Основным патогенетическим механизмом признано нарушение белкового обмена в мозговых тканях. Результатом дисметаболизма является агрегация ряда протеинов внутри нейронов, глиальных клеток. Белковые включения изменяют нормальную жизнедеятельность клеток, возможно, запускают механизм их самоуничтожения (апоптоз). Патологический процесс имеет избирательную локализацию, поражаются преимущественно фронто-париетальные области коры, субстанция нигра, стриатум, вентролатеральное таламическое ядро, зубчатые ядра мозжечка. Макроскопическая картина представлена асимметричными атрофическими процессами указанной локализации. Микроскопически определяется уменьшение числа нервных клеток, демиелинизация волокон, внутринейрональные включения тау-белка. Патогномоничным признаком КБД является наличие в зонах поражения неокрашиваемых баллонообразных нейронов.
Симптомы кортикобазальной дегенерации
Клиническая картина отражает прогрессирующее поражение коры и базальных ганглиев. Последовательность развития и сочетание синдромов могут быть различными, что формирует полиморфизм и значительную вариабельность проявлений. Зачастую первым симптомом становится чувство онемения, неловкости в конечности (чаще в верхней), расстройство в ней сложных типов чувствительности: способности узнавать предметы на ощупь (стереогнозис), различать несколько одновременно воздействующих раздражителей (дискриминационное чувство). Указанные изменения распространяются на ипсилатеральную конечность, затем на противоположную сторону. В половине случаев возникает синдром «чужой» конечности (чаще руки) в сочетании с её непроизвольными движениями.
Симптоматика паркинсонизма присутствует у 100% больных, носит асимметричный характер с преобладанием акинетико-ригидных проявлений. Отмечаются иные экстрапирамидные расстройства: различные формы мышечной дистонии, миоклонии, постуральный тремор, реже — хорея, атетоз. У многих пациентов кортикобазальная дегенерация протекает с типичным тоническим состоянием верхней конечности со сгибанием и приведением плеча, предплечья, кисти и пальцев. В ряде случаев больные вынуждены носить мячик в руке, чтобы предупредить повреждение кисти ногтями резко согнутых пальцев. Глазодвигательные нарушения представлены некоторым ограничением амплитуды движений, явный парез взора наблюдается в 20% случаев. Возможны мозжечковая атаксия, лобные симптомы: паратония, сосательный, хватательный рефлексы.
При дебюте симптоматики в нижней конечности нарушения походки появляются на первом году заболевания, при локализации первых проявлений в руке — спустя 3 года. Определяется лобная дисбазия с частыми падениями. Пирамидная недостаточность ограничивается появлением стопных симптомов, гиперрефлексией. В большинстве случаев возникает дизартрия, имеющая смешанный корково-подкорковый характер, в 20-30% случаев — динамическая афазия. У 85% пациентов отмечается апраксия — нарушение программы последовательного выполнения действий. Интеллектуальное снижение обычно развивается после формирования выраженных двигательных нарушений. При этом известны случаи, когда кортикобазальная дегенерация манифестировала когнитивными расстройствами, и деменция являлась ведущим симптомом болезни.
Осложнения
Обусловленные дисбазией падения больного опасны серьёзным травмированием с ушибами и переломами. В последующем прогрессирующий паркинсонизм и апраксия лишают пациента возможности самообслуживания, являются причиной глубокой инвалидности. Локальные мышечно-тонические нарушения осложняются развитием контрактур. Постепенно утрачивается способность самостоятельно передвигаться. Постоянный постельный режим способствует развитию пролежней и целого ряда инфекционных осложнений: цистита, восходящего пиелонефрита, застойной пневмонии, сепсиса.
Диагностика
Кортикобазальная дегенерация диагностируется на основании следующих клинических критериев: L-ДОФА-резистентный паркинсонизм, апраксия, феномен «чужой» конечности, мышечные дистонии, миоклонии, грубый тремор. Постановка диагноза возможна при наличии трёх признаков из шести. Диагноз достоверно верифицируется по данным патоморфологического исследования церебральных тканей. В ходе диагностического поиска осуществляются следующие исследования:
В дебюте симптоматики кортикобазальная дегенерация требует дифференциации с болезнью Паркинсона, в дальнейшем – с клинически сходными опухолями головного мозга, дегенеративными заболеваниями: болезнью Галлервордена–Шпатца, Пика, Альцгеймера, ПНП, деменцией с тельцами Леви. От болезни Паркинсона КБД отличается наличием корковой симптоматики, нарушений речи, резистентностью к ДОФА-терапии. При ПНП выражена офтальмоплегия, отсутствуют миоклонии и очаговая корковая дисфункция. Болезнь Альцгеймера характеризуется преобладанием атрофических и гипометаболических изменений лобно-височной коры.
Лечение кортикобазальной дегенерации
Возможности лечения КБД ограничены, поскольку этиология заболевания остаётся неясной. Применяется преимущественно симптоматическая терапия. Терапевтическая схема, способная остановить прогрессирование дегенерации, пока отсутствует. Лечение направлено на облегчение состояния пациента, уменьшение выраженности симптоматики. Общепринятой считается комбинированная терапия с включением следующих составляющих:
Прогноз и профилактика
Кортикобазальная дегенерация характеризуется неуклонным прогрессированием неврологических проявлений. В среднем спустя 5 лет когнитивные и двигательные расстройства приковывают больного к постели. Продолжительность жизни большинства пациентов не превышает 10 лет от времени дебюта симптоматики. Причиной летального исхода обычно становится бронхопневмония. Разработка профилактических мероприятий не представляется возможной до момента установления этиологии КБД.
Архив
ВВЕДЕНИЕ
Первое четкое описание кортикобазальной дегенерации (КБД) было представлено Rebeiz et al. в 1968 году, оно касалось трех пациентов с замедленными и обедненными произвольными движениями конечностей, их “одеревенением”, тремором, дистонической позой, мышечной ригидностью, нарушенными навыками и нарушениями походки. Óпомянутые авторы назвали описанный симптомокомплекс “кортикодентонигральной дегенерацией с нейрональной ахромазией”, о чем свидетельствовало наличие асимметричной атрофии коры и потеря нейронов в лобно-теменной области, сопутствующий глиоз и набухание нейрональных тел без субстанции Ниссля. При этом также наблюдалась утрата пигментных нейронов в черном веществе, вовлечение различных подкорковых структур и вторичная дегенерация кортикоспинального пути. В качестве определений данной патологии предлагались различные названия, больше всего среди них прижилось КБД.
ЭПИДЕМИОЛОГИЯ
Как правило, вышеописанное заболевание развивается в возрасте 60–80 лет; в большинстве случаев симптомы появляются в 63 года. Согласно патологоанатомическим данным, минимальный возраст пациента составляет 45 лет. Лица мужского и женского пола заболевают с одинаковой частотой, тем не менее, согласно некоторым метаанализам, женщины поражаются чаще. КБД — типичное спорадическое заболевание, однако в литературе встречаются ссылки на случаи семейной патологии. Неизвестно о какой-либо его взаимосвязи с токсическими или инфекционными факторами.
Хотя данное нейродегенеративное заболевание считается редким, точные данные о его частоте и распространенности не доступны. В последнем популяционном исследовании пациентов с паркинсоническим синдромом не было обнаружено ни одного случая КБД среди 121 628 лиц. По оценкам Togasaki и Tanner, на КБД приходится около 4–6% всех случаев паркинсонизма, ее частота достигает 0,62–0,92 на 100 тыс. лиц в год. Распространенность заболевания достигает 4,9–7,3 на 100 тыс. лиц, а средняя выживаемость — 7,9 года.
КЛИНИЧЕСКАЯ КАРТИНА
В нескольких клиникопатологических исследованиях изучалась клиническая семиотика заболевания, в частности типичные начальные проявления. Эти данные влияют на трактовку двигательных нарушений как атипичного паркинсонизма, учитывая тот факт, что большинство из них происходит из специализированных центров экстрапирамидных нарушений (клинический случай 1). Диагностические критерии КБД в основном были разработаны на основании упомянутых исследований, вместе с тем, вполне вероятно, что когнитивный аспект данной патологии зачастую игнорируется: такие больные часто попадают в нейропсихиатрические либо гериатрические клиники и поэтому данные о них не включаются в обсервационные исследования.
Клинический случай 1
Женщина 69 лет обратилась к неврологу после появления нарушений движения правой рукой в виде неловкости, прогрессирующей на протяжении 1 года. Она описывала свою верхнюю правую конечность как “отмершую”, хотя при объективном обследовании каких-либо признаков чувствительного дефицита обнаружено не было. Пациентка также жаловалась на тремор, ригидность и брадикинезию указанной конечности. Был уставлен диагноз вероятной болезни Паркинсона и назначена леводопа. После достижения суточной дозы препарата 600 мг полугодовое лечение эффекта не принесло. Больная жаловалась на затруднения в движениях и неловкость пораженной конечности, а также ее прогрессирующее сгибательное положение, ассоциировавшееся с болью. Муж пациентки утверждает, что она находится в угнетенном состоянии и начала страдать забывчивостью при выполнении повседневных обязанностей. При повторном обследовании было выялено: усугубление симптомов ригидности и брадикинезии, а также дистония правой руки и миоклония. Апраксию правой конечности оценить было сложно в связи с дистонией и ригидностью, однако на левой руке подобного не наблюдалось. Двухмерно-пространственная чувствительность не нарушена, физиологические рефлексы живые и симметричные, патологических подошвенные рефлексов обнаружено не было, походка медленная, с затягиванием правой ноги. Результаты анализов крови и ликвора — без особенностей. Стандартная МРТ головного мозга — норма. ОФЭКТ с переносчиком дофамина — двухстороннее снижение содержания последнего, преимущественно слева. Нейропсихологическое тестирование свидетельствует о вовлечении лобных и подкорковых структур. На основании вышеописанной симптоматики был установлен клинический диагноз “кортикобазальная дегенерация”. На протяжении последующих 2 лет двигательные нарушения прогрессировали с вовлечением обеих рук и ног, то же касалось ухудшения памяти и эмоциональных нарушений. Больной назначался амантадин в суточной дозе 300 мг, однако это не принесло улучшения. С целью снижения сгибательной фиксации руки использовались инъекции ботулотоксина, приносившие определенное облегчение. Пациентка умерла от пневмонии через 3 года после первых проявлений заболевания.
Начальные проявления
В двух крупномасштабных исследованиях изучались клинические признаки КБД. Rinne et al. описали 5 первичных клинических симптомов, выявленных у 36 пациентов. Чаще всего (в 55% случаев) наблюдался “синдром чужой руки” (вследствие ригидности, дистонии, акинезии либо апраксии), затем — нарушения походки (27%), другие проявления (чувствительные, речевые и поведенческие) наблюдались значительно реже. Wenning et al. описали 14 пациентов с патоморфологически подтвержденным диагнозом заболевания, у которых двигательные нарушения чаще всего являлись первичным симптомом (50%), за которым следовал тремор (21%). Через 3 года после появления первых признаков заболевания чаще всего наблюдались односторонняя ригидность верхней конечности (79%), брадикинезия (71%), идеомоторная апраксия (64%), постуральная нестабильность (45%), односторонняя дистония конечности (43%) и деменция (36%). В крупнейшем клиническом исследовании КБД с участием 147 пациентов, у которых только у 7 заболевание было подтверждено патоморфологически, у всех присутствовал, как минимум, один паркинсонический симптом — ригидность, брадикинезия или тремор, причем у 95% наблюдалось два симптома. Кроме того, у 93% больных имели место признаки поражения коры, например диспраксия, корковые нарушения чувствительности, деменция и дисфазия. Целый ряд других характерных признаков удалось выявить в немногочисленных популяциях, среди них: когнитивный дефицит, поведенческие расстройства, нарушения походки и речи, миоклонии, чувствительный дефицит и депрессия. Определенная асимметричность перечисленных симптомов объясняется тем, что большинство данных получено в специализированных клиниках двигательных нарушений (табл. 1).
Дисфункция конечности (асимметричная)*
Дистония конечности (асимметрическая)
Апраксия (чаще — конечности, нежели орофациальная или открывания век)*
Синдром чужой конечности
Корковые типы нарушений чувствительности
* При КБД имеет место чаще всего.
Неврологические симптомы
Паркинсонизм и дистония
Односторонний характер симптоматики или четкая асимметрия является ведущим признаком двигательных нарушений КБД. Самым распространенным из них является асимметричный паркинсонизм, преимущественно вовлекающий руки. Согласно выводам Kompoliti et al., ригидность относится к самым частым симптомам паркинсонического синдрома при КБД, за ней следуют брадикинезия, нарушения походки и тремор. Частота последнего достигает 6–8 Гц, его характер несколько отличается от постурального тремора или тремора покоя, наблюдающегося при болезни Паркинсона (БП). На него могут наслаиваться фокальные ситуативно-индуцированные миоклонии, в частности на поздних стадиях заболевания, хотя иногда данный симптом является единственным. Нарушения походки проявляются постуральной нестабильностью и частыми падениями, более выраженными в процессе прогрессирования.
Асимметричная дистония конечностей у большинства таких пациентов может присутствовать как в начале заболевания, так и на его конечных стадиях, она часто сопровождается болью. Дистонии нижних конечностей в данном случае развиваются реже, так как чаще всего вовлекаются руки, очень редко можно столкнуться с дистониями головы, шеи и туловища. Довольно часто имеет место формирование так называемого “дистонического кулака” — сжатой кисти с пальцами, согнутыми вокруг большого пальца в положении ладонного приведения.
Корковые нарушения
Среди корковых симптомов у больных КБД чаще всего наблюдается идеомоторная апраксия. С клинической точки зрения ее интерпретировать довольно сложно, особенно в случае сочетания с брадикинезией, ригидностью или дистонией. У большинства пациентов указанный синдром является двусторонним и поэтому более показателен на конечности, не пораженной паркинсонизмом или дистонией. Апраксия при КБД, как правило, проявляется в виде нарушений имитации бессмысленных или символических движений руками, а также при попытках удержать реальные предметы. При апраксии нижних конечностей пациенты испытывают трудности при ходьбе: нога будто „прилипает” к полу в момент начала движения либо ее нужно тащить, в связи с чем больной спотыкается на неровных поверхностях. При данной патологии может наблюдаться также апраксия лицевой области, включая нарушения движений языком и губами.
У лиц с КБД распространенным симптомом корковой дисфункции является “феномен чужой руки”. К другим признакам относятся хватательные и сосательные рефлексы. Больные, как правило, описывают данный феномен следующим образом: “рука будто бы не принадлежит мне, а живет и двигается сама по себе”. При этом пациенты производят хватательные движения верхней конечностью, двигательную активность которой они не контролируют, и, сами не осознавая того, захватывают другие части своего тела, элементы окружающей обстановки и даже детали одежды людей, находящихся рядом. Типичным является конфликт между пораженной и непораженной руками, когда больная рука препятствует произвольным движениям здоровой. Иногда наблюдается “феномен чужой ноги”, который проявляется в виде ее поднимания в положении сидя.
С вышеописанными расстройствами сосуществуют корковые нарушения чувствительности — онемение, покалывание или “одеревенение” конечности. По мере прогрессирования болезни часто сохранная поверхностная чувствительность сосуществует с нарушениями дискриминационной и двухмерно-пространственной чувствительности и стереогноза.
Когнитивные нарушения и деменция
Несмотря на то что ранее считалось, что когнитивные нарушения при КБД встречаются редко, последние исследования свидетельствуют, что их частота достаточно высокая в указанной популяции больных, а деменция может выступать ведущим синдромом. Данные состояния зачастую становятся причинами неверной постановки диагноза, поскольку таких пациентов, как правило, впервые обследуют вне специализированных клиник двигательных нарушений.
Диапазон когнитивных нарушений при КБД являлся предметом детального исследования Graham et al. Особенно частыми, согласно их наблюдениям, являются нарушения плавности речи. Так, метаанализ результатов 42 исследований (399 пациентов) засвидетельствовал, что афазия наблюдалась у 34% лиц с клиническим и 44% больных с патоморфологическим подтвержденным диагнозом. Также довольно часто имеет место нарушение исполнительных функций, что связано с лобной долей, и сложности со счетом и пространственным восприятием, касающиеся теменной зоны коры. Что касается симптомов поражения височной доли, то, например, у таких больных семантическая память, как правило, сохранна, а эпизодическое снижение памяти не такое выраженное, как при болезни Альцгеймера. В свете вышесказанного формальная оценка когнитивных функций является информативным элементом общего клинического обследования пациента с КБД.
Особую сложность при диагностике представляет группа больных вышеуказанным заболеванием, у которых в клинической картине присутствует только когнитивный дефицит или же явная деменция. У некоторых из них в дальнейшем появятся сопутствующие двигательные нарушения, у других — когнитивные расстройства останутся единственным проявлением. Такое состояние довольно сложно отличить от прогрессирующей афазии на фоне лобно-височной дегенерации или поведенческих нарушений, которыми сопровождаются определенные подтипы лобно-височной деменции (ЛВД) (клинический случай 2). Хотя наличие ЛВД или “комплекса Пика” как отдельной нозологической единицы остается спорным вопросом, КБД необходимо учитывать при дифференциальной диагностике у всех больных с лобной деменцией, осложненной афазией. Это касается как таупатий (ЛВД и паркинсонизм, связанные с 17 хромосомой, прогрессирующий надъядерный паралич [ПНП]), так и других заболеваний (убиквитин-положительная, тау-отрицательная болезнь с тельцами включений).
Клинический случай 2
Мужчина 65 лет, правша, с проблемами в вербальном контакте с окружающими на протяжении последних 3 лет, обратился к неврологу. Первыми симптомами являлись сложности в произношении некоторых слов. Нарушения неуклонно прогрессировали, однако пациент мог безопасно управлять автомобилем, ездить по привычным и новым маршрутам и обслуживать сам себя в домашних условиях. Вследствие коммуникативных проблем ему пришлось расстаться со своим хобби спортивного судьи. Появилась определенная ригидность, однако без признаков расторможенности или изменений пищевого поведения. У членов семьи пациента неврологических заболеваний не отмечалось, анамнез жизни и болезни не отягощен. Результаты неврологического обследования — без особенностей, за исключением выраженных трудностей с речью, орофациальной диспраксии, лобных симптомов с персеверациями, что подтвердилось при формальном нейропсихологическом тестировании. Также не отмечалось апраксии конечностей, миоклоний и синдрома чужой руки. Через год экспрессивность речи значительно ухудшилась — можно было различить только отдельные слова. Появились также другие признаки вовлечения лобных долей без асимметричной апраксии конечностей или миоклоний. На МРТ отмечалась умеренная асимметричная лобно-височная атрофия, преимущественно слева; анализы крови и ликвора — без особенностей. Была заподозрена болезнь Пика. К концу того же года у пациента произошел инсульт и он умер в возрасте 67 лет. При патоморфологическом исследовании подтвердился диагноз “кортикобазальная дегенерация”.
Психиатрические симптомы
Помимо деменции, распространенными психиатрическими проявлениями КБД являются депрессия (73%), апатия (40%), раздражительность (20%) и возбуждение (20%). Среди других признаков, упоминающихся в литературе, — тревожность, расторможенность, бред, обсессивно-компульсивный синдром, проявляющийся в виде наплывов мыслей, навязчивых действий, контролирующего поведения и перфекционизма. Перекрывание вышеуказанных симптомов с признаками когнитивного дефицита вследствие вовлечения лобных долей достаточно вероятно.
Другие клинические признаки
Глазодвигательные нарушения помогают в дифференциальной диагностике. Наиболее частой их разновидностью, связанной с КБД, являются затрудненные и замедленные саккады, которые после инициации характеризуются нормальной скоростью и диапазоном. Самым неблагоприятным глазодвигательным нарушением являются неадекватные горизонтальные саккады при сохранении вертикальных — это, хоть и не всегда, помогает в дифференциальной диагностике с ПНП.
В литературе встречаются единичные упоминания о других клинических проявлениях болезни, включая псевдосиндром Балинта, пирамидные нарушения, мозжечковые симптомы, боль и дисфагию.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА: ПСЕВДОСИНДРОМЫ КОРТИКОБАЗАЛЬНОЙ ДЕГЕНЕРАЦИИ
Клинический диагноз КБД достаточно сложный по причине сходства с другими нейродегенеративными заболеваниями. Несмотря на высокую точность (почти 100%), при первом визите его чувствительность составляет 35%, при последнем — около 48%. Среди всех патологий, которые путают с упомянутой болезнью, возможно, сложнее всего отдифференцировать ПНП. Хотя у таких пациентов ведущими симптомами являются аксиальная ригидность, постуральная нестабильность и патологические вертикальные движения глаз, иногда у них наблюдаются атипичные начальные симптомы — асимметрия, незначительные глазодвигательные нарушения, фокальная дистония и непроизвольные движения конечностей, напоминающие “синдром чужой руки”. Такое клиническое сходство объясняется патоморфологической близостью ПНП и КБД в рамках таупатий.
Поскольку последняя проявляется преимущественно деменцией, она может представлять диагностические сложности при различных когнитивных нарушениях, особенно это касается таких состояний, как прогрессирующая афазия или ЛВД. Другими синдромами, подобными КБД, являются ХП, мультисистемная атрофия, болезнь Вильсона, прогрессирующий подкорковый глиоз, акинетико-ригидный вариант болезни Гантингтона, атипичные формы болезни Пика, комплекс “паркинсонизм-БАС-деменция”, суданофильная лейкодистрофия и болезнь нейрофиламентных включений.
ДИАГНОСТИЧЕСКИЕ МЕТОДИКИ
Нейровизуализационное и электрофизиологическое обследование
Результаты рутинных лабораторных исследований крови, мочи и ликвора при КБД, как правило, соответствуют норме. КТ и МРТ-картина головного мозга также остаются без изменений на ранних стадиях заболевания. В процессе его прогрессирования становится очевидной асимметричная атрофия задних отделов и лобных и теменных долей коры, а также расширение боковых желудочков.
ЭЭГ на ранних стадиях болезни также нормальная, хотя со временем появляется асимметричное замедление волн, наиболее выраженное в полушарии, контралатеральном относительно пораженной конечности. Исследования нервной проводимости, нейромиография и вызванные потенциалы не свидетельствуют о какой-либо патологии.
Для дифференциальной диагностики КБД используется функциональная нейровизуализация. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) с дофаминовым переносчиком, как правило, свидетельствует о нетипичной картине и помогает различить болезнь Альцгеймера и Пика даже на начальных стадиях, однако это не касается идиопатической ХП или ПНП. Результаты ПЭТ и ОФЭКТ у пациентов с клинически четким диагнозом свидетельствуют об асимметричном снижении метаболизма глюкозы в покое и замедлении кровотока в задних лобных, нижних теменных и верхних височных долях, а также в таламусе и стриатуме (что не характерно для первичного паркинсонизма и определенных синдромов паркинсонизма-плюс). Новые методики нейровизуализации являются достаточно перспективными: ПЭТ-сканирование микроглиальной активности с применением в качестве лиганда РК11195 позволяет обнаружить асимметрию базальных ганглиев и корковую активацию при КБД. Диагностическая ценность данного метода требует дальнейших исследований.
Гистопатология
Принимая во внимание неоднозначность клинических диагностических критериев заболевания, для точного подтверждения его наличия необходимо патоморфологическое исследование. При этом чаще всего обнаруживается атрофия околороландовой зоны с вовлечением задней лобной и теменной коры при относительной сохранности височных и затылочных долей. Наиболее выраженные патологические изменения касаются двигательных и чувствительных проекционных зон с вторичной дегенерацией кортико-спинальных трактов. Атрофия коры, как правило, асимметричная и более заметная на стороне, противоположной пораженной конечности. Иногда наблюдается относительно симметричное поражение лобно-височных долей, особенно если ведущими проявлениями выступают деменция и афазия. Микроскопическая картина свидетельствует о разрушении цитоархитектоники, исчезновении корковых слоев и об интенсивном фибриллярном глиозе. Четкие признаки атрофии и утраты нейронов с сопутствующим глиозом и исчезновением пигментных клеток затрагивают также латеральные 2/3 черной субстанции.
Очень характерны для КБД большие бледные нейроны (“нейрональная ахромазия”, согласно описанию Rebeiz et al.). Чаще всего поражаются средние и крупные пирамидные клетки 3, 5 и 6 слоев коры. Их ядра располагаются эксцентрически, субстанция Ниссля отсутствует, что отличает данный тип дегенерации от центрального хроматолиза. В цитоплазме присутствуют интенсивно окрашенные фосфорилированные нейрофиламенты и бета-кристаллин. Наличие таких “раздутых” нейронов считается специфическим патоморфологическим признаком КБД и болезни Пика, хотя иногда они обнаруживаются и при ПНП, болезни Альцгеймера, ЛВД и болезни Кройцфельдта-Якоба. Следовательно, ключом к диагностике является характер распределения и количество подобных клеток, а также ультраструктурные паттерны нейрофиламентов. Другие авторы подчеркивают важность астроцитарных бляшек для подтверждения диагноза КБД.
Молекулярная патология
КБД относится к нейродегенеративным заболеваниям, характеризующимся накоплением надфосфорилированного тау-белка с формированием патологических филаментных включений в нейронах и глии (табл. 2). Ген, кодирующий данную патологию, находится в 17 хромосоме и состоит из 13 экзонов. КБД и ПНП характеризуются подобным паттерном тау-экспресии при электрофорезе. При первом из указанных заболеваний данный белок формирует парные спиральные филаменты. Следовательно, таупатия с вовлечением долей коры и базальных ганглиев заметно отличается, при этом имеет место избирательное накопление четырех белковых повторяющихся участков со специфическими антигенными и ультраструктурными признаками.
ЛВД и паркинсонизм, сопряженные с 17 хромосомой