костный мозг бедренной кости
Костный мозг бедренной кости
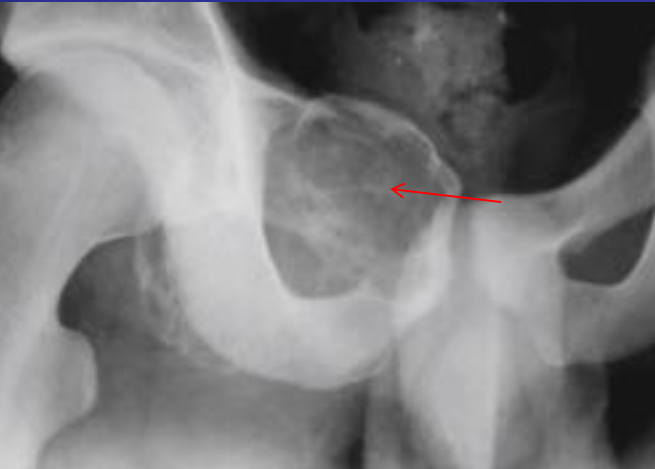
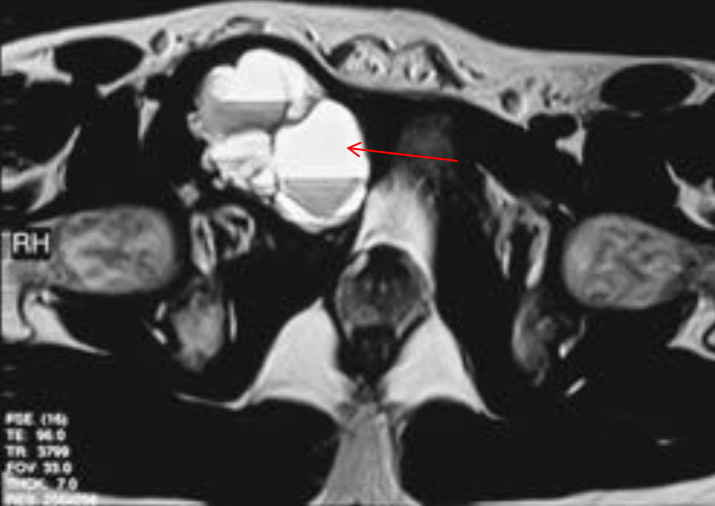
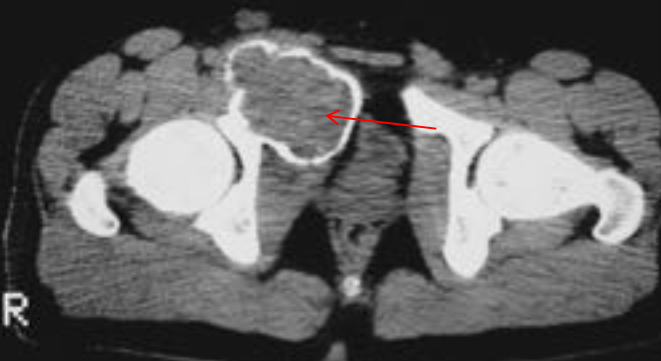
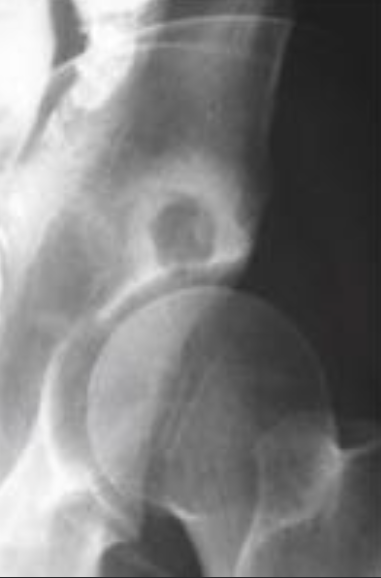
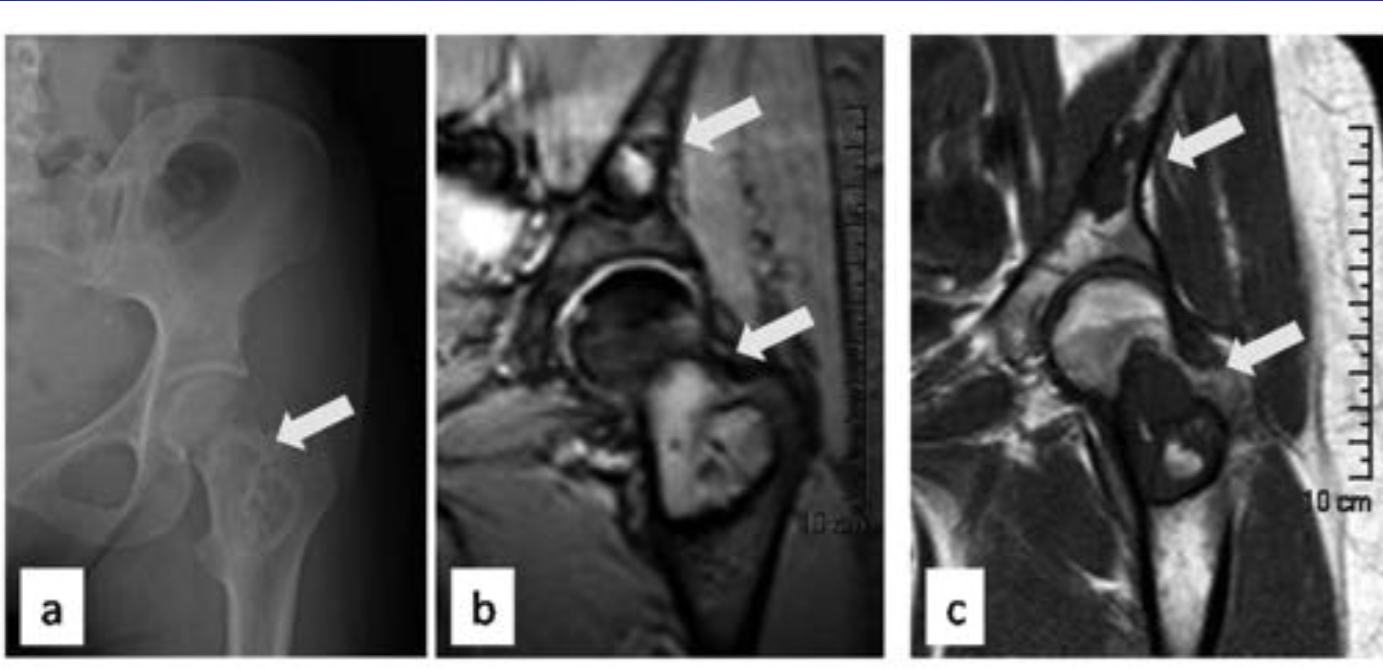
Остеохондропатия головки бедренной кости (болезнь Пертеса—Легга—Кальве)
Заболевание выделено как самостоятельное A. Legg (1909), G. Perthes (1910), J. Calve (1916), и с тех пор его называют именами данных авторов. Среди всех остеохондропатий оно составляет от 0,17 до 17% [Шапиро М. Н., Цыпкин Б. Н., 1935; Низовская М. М., Грацианский В. П., 1940], а среди заболеваний суставов — до 25,3% [Крылова М. Д., 1966].
ЭТИОЛОГИЯ.
Причины возникновения асептического некроза эпифиза головки бедренной кости у детей остаются невыясненными, но продолжают обсуждаться инфекционная, травматическая, обменно-гормональная и наследственная теории, однако ни одно не имеет убедительных доказательств.
ПАТОГЕНЕЗ.
Поскольку заболевание относят к аваскулярной природе, особый интерес представляют ранние изменения в капсуле сустава и ее сосудах. А. Л. Капитанаки (1964) в капсуле тазобедренного сустава при остеохондропатии обнаружил скопление плазматических клеток, P. Mass (1957) выявил периваскулярную инфильтрацию лимфоцитами и плазматическими клетками, а Г. Г. Спиридонов (1959) в сосудах фиброзного слоя капсулы и прилегающей клетчатки обнаружил утолщение стенки сосуда с сужением его просвета. Такие изменения в капсуле напоминают аллергическое воспаление и, очевидно, относятся к начальным признакам остеохондропатии.
Выявляемое радиоизотопным исследованием нарушение кровообращения во всей пораженной конечности и расстройства микроциркуляции в виде застойных явлений в капиллярах ногтевого лимба пальцев стопы, их расширение и извилистость, замедление кровотока, застойный синюшный фон могут при болезни Легга—Кальве—Пертеса носить вторичный характер [В. М. Гартаницкая, 1973; Семенов В. А., Абальмасова Е. А., Крюкова Н. Н., 1972].
При микроскопическом исследовании бедренной кости в начальной стадии остеонекроза R. Mattner (1968) выявил некроз ядер остеоцитов, некроз костного мозга в субхондральных зонах, участки детрита в эпифизарном хряще. В. А. Штурм (1935) провел подробное макро- и микроскопическое исследование тазобедренного сустава мальчика 11 лет с III—IV стадией болезни Пертеса. Макроскопически выявлено, что при надавливании хрящ головки сдавливается и сплющивает размягченную под ним кость. Аналогичное размягчение кости выявляется в параэпифизарной зоне шейки бедра, где эпифиз, как колпачок, надет на шейку. Укорочение и расширение шейки бедра, грибовидная головка, возможно, образуются в результате этого оседания эпифиза. Костные балки эпифиза некротизированы и размягчены, напоминают губку. Некроз костных балок с жировым костным мозгом, бедным клеточными элементами, выявляется в эпифизе, шейке бедра и в меньшей степени в крыше суставной впадины и большом вертеле. В. А. Штурм на основании распространенности процесса рассматривал болезнь Пертеса как «остеохондропатию тазобедренного сустава», а не только эпифиза головки бедренной кости. Патологический процесс при этом носит характер глубокой дистрофии с некрозом губчатой кости, отчасти и хряща, особенно в зоне эпифизарного окостенения, с некрозом костного мозга [Штурм В. А., 1935; Шаиро Э. И., 1970; Ponseti J., 1956].
КЛИНИЧЕСКАЯ КАРТИНА.
Остеохондропатия головки бедренной кости возникает у детей в возрасте 5—10 лет, но возможны случаи заболевания в более раннем и более позднем возрасте. Как правило, поражается один, чаще правый, сустав, но при этом нередко меньшая степень остеохондропатических изменений выявляется и в другом суставе, которые могут подвергаться обратному развитию, не проходя всех стадий. Типичный двусторонний процесс встречается в 7—10% случаен, но, как правило, он развивается не одновременно [Капитанами A. Л., 1964]. Мальчики заболевают в 4—5 раз чаще девочек.
Клиника болезни Пертеса описана многими авторами, но до сих пор поздняя диагностика встречается нередко. Основной причиной поздней диагностики заболевания является слабая выраженность симптомов, продолжительные периоды безболезненного течения после появления и исчезновения первых болей.
Самыми ранними и частыми признаками болезни Пертеса являются боль и хромота. Однако в определенном проценте случаев боль отсутствует. Локализация болей непостоянная: у 65,9% больных она возникает в области тазобедренного сустава, у 12,4% больных — в коленном суставе, у 10,6% —во всей нижней конечности [Капитанаки А. Л., 1964]. Иногда дети жалуются на чувство стягивания в области большого вертела, где определяется выраженный, плотный, ограниченный отек.
Хромота в начале заболевания может быть результатом боли и контрактуры сустава, а позже следствием снижения высоты эпифиза, легкого подвывиха бедра и слабости ягодичных мышц. Наиболее часто при болезни Пертеса наблюдается ограничение внутренней ротации бедра — у 87,7—91,2% детей, несколько реже — ограничение наружной ротации сгибания — у 35,9%, приведения — у 30,9%. У 55% детей формируется сгибательная и наружно-ротационная контрактура [Капитанаки А. Л., 1964; Лимин А. Л., Хвисюк Н. И., 1970].
Атрофия мышц относится к ранним и постоянным симптомам; она более всего заметна в области ягодичных мышц и мышц бедра. В ряде случаев на фоне лимфостаза, утолщения кожи и подкожной клетчатки она может быть малозаметной. Симптом Александрова, как правило, бывает положительным. Могут иметь место выраженные вегетативно-сосудистые расстройства, которые более заметны при одностороннем процессе. К ним относятся бледность и похолодание стопы, снижение температуры конечности на 0,5—2°С, меньшая выраженность капиллярного пульса в области пальцев стопы, морщинистая кожа подошвы (кожа прачки), замедление биологической и гидрофильной проб, асимметрия реакции потоотделения по Минору, нарушения кровообращения во всей конечности в сравнении со здоровой, выявляемое при радиоизотопном исследовании [Гортаницкая В. М., 1973; Семенов В. А., Абальмасова Е. А., Крюкова Н. Н., 1974].
Острое начало болезни Пертеса встречается в 0,4—6% случаев, с подъемом температуры и воспалительным сдвигом в крови [Королев В. А., 1964; Фурдюк В. В., 1976; Mass P., 1962]. Однако и у детей с обычным течением нередко наблюдается субфибрильная температура, повышение СОЭ до 23—34 мм/ч, лейкоцитов до 109/л, лимфоцитов до 45—54% [Макушин В. Д., 1963; Абальмасова Е. А., Крюкова Н. Н., 1979].
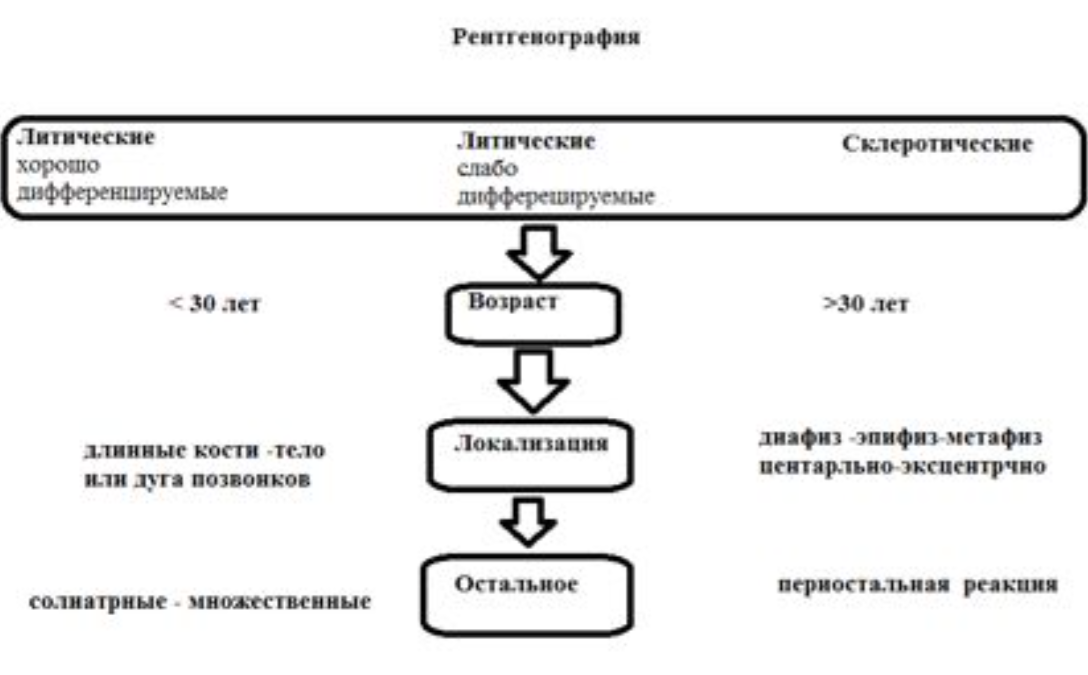
РЕНТГЕНОЛОГИЧЕСКИЕ ПРИЗНАКИ.
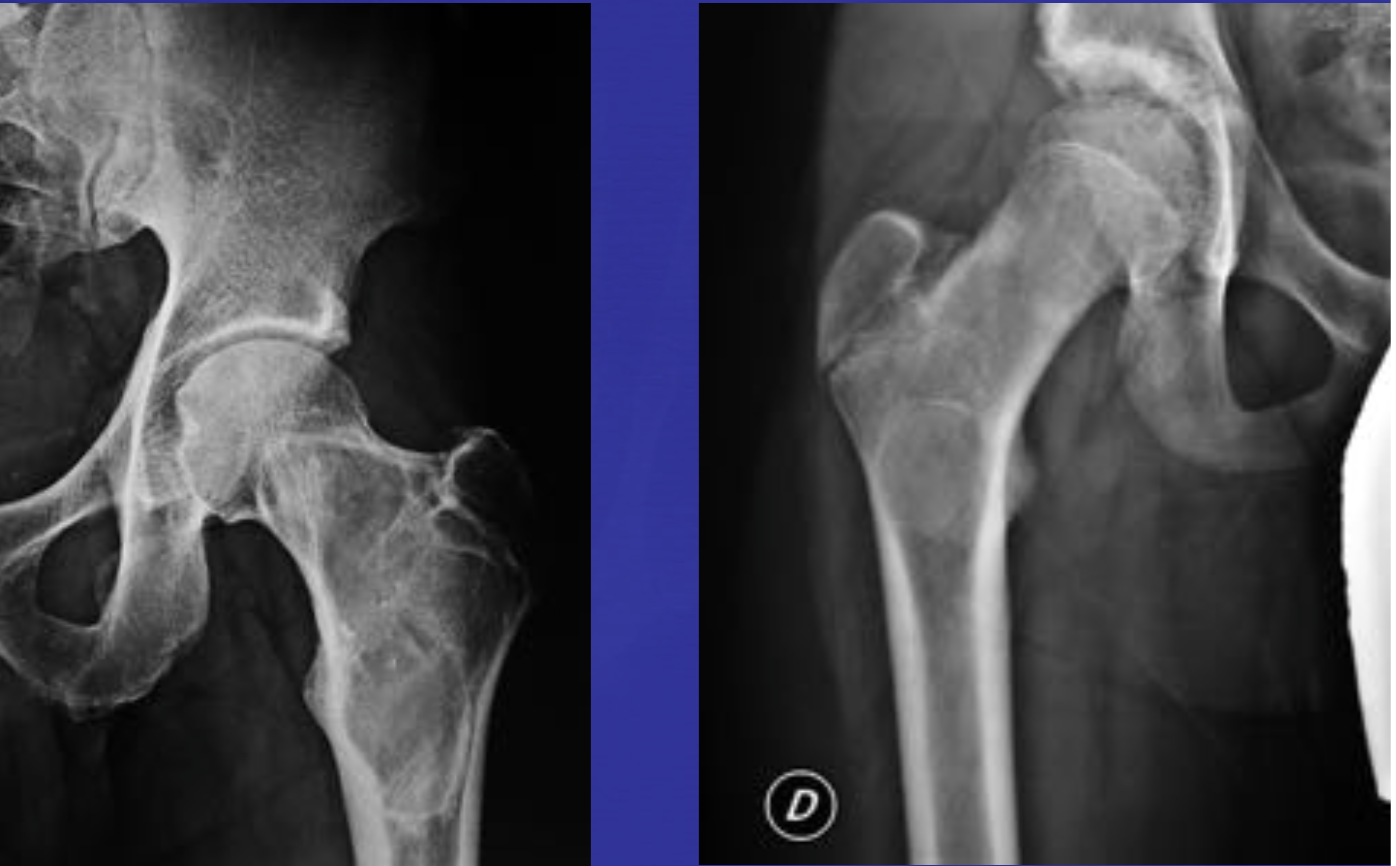
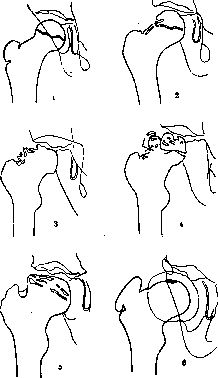
В течении остеохондропатии головки бедренной кости у детей различают пять последовательно развивающихся стадий, каждой из которых свойственны свои патоморфологические и рентгенологические особенности. I, начальная, стадия характеризуется некрозом губчатой кости эпифиза и костного мозга, II стадия — импрессионным переломом, III стадия — фрагментацией эпифиза, IV стадия — репарацией, V стадия — окончательным восстановлением кости.
Наибольшие трудности в рентгенологической диагностике испытывают именно при начальной (I) стадии заболевания. Поэтому для диагностики данной стадии различают три группы признаков: изменения в мягких тканях (капсуле и мышцах), проекционные изменения в костях таза и тазобедренного сустава, прямые признаки заболевания.
Проекционные признаки можно выявить лишь при условии правильной симметричной укладки больного и рентгенографии костей таза и обоих суставов. К этим признакам относят разную проекцию крыла подвздошной кости, запирательного отверстия справа и слева [Петухова Л. И., Волкова В. В.], расширение фигуры слезы [Halkier, 1956].
В качестве ранних косвенных признаков болезни Пертеса предложены рентгенометрические: смещение крестца в здоровую сторону; изменение формы линии Шентона из дугообразной в квадратную; увеличение эпифизарно-диафизарного угла Альсберга; увеличение угла, образованного пересечением оси бедра с плоскостью входа в суставную впадину; уменьшение угла, образованного пересечением линии Хильгенрейнера с продолжением линии эпифизарного хряща; смещение вершины и увеличение угла, образованного пересечением сагиттальной оси таза с продолжением плоскости входа в суставную впадину [Абальмасова Е. А., Крюкова И. Н., 1979].
В конце I стадии в параэпифизарной зоне шейки бедренной кости могут выявляться очаги деструкции, в области которых позже формируются кистевидные просветления; шейка укорачивается, становится шире. Первая стадия продолжается до 6 мес [Рейнберг С. А., 1964].
Во II стадии — импрессионного перелома, при которой некротические костные балки, теряя прочность под влиянием статической и динамической нагрузки, надламываются и импрессируются. Рентгенологически в этой стадии тень эпифиза уплотняется; структура его утрачивается, а высота снижается, суставная щель соответственно расширяется. Начиная с этой стации диагностика заболевания не представляет затруднений. II стадия продолжается от 3 до 6—8 мес.
В III стадии фрагментации эпифиза, при которой происходит реваскуляризация эпифиза со стороны надкостницы шейки бедренной кости, хряща головки, губчатой кости шейки. В глубь некротической кости эпифиза врастает соединительная ткань, а вместе с ней и сосуды. Они разделяют головку на отдельные фрагменты, а в шейке образуются кисты различных размеров. Эта стадия продолжается от 1 до 1,5 лет. Одновременно за рассасыванием старой кости следует процесс образования новой кости, который идет активнее с внутренней стороны, а в центре головки могут длительно сохраняться плотные секвестроподобные тени.
В IV стадии — репарации; при ней секвестроподобные тени исчезают, эпифиз полностью замещается новообразованной костью с участками просветления в центре.
В V стадии — конечной, соответствующей восстановлению формы головки и структуры, характерной для зрелой кости. Восстановление головки может быть двояким; при благоприятных исходах высота эпифиза головки приближается к его высоте в нормальном суставе. Однако при самых идеальных исходах высота головки восстанавливается не боле чем па 85%. При менее благоприятных исходах головка имеет грибовидную форму; она на 30—70% не перекрывается впадиной, у 75% больных впадина уплощается и вытягивается кверху [Редулеску А., 1967]. Шейка бедренной кости укорачивается и расширяется. В этих случаях может формироваться подвывих бедра.
У детей с подвывихом создаются условия к раннему развитию деформирующего артроза, который В. М. Ермолаев и П. Д. Мицкевич наблюдали уже у больных в возрасте 15—20 лет. М. Д. Крылова (1971) описала локализованную форму остеохондропатии в верхне-наружном квадранте головки, а А. Л. Лимин, Н. И. Хвисюк (1970) в 19% наблюдали субкапитальную форму — с более благоприятным течением.
ЛЕЧЕНИЕ.
Комплексное консервативное лечение болезни Пертеса предусматривает прежде всего полную разгрузку конечности, улучшение и восстановление кровообращения в области тазобедренного сустава и в пораженной конечности, стимулирование процессов рассасывания некротической костной ткани и следующих за ним процессов новообразования, сохранение функции сустава, поддержание физиологического тонуса мышц конечности и общего мышечного тонуса.
Полную разгрузку конечности следует назначать немедленно, как только поставлен диагноз. Разгрузка конечности предупреждает дальнейшее снижение высоты эпифиза, последующее восстановление которого происходит только в пределах исходной высоты. В процессе лечения никакими средствами невозможно увеличить высоту уплощенного эпифиза.
С целью разгрузки используют вытяжение манжетой за голеностопный сустав или шинно-гильзовый тутор, обычно туго фиксированный на бедре и голени. При атрофии мышц и распространенных вегетативно-сосудистых нарушениях во всей конечности (прежде всего выраженных застойных явлениях в венозном русле) такие виды вытяжения следует считать нерациональными и даже вредными.
Широкое применение нашла гипсовая кроватка и глухая гипсовая повязка, лечение в которых каждые 3—4 мес чередуют с функциональным восстановительным лечением или скелетным вытяжением [Somervill Е., 19711. М. Harrison и М. Меnon (1966), изучив результаты лечения болезни Пертеса всеми существующими методами, нашли, что наилучшим оказался метод фиксации бедер туторами с внутренней ротацией и умеренным отведением. При этом методе головка бедренной кости центрируется в суставной впадине, а фиксированное отведение бедер уменьшает давление на пораженную головку; при этом методе также сохраняется подвижность в тазобедренных и голеностопных суставах.
Общую гимнастику для верхних и нижних конечностей (исключая пораженную конечность), мышц спины и брюшной стенки начинают проводить с I стадии и продолжают постоянно. В это время ребенка заставляют производить активные сокращения ягодичных и четырехглавой мышц на больной стороне, активные движения в голеностопном суставе. В III стадии детям разрешают присаживаться, им проводят легкие пассивные движения в тазобедренном и коленном суставах. С IV стадии подключают активные упражнения для пораженного тазобедренного сустава. Указанный ортопедический режим следует сохранять до стадии восстановления головки бедренной кости. С восстановлением структуры головки и шейки, свойственной зрелой кости, в положении лежа используют упор на пружинных приспособлениях (ходьба лежа), вращение на стационарном велосипеде, легкую опору на конечность во время ходьбы па костылях.
Полную нагрузку на конечность разрешают лишь после того, как на двух последних рентгенограммах, сделанных с интервалом в 2—3 мес после указанного выше подготовительного лечения, структура головки и шейки бедренной кости остается неизменной.
Нагрузку на конечность без костылей в первый год после окончания лечения увеличивают постепенно, полностью исключая прыжки, переходы на большие расстояния, подъем тяжести, приседания. В это время рационально использовать прогулки па велосипеде, плавание. В дальнейшем перенесшим болезнь Пертеса лицам необходимо избегать чрезмерных нагрузок на сустав, систематически проводить утреннюю гимнастику, преимущественно лежа, полностью исключая упражнения приседания; для них полезно пребывание на море в летнее время и плавание в бассейне — в зимнее. Эти меры необходимы для предупреждения развития раннего деформирующего артроза в тазобедренном суставе. Массаж пораженной конечности проводят во всех стадиях заболевания с перерывами на 3—4 нед; он направлен прежде всего на устранение застойных явлений в лимфатической и венозной системах конечности и улучшение активного кровообращения.
Медикаментозные средства в комплексном лечении болезни Пертеса занимают важное место, обеспечивая прежде всего нормализацию кровообращения в пораженной конечности, стимулирование процессов рассасывания и регенерации. Учитывая преобладание спастического типа кровообращения, в качестве сосудорасширяющих средств используют никотиновую и аскорбиновую кислоту, но-шпу, никошпан, депо-падутин и др. Наибольший сосудорасширяющий эффект у детей получен от никотиновой и аскорбиновой кислоты, что подтверждено капилляроскопией. Поэтому со II до V стадии следует применять указанные средства, чередуя их и делая перерывы на 1—1,5 мес. На протяжении всего периода лечения детям дают комплексы витаминов. Л. А. Смирнова и Е. А. Вишневецкая (1976) с целью стимулирования остеогенеза применяли повторные курсы инъекции витамина В12, который, являясь неврогенным стимулятором, способствует нормализации и вегетативно-сосудистых функций; применяют парафин, озокерит (t 35—38°С), грязевые аппликации, горячие ванны и укутывания. Однако при венозном застое, что характерно для I стадии, эти средства лишь увеличивают застойные явления, что подтверждено данными капилляроскопии [Абальмасова Е. А., Крюкова Н. Н., 1979].
Указанные тепловые процедуры наиболее рационально назначать в стадии фрагментации, репарации и окончательного восстановления.
В стадии импрессионного перелома, особенно в стадии фрагментации, рационально использовать алоэ, ФиБС, стекловидное тело, электрофорез с препаратами, содержащими йод, что ускоряет рассасывание некротической кости [Волков В, В., Ковальская О. А., Шифрис А. Ш., 1965], диатермию, УВЧ, а в стадиях восстановления — электрофорез с хлоридом кальция и препаратами, содержащими фосфор. Как указывают В. И. Рокитянский (1962), А. Н. Рыжих (1966), А. С. Мартене (1967), электрофорез с йодидом кальция ускоряет восстановление костной ткани, а ультразвук активирует рассасывание некротической костной ткани.
Все указанные лечебные средства у детей с болезнью Пертеса применяют на фоне общеукрепляющего лечения (поливитамин, рыбий жир, глюконат кальция, апилак, гелио- и аэротерапия, питание богатое белками и витаминами).
Результаты консервативного лечения.
Общая продолжительность консервативного лечения, но данным различных авторов, колеблется от 2—3 до 4—6 лет [Рейнберг С. А., 1925; Крылова М. Д., 1971; Приезжева В. Н., 1971; Somervill E., 1971]. Продолжительность и результаты лечения находятся в прямой зависимости от возраста детей к началу заболевания и от стадии болезни к началу лечения. Чем меньше возраст ребенка и чем раньше начато лечение, тем быстрее и полноценнее завершается процесс восстановления головки бедра.
В оценке результатов лечения болезни Пертеса используют преимущественно трехбалльную систему, которая является довольно субъективной. Так, по данным Н. Waldenstrom (1922), отличные функциональные исходы получены у 62% детей, хорошие — у 25% детей, удовлетворительные — у 13%. Рентгенологически у этих же больных хорошие исходы определены только у 30% детей, удовлетворительные — у 54%, плохие — у 16% детей. Как указывает автор, остеохондропатический процесс лишь в редких случаях не оставляет последствий и поэтому нельзя рассчитывать на хорошие исходы самоизлечения. И. М. Шаматов и В. В. Синев (1966) подтверждают это: из наблюдаемых ими 28 детей с болезнью Пертеса, из которых 22 ребенка лечения не получали, в отдаленные сроки (до 9—30 лет) у 14 была выраженная хромота и симптом Тренделенбурга, у 22 — укорочение бедра, диффузная атрофия мышц (на 2—4 см), ограничение отведения и особенно внутренней ротации бедра. Ограничение сгибания и разгибания в тазобедренном суставе имелось у всех больных. На рентгенограмме у всех больных головка была грибовидной формы, а у 13 края ее выступали за край впадины. Эти данные убедительно подтверждают необходимость систематического лечения болезни Пертеса у детей. А. Л. Капитанаки (1963) из 95 детей, у которых лечение начато своевременно, хорошие результаты получил у 80, а из 40 детей, которым лечение начато поздно, такие результаты наблюдались только у 16.
К хирургическому лечению остеохондропатии головки бедренной кости прибегают сравнительно редко. Оно направлено на ускорение реваскуляризации эпифиза головки и сокращение сроков лечения. Однако А. Л. Капитанаки (1963) считает хирургическое лечение показанным в случаях замедленного рассасывания некротических костных балок эпифиза, что может быть выявлено не ранее чем через 1—1,5 года от начала болезни, а Э. И. Шаиро (1970) рекомендует его во всех случаях в стадии импрессионного перелома.
Предложены различные хирургические методы лечения болезни Пертеса: чрезвертельная остеотомия бедра [Козловский А. А., 1924], транстрохантерно-цервикальный остеосинтез [Fergusson A., 1955; Howorth M., 1966], туннелизация шейки и эпифиза бедра спицей Киршнера при затянувшейся III стадии. В качестве постоянного раздражителя для реваскуляризации и костеобразования используют алло- и ксенотрансплантаты, свободный аутотрансплантат, аутотрансплантат на питающей ножке [Шаиро Э. И., 1970]. Небольшое число наблюдений каждого из перечисленных методов у отдельных авторов не позволяет дать им объективную оценку. А. Л. Капитанаки отметил ускорение реваскуляризации эпифиза головки бедра у 8 из 9 больных после туннелизации и у одного из трех — после межвертельной остеотомии бедра. Э. И. Шапиро (1970) при введении в шейку и эпифиз бедра аутотрансплантанта на питающей сосудистой ножке отметил сокращение сроков восстановления эпифиза головки бедра. В экспериментальных исследованиях получены морфологические доказательства проникновения сосудов через питающую надкостнично-мышечную ножку трансплантата в шейку и эпифиз бедра.
После чрезвертельной остеотомии развивается остеопороз в проксимальном отделе бедра, который сохраняется длительное время, но последующего ускорения восстановительных процессов и улучшения исходов не установлено. Гомотрансплантат, введенный в шейку бедра, сохраняется неизмененным до 4—6 лет, а в ряде случаев вокруг него образуется склеротический вал, возможно, как проявление тканевой несовместимости. Такие трансплантаты, безусловно, не являются стимуляторами процессов реваскуляризации и костеобразования.
В случаях длительного сохранения стадии импрессионного перелома в эпифизе или при наличии в нем секвестроподобных участков мы применили просверливание канала от основания большого вертела через шейку в эпифиз троакаром диаметром 0,5—0,7 см и дополнительное просверливание 8—10 каналов спицами. Через такие каналы врастает богатая сосудами грануляционная ткань, что улучшает питание кости.
(по материалам открытых интернет-источников)
Вопросы дифференциальной диагностики костно-суставной патологии.
Болезни костно-суставной системы и соединительной ткани представляют актуальную медико-социальную проблему не только национального, но и мирового значения.
Занимают одно из ведущих мест в структуре первичной и общей заболеваемости населения.
Являются наиболее частой причиной длительных болей и нетрудоспособности.
Структура костно-суставной патологии.
Вопросы, на которые должен ответить рентгенолог при обнаружении образования кости.
1 — неопластическое, инфекционное образование или результат дистрофических (диспластических) изменений или обменных нарушений
2 — доброкачественное или злокачественное
3 — первичное или вторичное образование
Необходимо использовать не скиалогический, а морфологический язык описания.
Цель лучевых исследований.
• Локализация
• Количественная оценка:
количество образований
инвазия.
• Качественная оценка:
злокачественное или доброкачественное предположительный гистологический тип
• Предполагаемый диагноз:
вариант нормы дистрофические/диспластические изменения нарушения обмена веществ (метаболические) травма
воспаление опухоль

Важно.
Направительный диагноз
• Возраст
• Оценка результатов предыдущих исследований, анализов
• Симптомы и результаты физикального обследования
• Моно – или полировальное поражение

Оценка изменений в анализах
• Остеомиелит – повышенное СОЭ, лейкоцитоз
• Доброкачественные опухоли — нет изменений в анализах
• Саркома Юинга – лейкоцитоз
• Остеосаркома — повышение ЩФ
• Метастазы, миеломная болезнь – анемия, повышение кальция в крови
• Миеломная болезнь – белок Бенс-Джонсона в моче
Оценка.
• Локализация образования
• Число образований
• Деструкция/склеротические изменения кости
• Наличие гиперостоза
• Тип периостальной реакции
• Изменения в окружающих тканях
Количественная оценка.
• Первичные опухоли – чаще солитарные
• Метастазы и миелома – множественные
Группы основных изменений
• изменениями формы и величины кости
• изменениями контуров кости
• изменениями костной структуры
• изменения надкостницы, хряща
• изменения окружающих мягких тканей
Деструкция костной ткани.
• Доброкачественная — за счет экспансивного роста, повышения давления, надкостница сохраняется (долгое время), доброкачественная персональная реакция
• Злокачественная — инвазивный рост, плохая дифференцировка краев,мягкотканыйкомпонент, злокачественная периостальная реакция, периостальная гиперплазия, рисунок «изъеденный молью»
Кортикальная деструкция.
Определяется при широком спектре патологии, воспалительных измениях доброкачественных и злокачественных опухолях. Полная деструкция может быть при высокодифференцированных злокачественных опухолях, при локальных агрессивных доброкачественных образованиях, таких как эозинофильная гранулема, при остеомиелите. Частичная деструкция может быть у доброкачественных и низкодифференцированных злокачественных опухолях.
Фестончатость по внутренней поверхности (эндостальная) может при фиброзном кортикальном дефекте и низкодифференцированных хондросаркомах.
Вздутие кости так же является вариантом кортикальной деструкции — происходит резорбция эндоста и костеобразование за счет периоста, «неокортекс» может быть гладким, непрерывным и с участками прерывистости.
По данным рентгенографии при злокачественных мелко- круглоклеточных опухолях (саркома Юинга, мелкоклеточная остесакрома, лимфома, мезенхимальная хондросаркома) целостность кортикальной пластинки может быть сохранена, но, распространяясь чрез гаверсовы каналы, они могут формировать массивный мягкотканый компонент.
Типы персональной реакции.
Кальцификация матрикса.
• Кальцинация хондроидного матрикса в хрящевых опухолях. Симптом «попкорна», кальцинация по типу хлопьев, по типу колец и дуг.
• Кальцинация остеоидного матрикса в остеогенных опухолях. Трабекулярная оссификация. Может быть в доброкачественных (остеоид остеома) и злокачественных опухолях (остеогенная саркома)
Остеомиелит.
— бактериальное воспаление костного мозга после металлоостеосинтеза (чаще у взрослых)
— ограниченный гнойный очаг с формированием деструкции (очаговый остеомиелит)
— поверхностная форма – затрагивает кортикальный слой кости и окружающие мягкие ткани
— распространенный тип остеомиелита – обширное поражение кости на фоне предшествующего процесса
— хронический остеомиелит – слоистые периостальные наслоения, происходит чередование процесса периостального костеобразования (периостоз) с образованием новой кости
— отек костного мозга (рентген негативная фаза, до 4 недель, метод выбора — МРТ )
— инфильтрация парасоссальных мягких тканей
— гнойное воспаление костного мозга
— некротизация костного мозга
— очаги деструкции
— образование секвестров
— распространение гноя вдоль мышечных структур, образование свищей
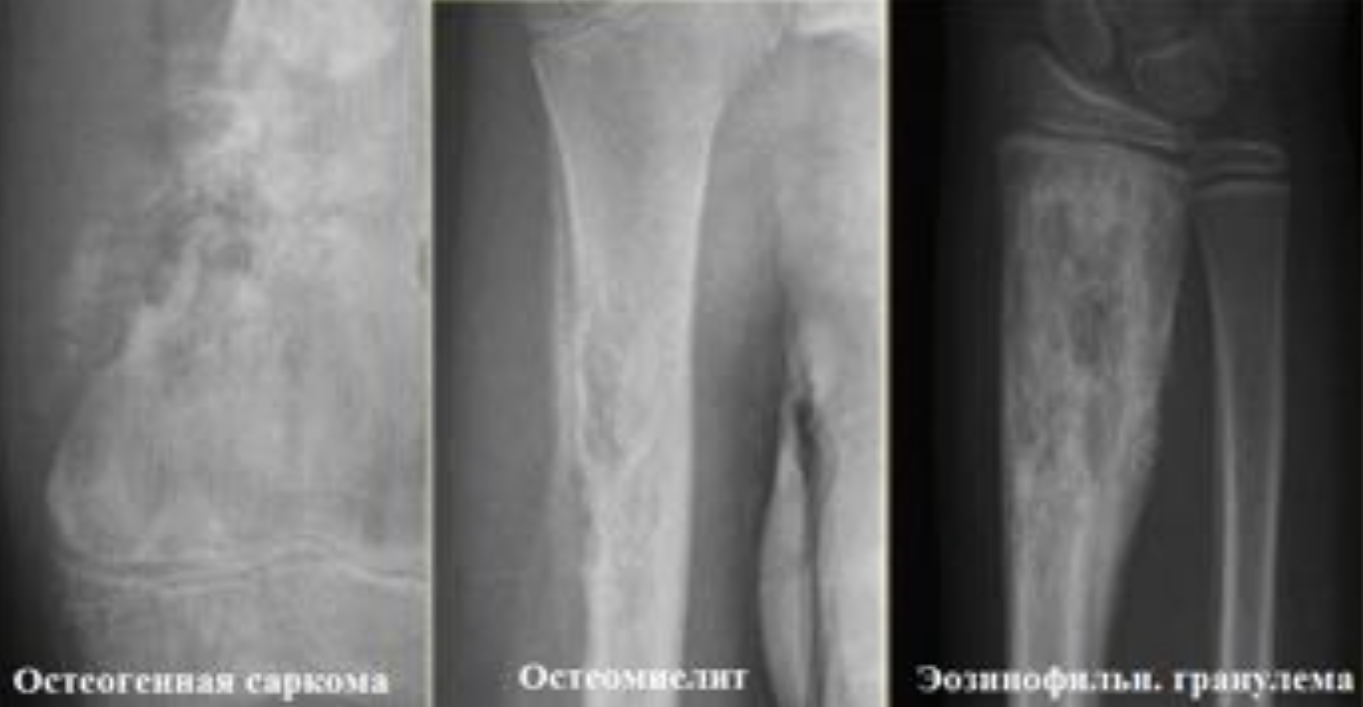
Сравнительное изображение остеомиелита
1) остеогенная саркома
2) остеомиелит
3) эозинофильная гранулема.
Отек костного мозга.
Отек мозга визуализируется при 15 разных патологиях.
Остеоартроз.
1 стадия
— субхондральный склероз
— краевые костные разрастания
2 стадия
субхондральные кисты (геоды)  выход на край — эрозии
сужение суставной щели
3 стадия
-дефигурация суставный поверхностей, нарушение взаимоотношения в суставе
— хондромаляция, субхондральный отек (МРТ)
— выпот в суставе (реактивный синовиит, МРТ)
— вакуум-феномен (кт)
Геоды встречаются при:
— остеоартрозы
- ревматоидный артрит (так же эрозии) 
— болезни с нарушением отложения кальция (пирофосфатная
артропатия, хондрокальциноз, гиперпаратиреоидизм)
— аваскулярный некроз
Геоды. Эрозии. 
Гиперпаратиреоз.
• поднадкостничная резорбция в трубчатых костях кистей (лучевая часть), шейке бедренной кости, проксимальный отдел большеберцовой кости, ребрах
• туннелирование кортикального слоя
• опухоль Брауна (бурые опухоли) – литическое поражение с четкими ровными краями, раздувает надкостницу, м.б. кровоизлияние (кости таза, ребра, бедренная кость, кости лица). Чаще у женщин, возраст 30-60 лет. Развиваются У 20 % больных гиперапаратиреозом. Гетерогенный сигнал во последовательности на МРТ
• хондрокальциноз
Опухоль Брауна при гиперпаратиреозе
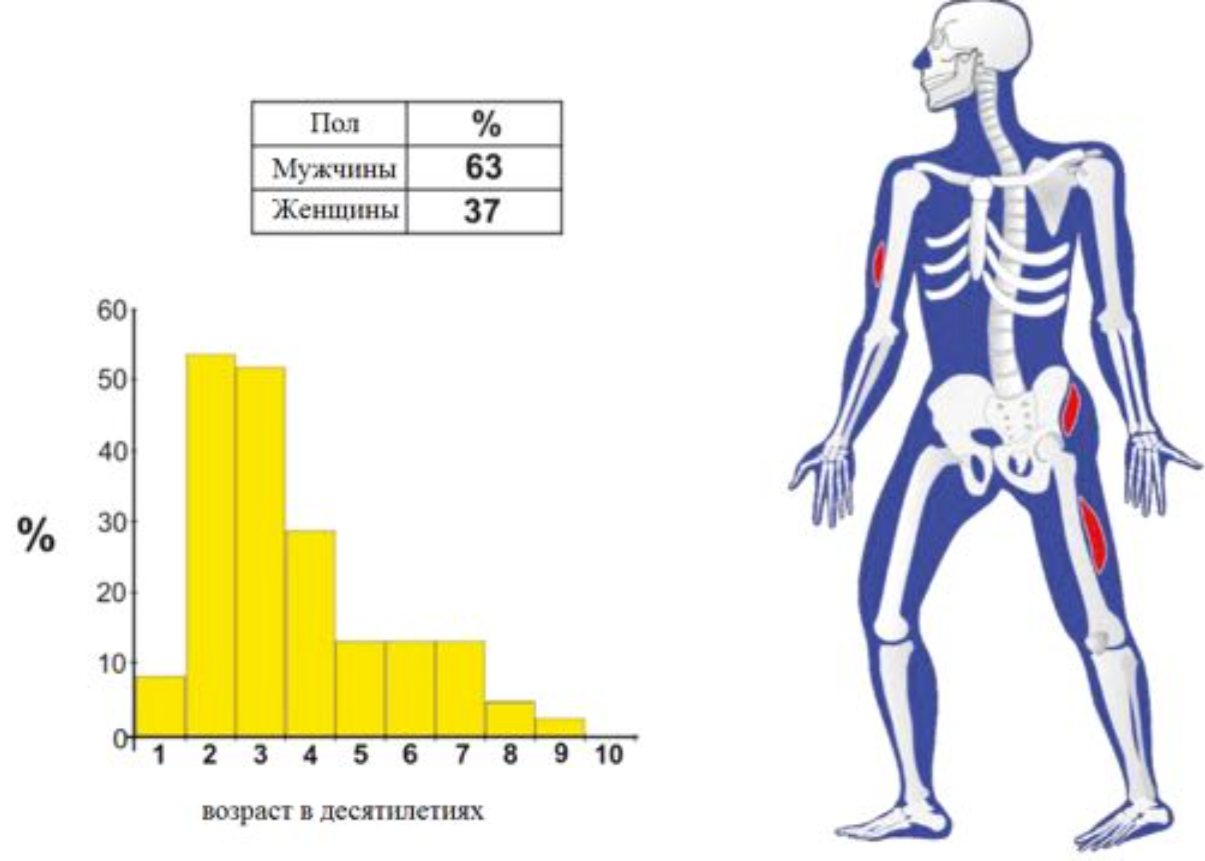
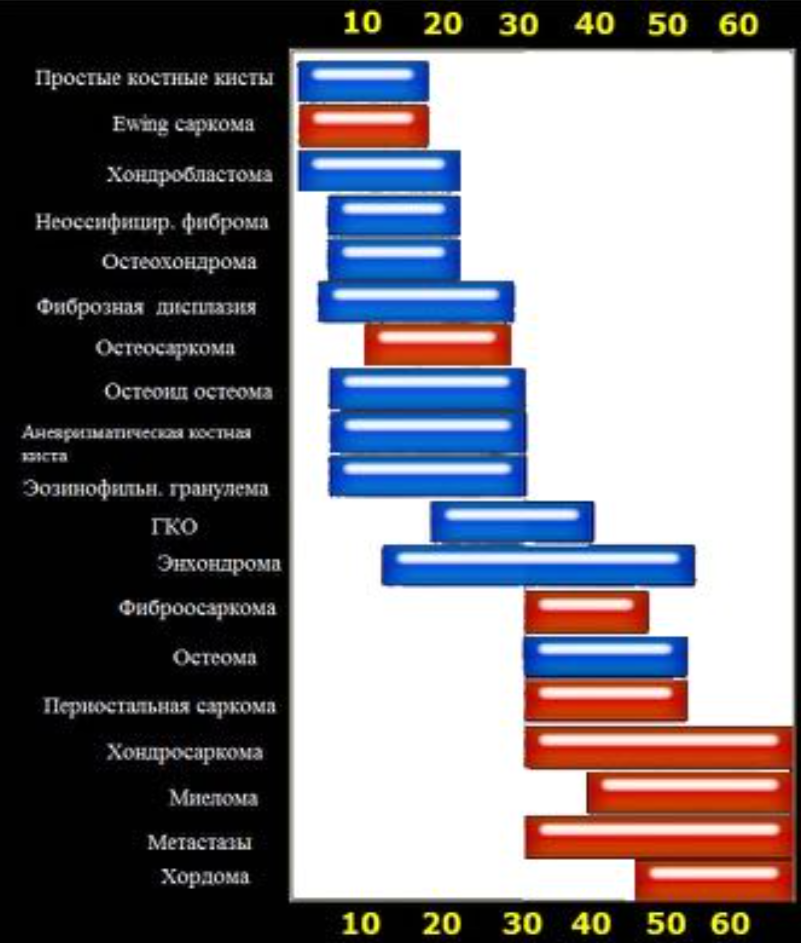
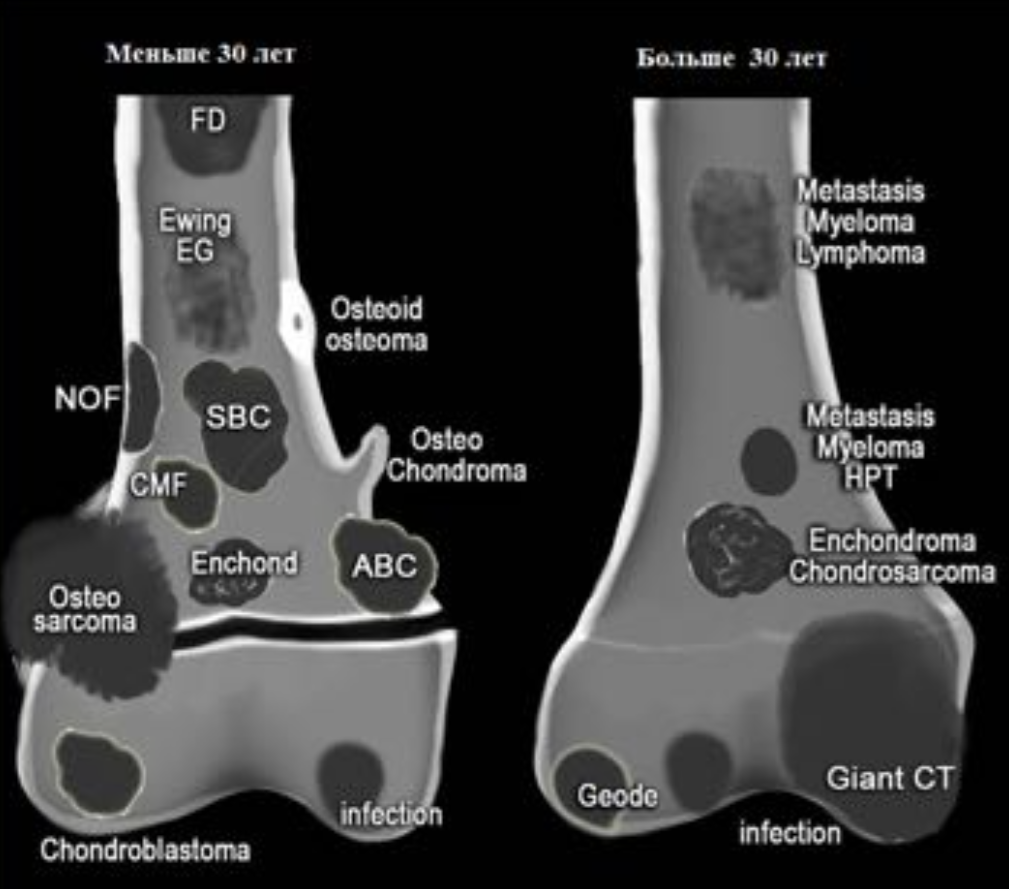
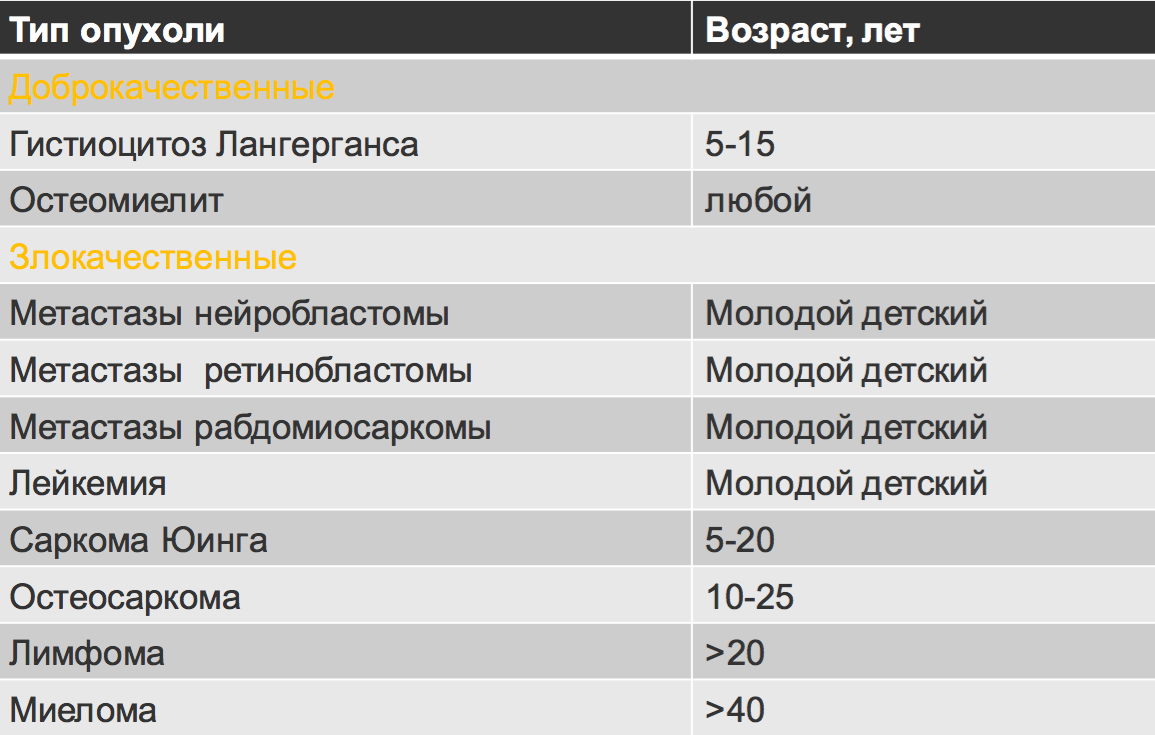
Возрастное распределение костных образований.
Локализация костных образований
FD- фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф.гранулема
Osteoidosteoma- остеоид- остеома
NOF – не оссифицир. Фиброма
SBC – простая костная киста
CMF – хондромиксоидная фиброма
ABC – анеривзматическая костная киста
Osteosarcoma – остеогенная саркома
Chondroblastoma – хондробластома
Osteohondroma – остеохондрома
Enchondroma-энхондрома
Chondrosarcoma –
хондросаркома
Infection — инфекция
Geode (геоды) –
субхондральная киста
Giant CT (GCT) – гигантоклеточная опухоль
Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм

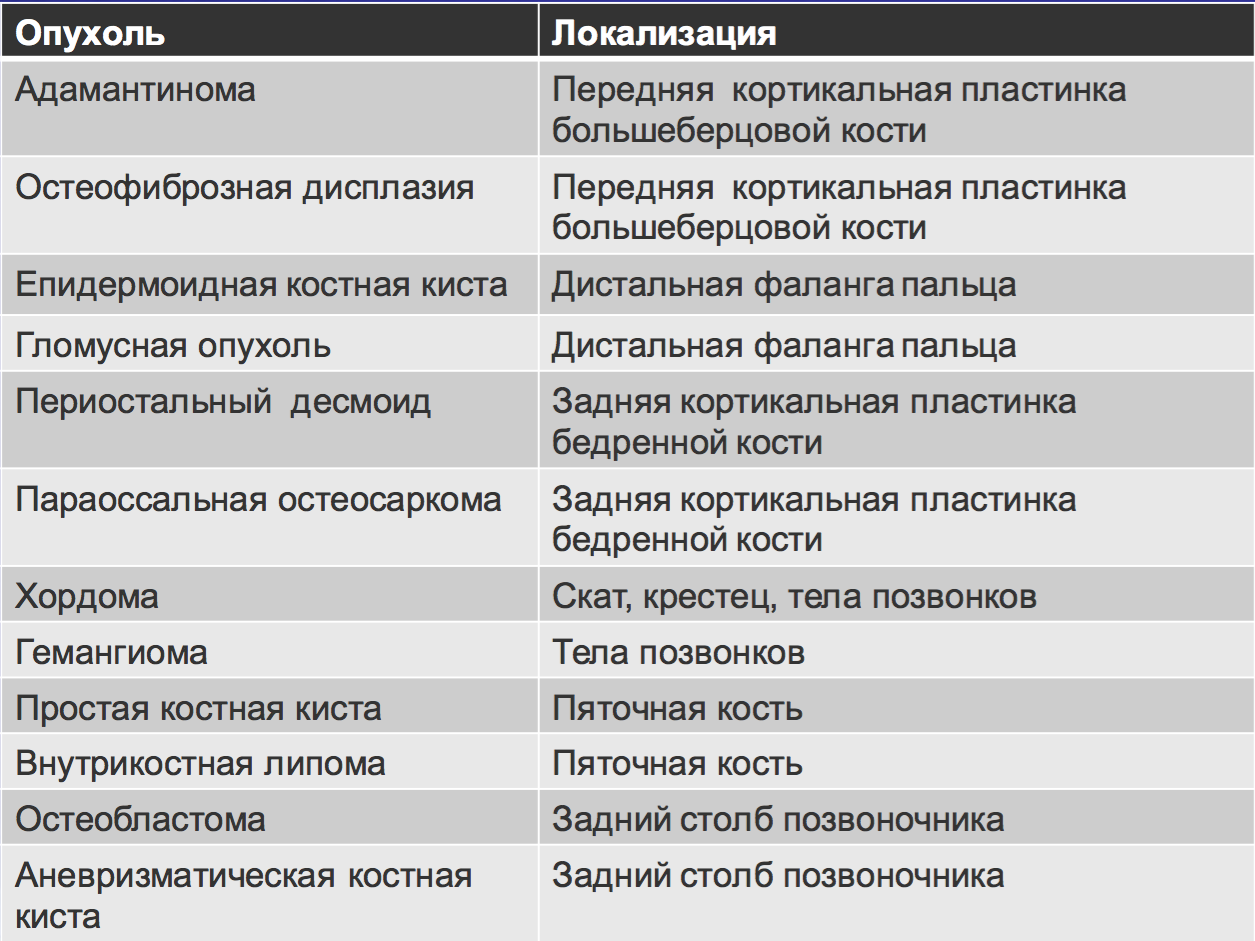
Расположение.
• Центральное: простая костная киста, аневризматическая костная киста, эозинофильная гранулема, фиброзная дисплазия, энхондрома.
• Эксцентричное: остеосаркома, неоссифицирующая фиброма,хондробластома, хондромиксоидная фиьрома, остеобластома, гиганоклеточные опухоли.
• Кортикальное: остеоид-остеома.
• Юкстакортикальное : остеохондрома, парадоксальная остеосаркома
Принцип оценки рентгенографии.
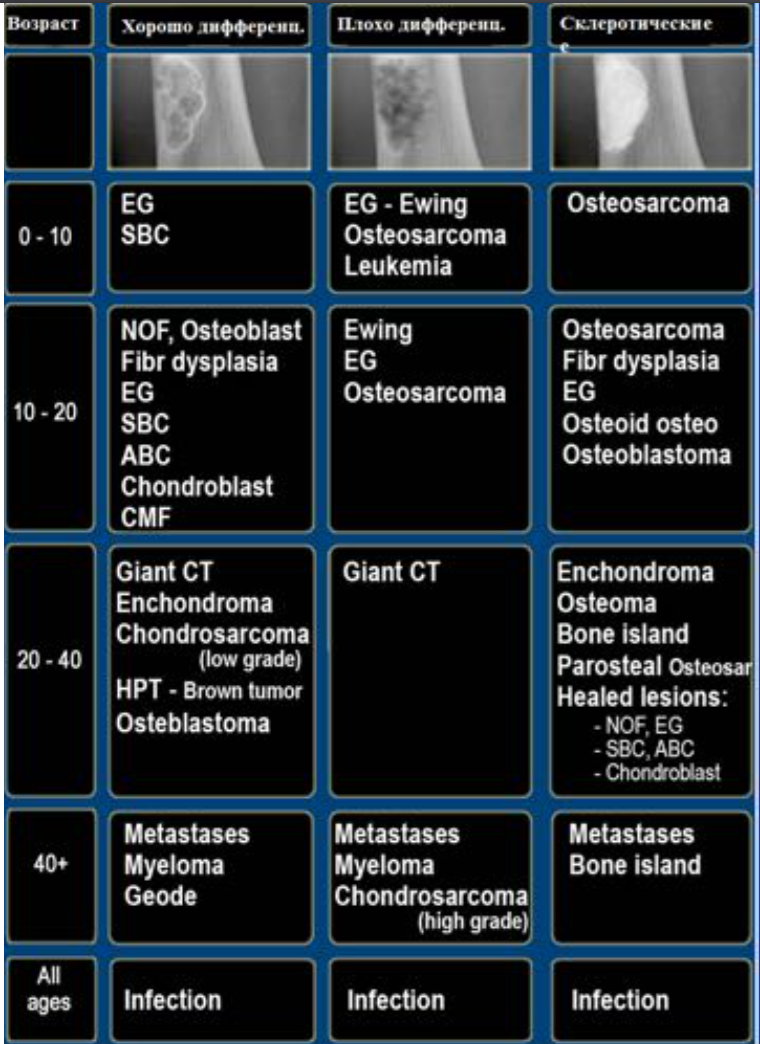
Отношение возраста и наиболее частой патологии.
FD- фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф.гранулема Osteoidosteoma- остеоид-остеома
NOF – не оссифицир. Фиброма
SBC – простая костная киста
CMF – хондромиксоидная фиброма ABC – анеривзматическая костная киста Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция
Geode (геоды) – субхондральная киста
Giant CT (GCT) – гигантоклеточная опухоль Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм
Leukemia — лейкемия
Bone island –костные островки
Low grade – низкодифференцированная
High grade — высокодиффернцированная Parosteal Osteosar – параостальная остеосаркома

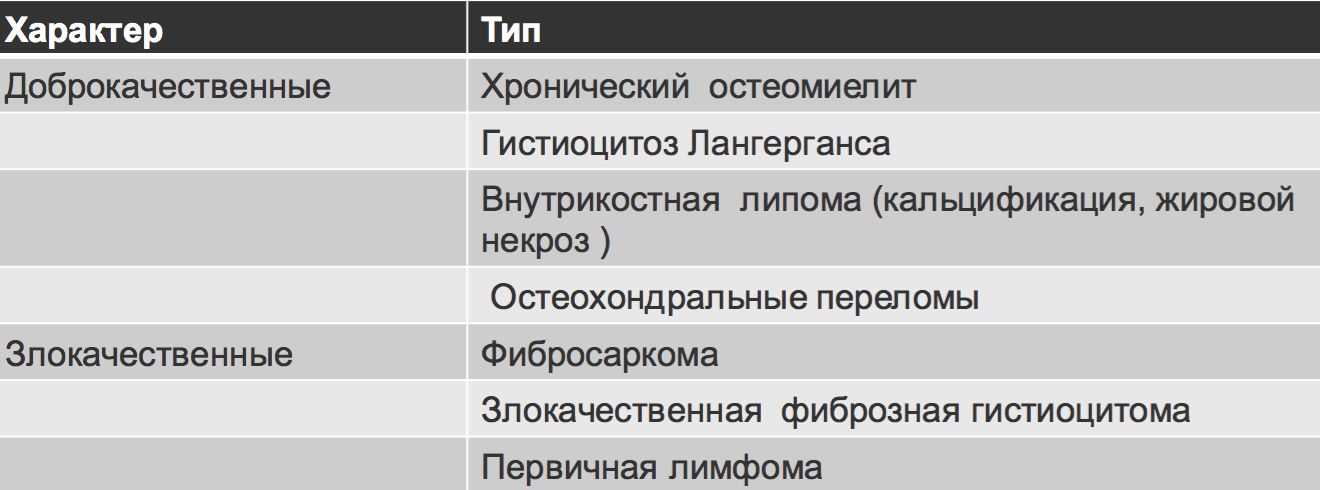
Ключевые моменты дифференциальной диагностики.
• Основная масса костных опухолей — остеолитические.
• У пациентов до 30 лет наличие зон роста является нормой
• Метастазы и миеломная болезнь всегда включаются в дифференциальный ряд множественного литического поражения у поражения у пациентов старше 40 лет
• Остемиелит (инфекция) и эозинофильная гранулемы могут симулировать злокачественную опухоль (агрессивный тип периостальной реакции, деструкция кортикальной пластинки, плохое дифференцирование краев)
• Злокачественные опухоли не могут вызывать доброкачественной периостальной реакции
• Наличие периостальной реакции исключает фиброзную дисплазию, энхондрому, неоссифицирующую фиброму, простую костную кисту.
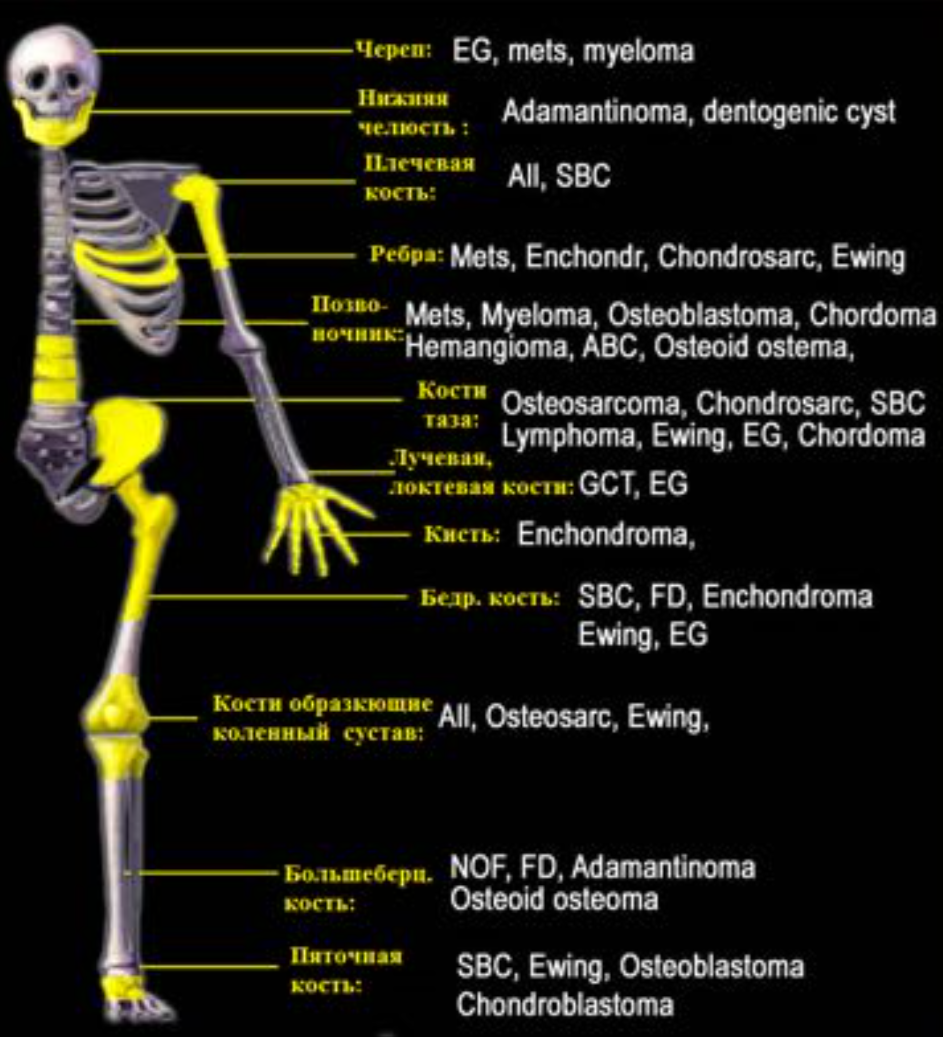
Локализация опухолей костей.
FD-фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф. гранулема Osteoidosteoma- остеоид-остеома NOF – не оссифицир. Фиброма SBC – простая костная киста
CMF – хондромиксоидная фиброма ABC – анеривзматическая костная
киста
Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция
Geode (геоды) – субхондральная киста Giant CT (GCT) – гигантоклеточная
опухоль
Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм
Leukemia — лейкемия
Bone island –костные островки
Low grade – низкодифференцированная High grade —
высокодиффернцированная Parosteal Osteosar – параостальная
остеосаркома
Специфическая локализация ряда костных образований.
Образования с множественными литическими изменениями по типу «изъеденных молью»
Изменения, которые могут формировать секвестр
Образования с множественными литическими изменениями по типу «мыльных пузырей»
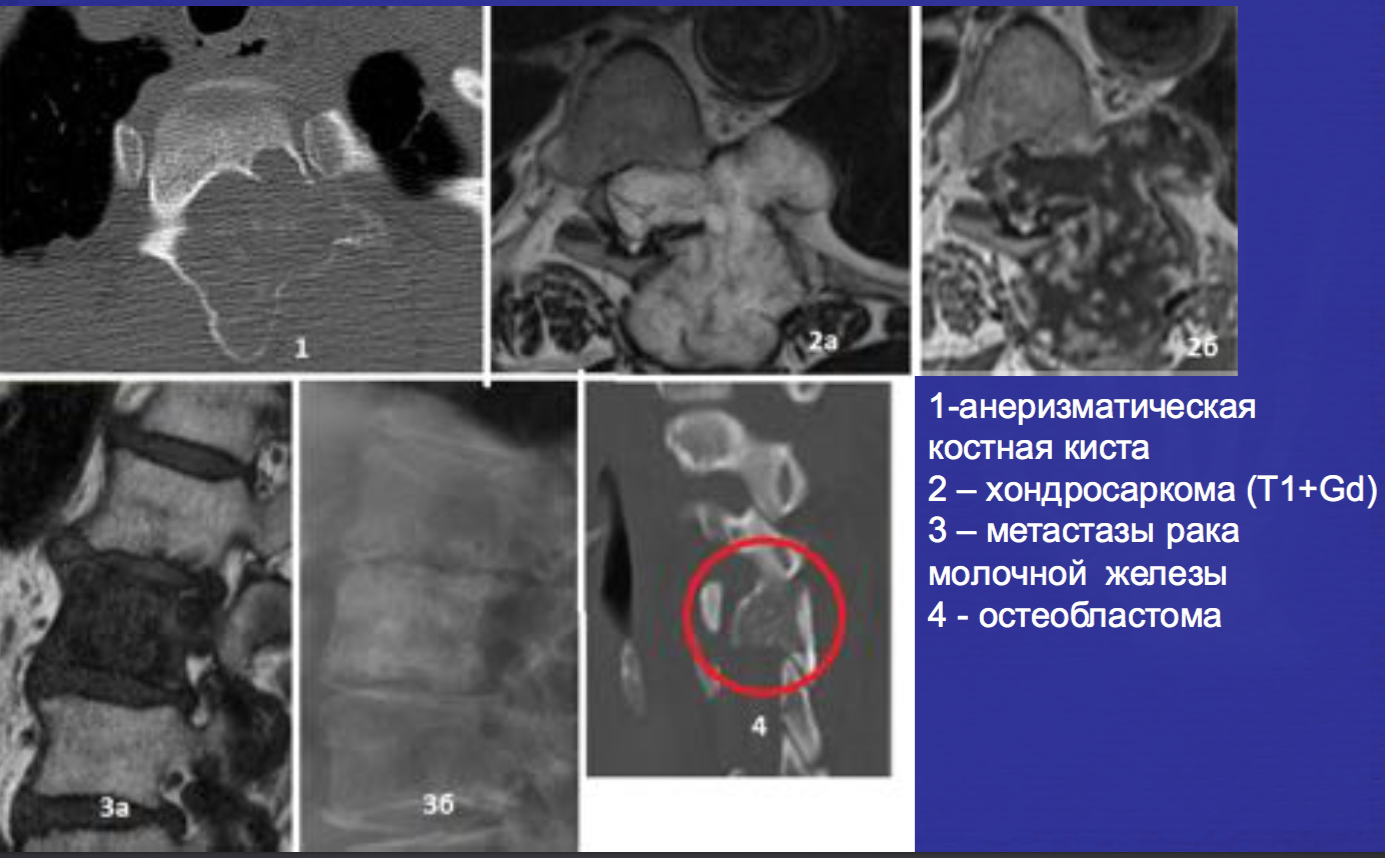
Наиболее частые спинальные литические поражения.
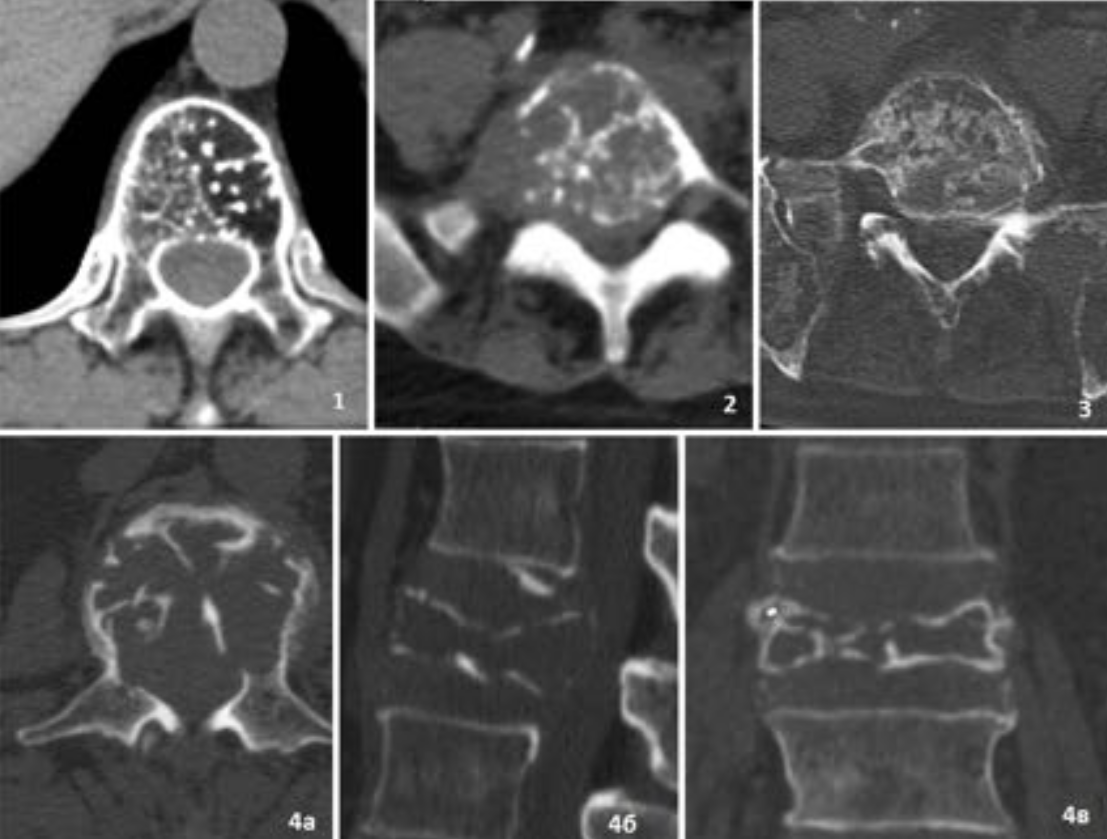
3- множественная миелома
4 — плазмоцитома
Другие варианты спинальных литических поражений.
Болезнь Педжета.
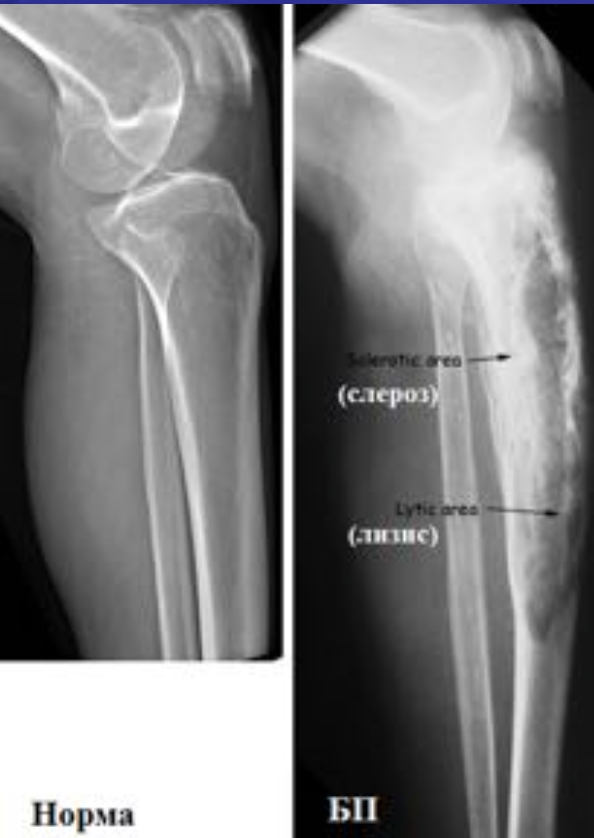
Болезнь Беджета (БП) является довольно распространенным заболеванием во многих европейских странах, США. Оценка распространенности у людей старше 55 лет колебалась от 2% до 5%. Факт, что значительная доля пациентов остаются бессимптомными на протяжении всей их жизни. БП всегда следует рассматривать в дифференциальной диагностике остеосклеротических, а также остеолитических скелетных поражений.
I стадия (литическя) — острая стадия, определяется деструкция кортикального слоя в виде очагов пламени или в форме клина.
II стадия (переходная) – смешанное поражение (остеолиз + склероз).
III стадия (склеротическая) – преобладание склероза с возможной деформацией кости
В монооссальных случаях, частота которых, согласно публикациям, начинается от 10-20% доходя до почти 50%, дифференциальный диагноз может быть гораздо сложнее. В огромном большинстве случаев БП, наличие неоднородных участков костного склероза или остеолиза с искажением трабекулярной архитектуры в сочетании с кортикальным утолщением и фокальным утолщением кости практически патогномоничен для данного заболевания. Бедренная кость является второй наиболее распространенной монооссальной локализацией после таза. В случаях, когда имеется ее дистальное поражение, рентгенологические признаки, характерные для БП, выявляются с меньшей частотой или менее выражены, так что дифференциация с другими процессами, в частности, опухолевыми, может быть затруднена.
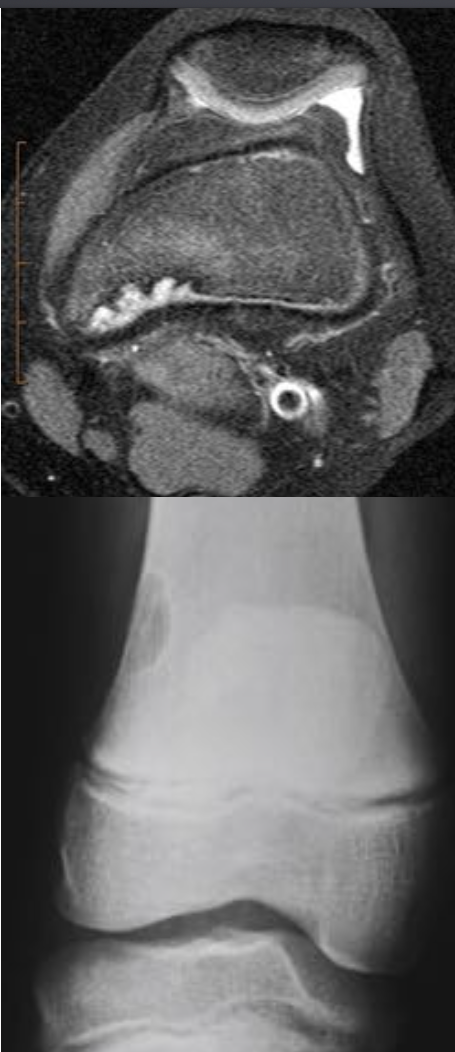
• Интрамедуллярное эксцентричное метаэпизеальное многокамерное кистозное образование
• В полостях определяются множественные уровни жидкости содержащие кровь
• Ограничены мембраной различной толщины, состоящие из костных трабекул и остеокластов
• В 70% — первичные, без явных причин
• В 30% — вторичные, в результате травмы
• Этиология неизвестна, предполагается неопластическая природа
• Половой предрасположенности нет, в любом возрасте
• Чаще располагаются в длинных трубчатых костях и позвоночнике
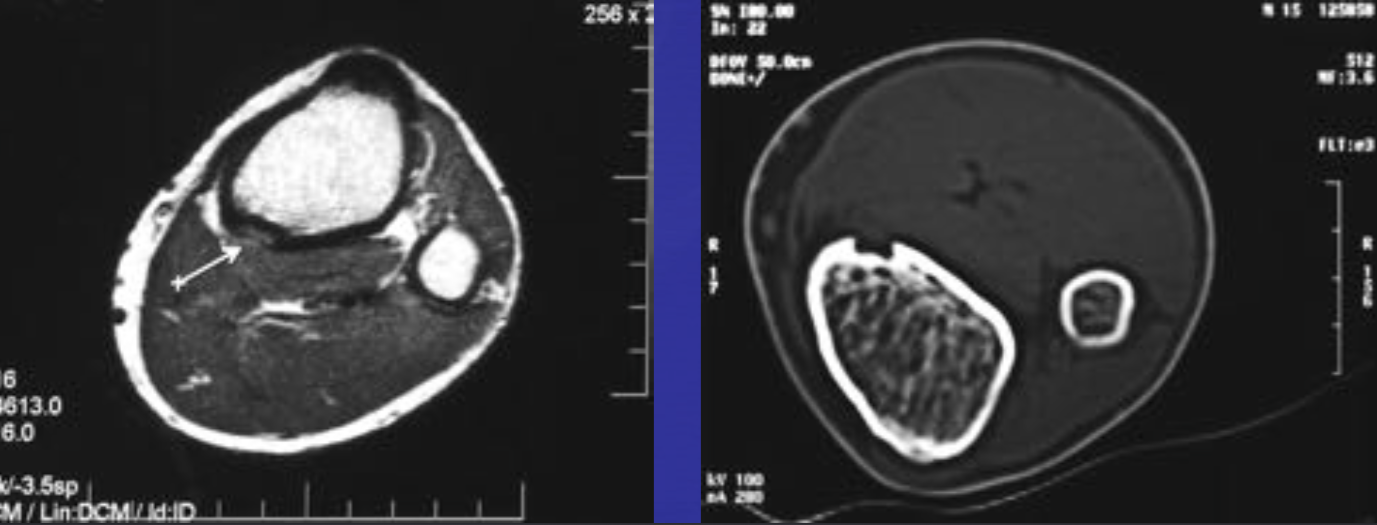
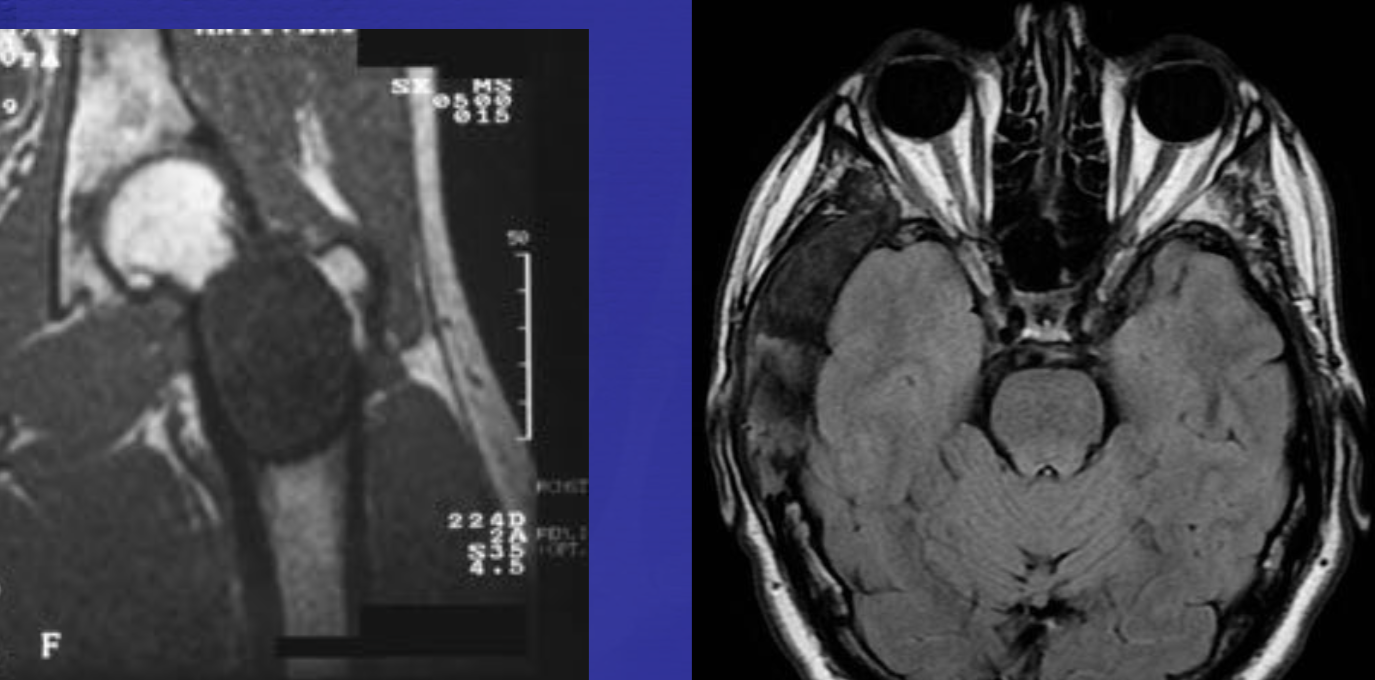
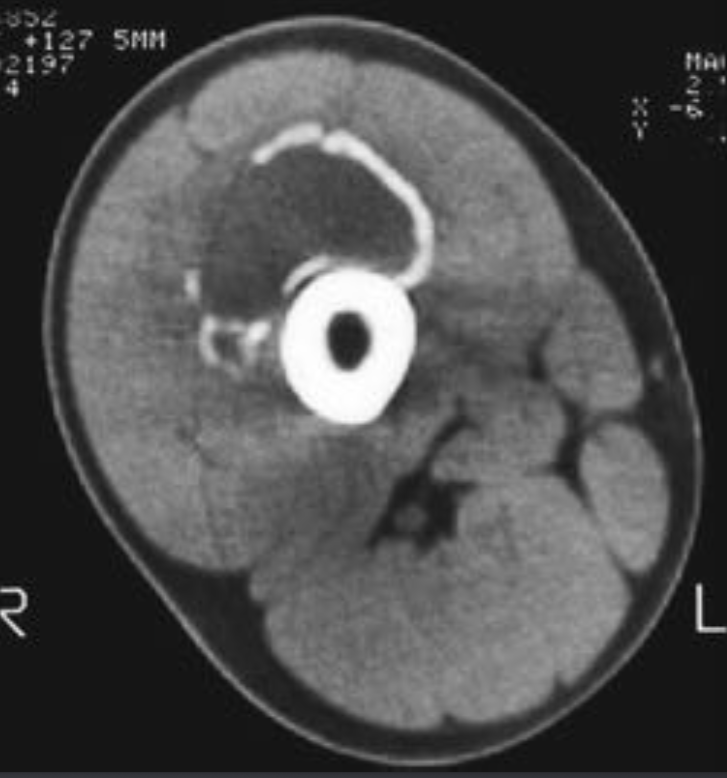
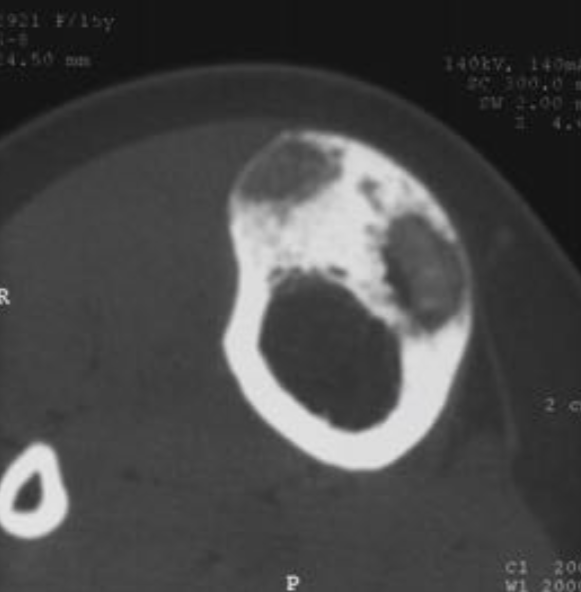
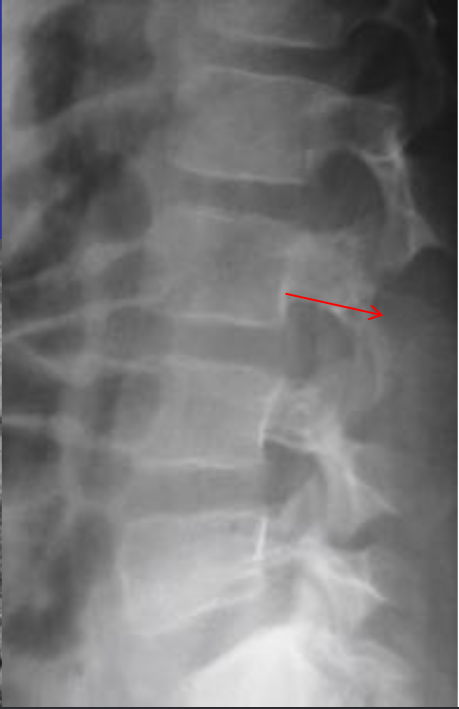
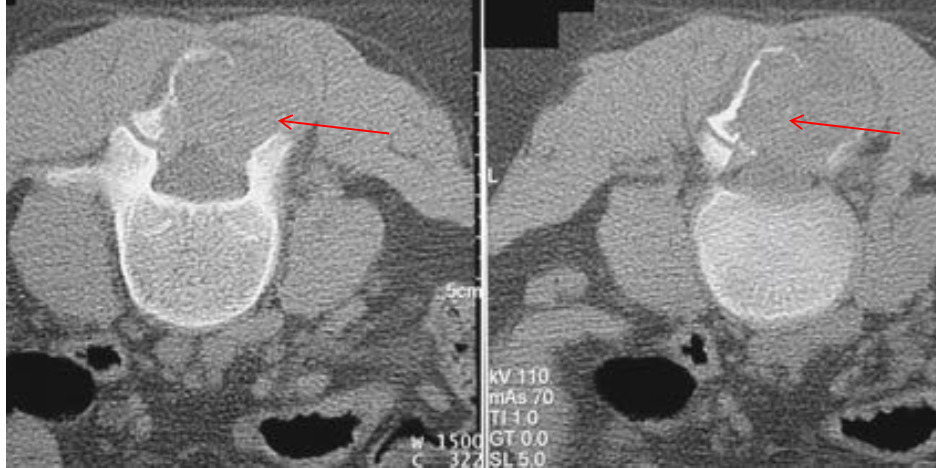
Аневризматические костные кисты
• Многокамерные кисты с перегородками
• Множественные уровни жидкости
• Склеротическое кольцо по периферии
• При локализации в позвонках – поражает более одного сегмента
• Редко располагается центрально
«Раздувает» кость, вызывает деструкцию костных балок, компактного вещества
• Может распространяться на соседние костные элементы

 Еще один случай АКК
Еще один случай АКК
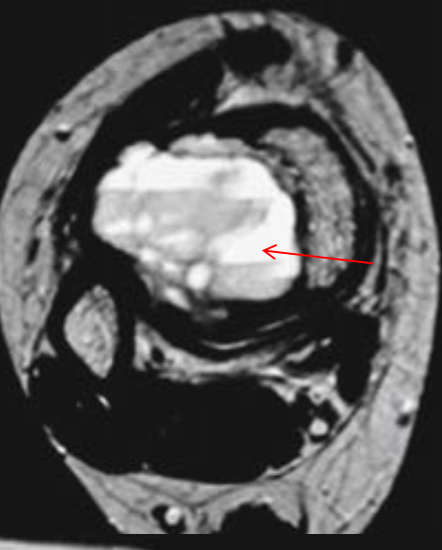
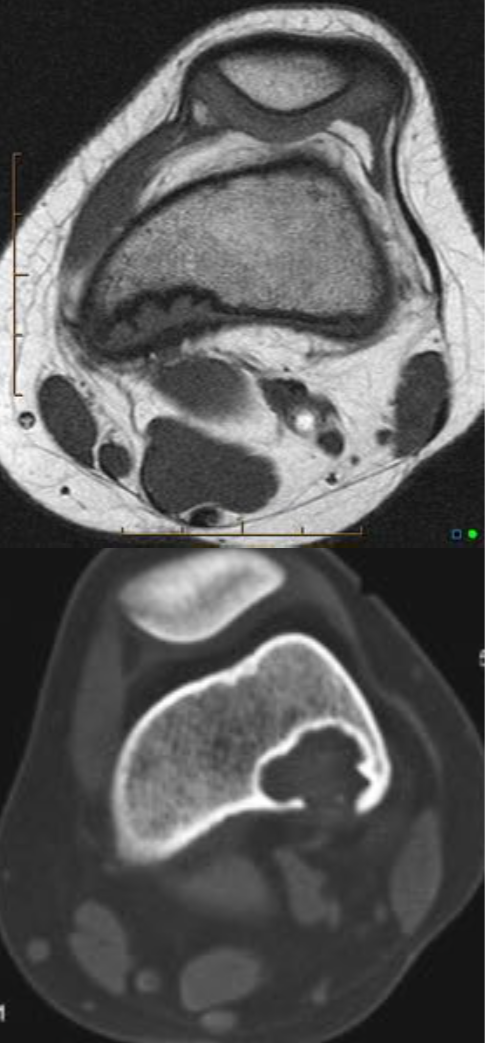
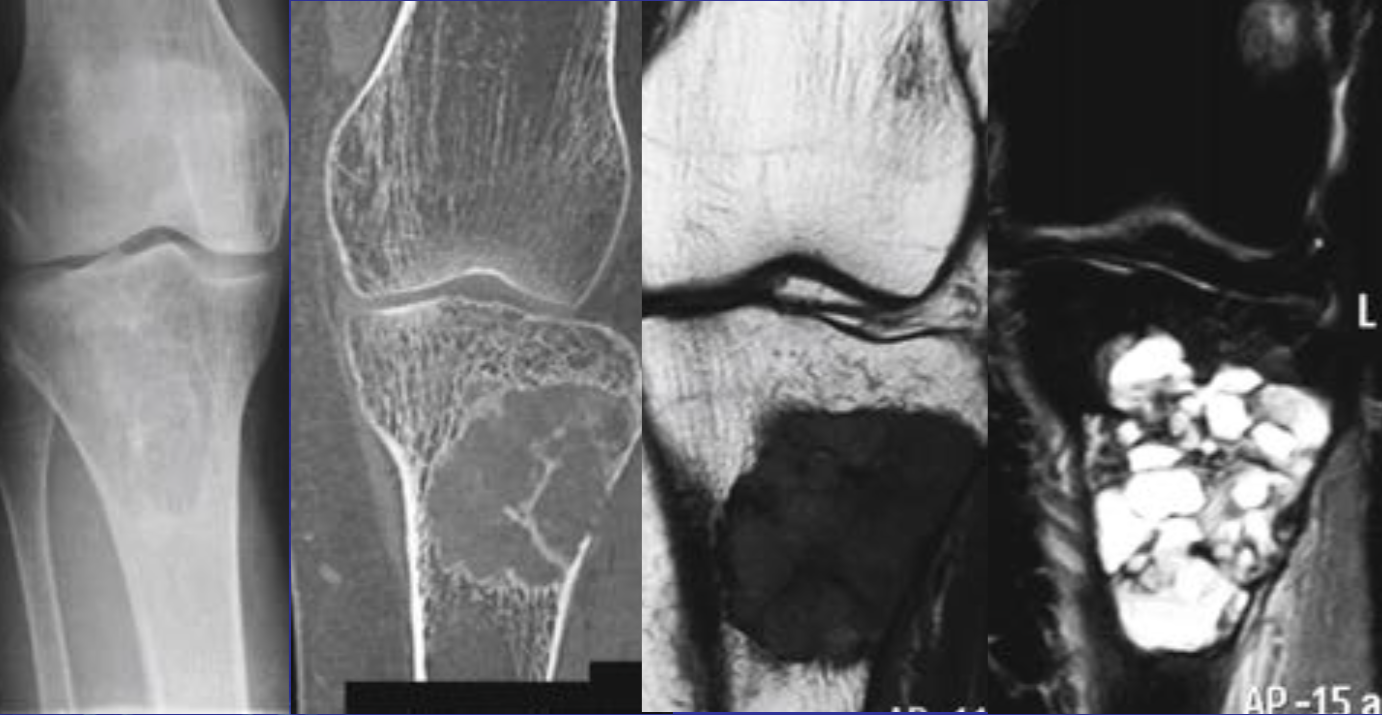
Интрамедуллярные, чаще односторонние полости, с серозным или серозно-геморрагическим содержимым, отделены мембраной различной толщины
• Чаще встречаются у мужчин (2/3:1)
Обнаруживаются на первых двух декадах жизни у 80 %
• В 50 % — проксимальная половина плечевой кости
• В 25 % — проксимальная половина бедренной кости
• Третья локализация по частоте встречаемости – проксимальная половина малоберцовой кости
• У пожилых пациентов чаще встречается в таранной и пяточной костях

• Хорошо отграниченные, симметричные
• Не распространяются выше эпифизиальной пластинки
• Располагается в метаэпифизе, с ростом в диафиз
Деформируют и истончают компактную пластинку
• Периостальная реакция отсутствует
• Возможны переломы, на фоне кист
• Септ практически не содержат
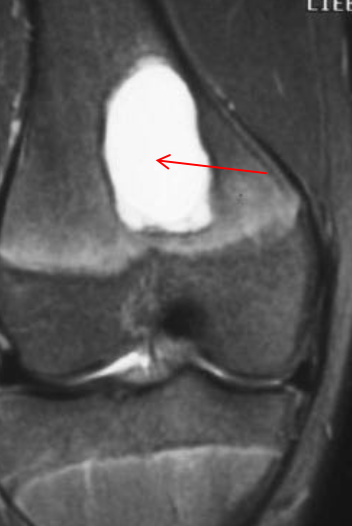
• На T2W, stir, PDFS высокий однородный сигнал, низкий на T1W, без солидного компонента. Признаки высокобелкового компонента (кровь, повышение сигнала на T1W) возможно при переломах
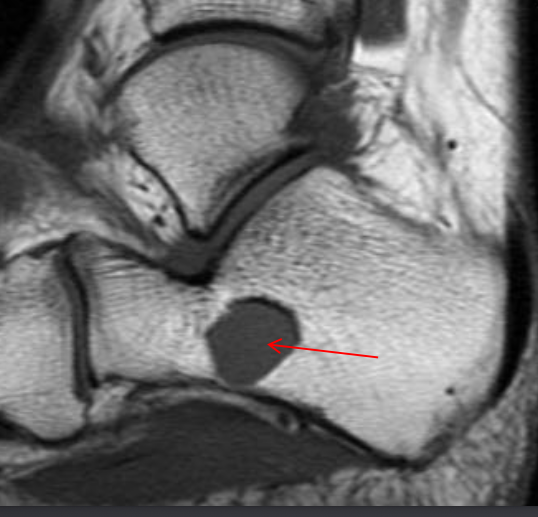
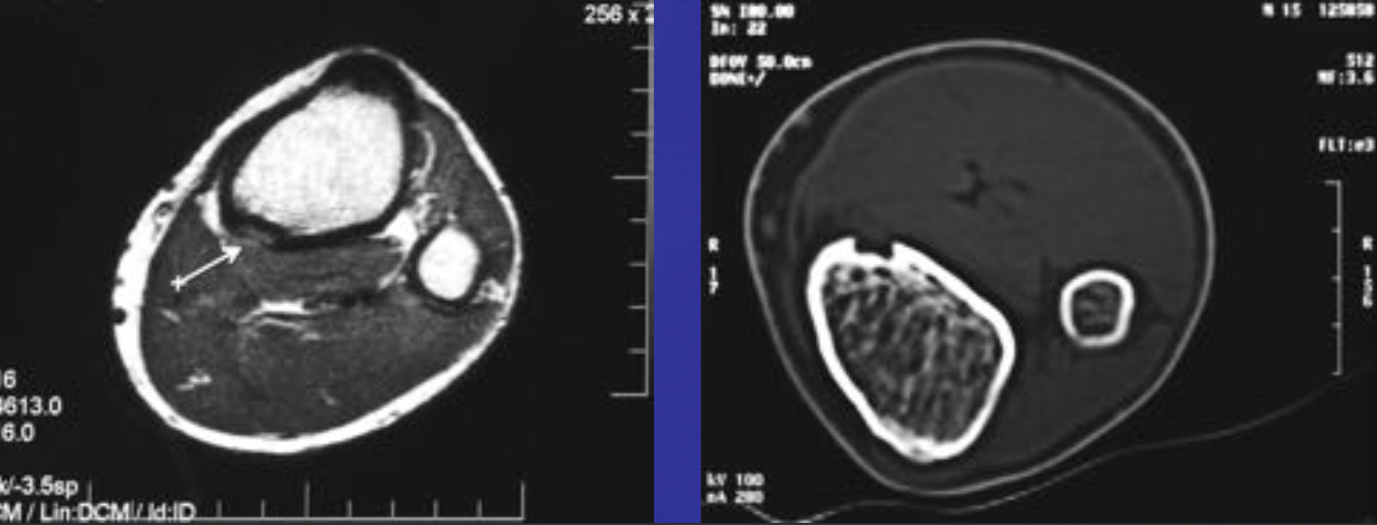
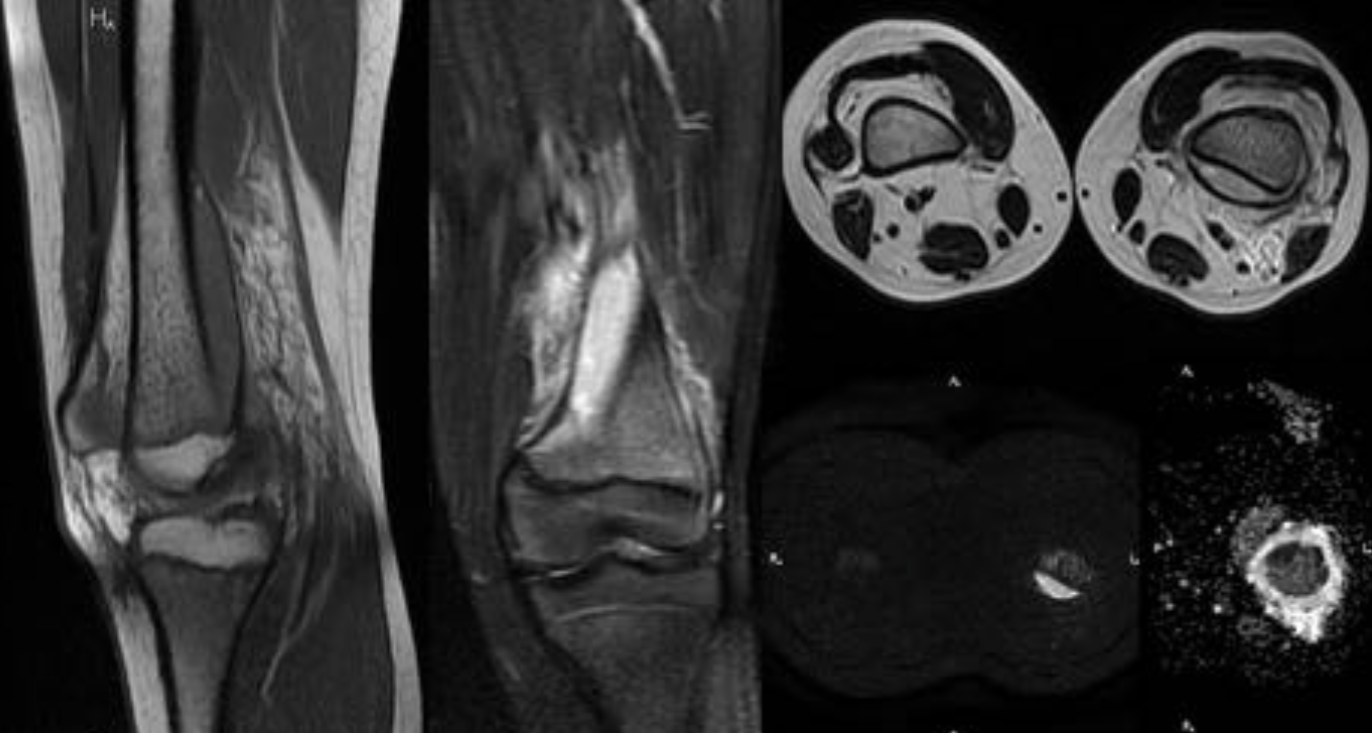
• Ненеоплатическое субхондральное кистозное образование, развивается в результате мукоидной дегенерации соединительной ткани
• Не связно с дистрофическими процессами
• Содержит муцинозную жидкость и отграничена фиброзной тканью с миксоидными имениями
• Если в суставе определяются дистрофические изменения, это изменение трактуется как дегенеративнная субхондральная псевдокиста (чаще носят множественны характер)
• Преобладают мужчины
• 80% — между 30 и 60 годами
• Чаще располагается в тазобедренном, коленном суставах, голеностопных, лучезапястных и плечевых
Юкстаартикулярная костная киста
• Определяется в виде хорошо отграниченного овального или округлого кистозного образования
• Эксцентрично
• Располагается субхондрально, в эпифизах
• Ограничены соединительнотканной мембраной с фибробластами, коллагеном, синовиальными клетками
• Синонимы – внутрикостный ганглион, внутрикостная мукоидная киста.
• Могут деформировать надкостницу
• Отграничены склеротическим ободком
• Чаще1-2см,редкодо5см
• Дистрофические изменения в суставе не выражены
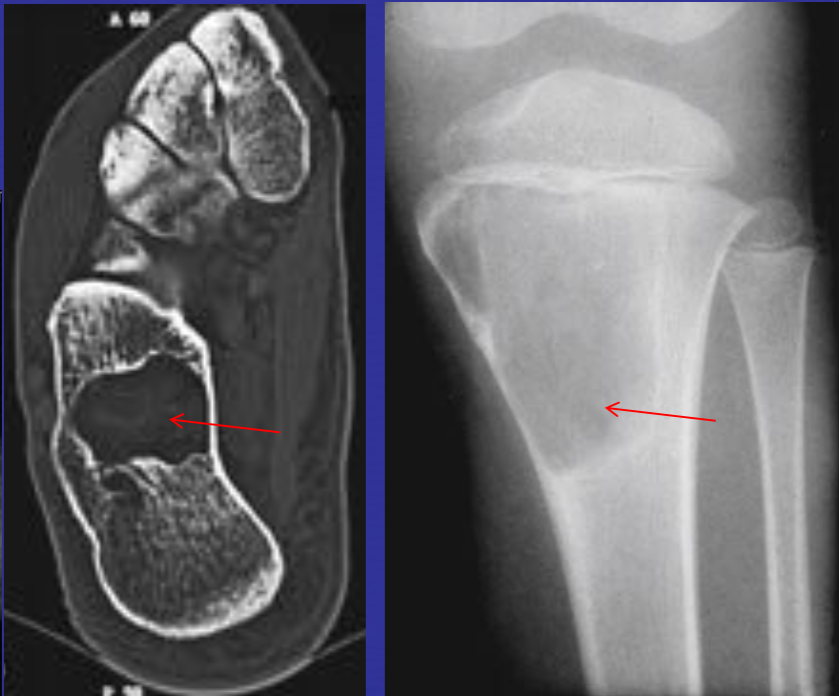
Метаэпифизиальный фиброзный дефект (фиброзный кортикальный дефект).
• Синоним – неоссифицирующая фиброма (не путать с фиброзной дсиплазией), применяется для образований более 3 см
• Ненеоплатическое образование
• Состоит из фиброзной ткани с многоядерными гигантскими клетками, гемосидерином, воспалительными элементами, гистиоцитами с жировой тканью
• Одно из самых частых опухолеподобных образований костной ткани
• 60% — мужчины, 40% — женщины
• 67% — на второй декаде жизни, 20% — на первой
• Наиболее часто поражает дистальный метаэпифиз бедренной кости и проксимальный метаэпифиз большеберцовой кости. Составляют 80 % случаев
• Длинник располагается вдоль оси кости
• 2-4см, редко до 7 см и более
• Кистозное образование в метаэпифизе, всегда вплотную прилежит к эндостальной поверхности компактной пластинки, часто по периферии склероз, четко отграничена от окружающего костного мозга
• Может вызывать деструкцию кортикальной пластинки, осложняться переломом
• Шире в дистальной части
• Роста через метаэпифизиальную пластинку нет, распространяется по направления к диафизу
• Могут быть геморрагические изменения
• Нет периостальной реакции, изменений со стороны прилежащих мягких тканей
• Сниженный сигнал на T1W, вариабельный на T2W, stir чаще — высокий
Периостальный десмоид.
• Вариант фиброзного кортикального дефекта, локализующийся по дорзальной поверхности дистальной трети бедренной кости
• Семиотика аналогичная фиброзному кортикальному дефекту,толькопроцессограничен кортикальный пластинкой
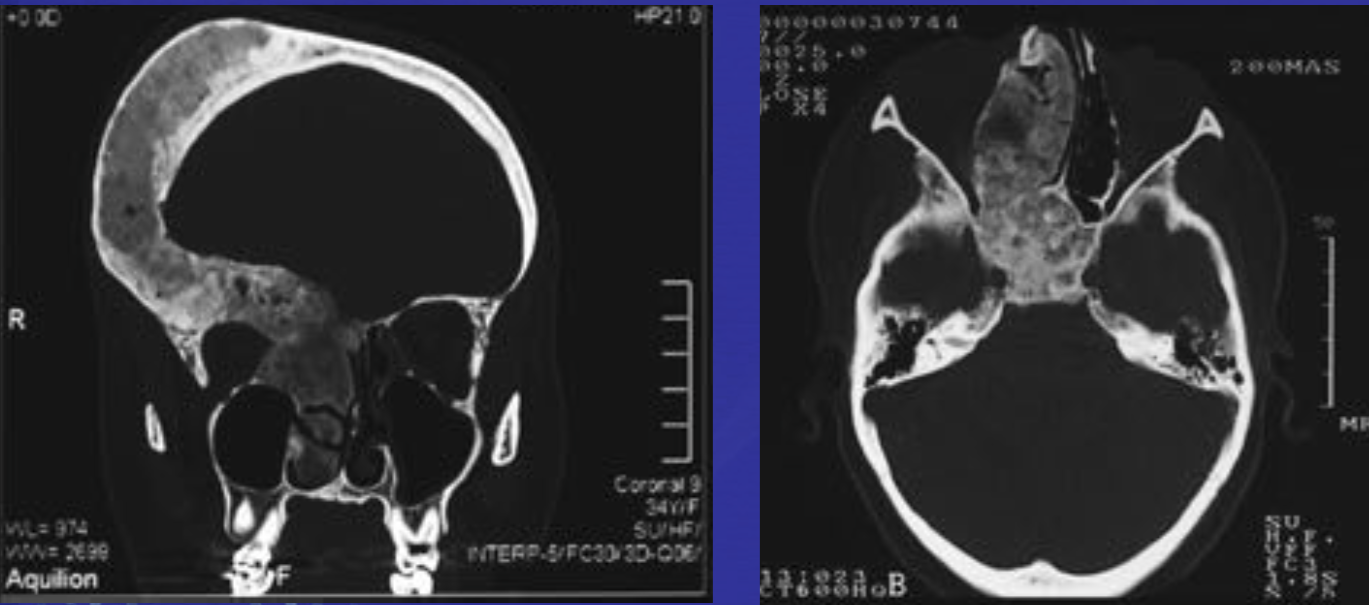
Фиброзная дисплазия.
• Доброкачественное интрамедуллярное фиброзно-костное диспластическое приобретенное образование
• Может быть моно- и полиоссальное поражение
• Монооссльаная форма – 75%
• Немного преобладают женщины (Ж-54%, М-46%)
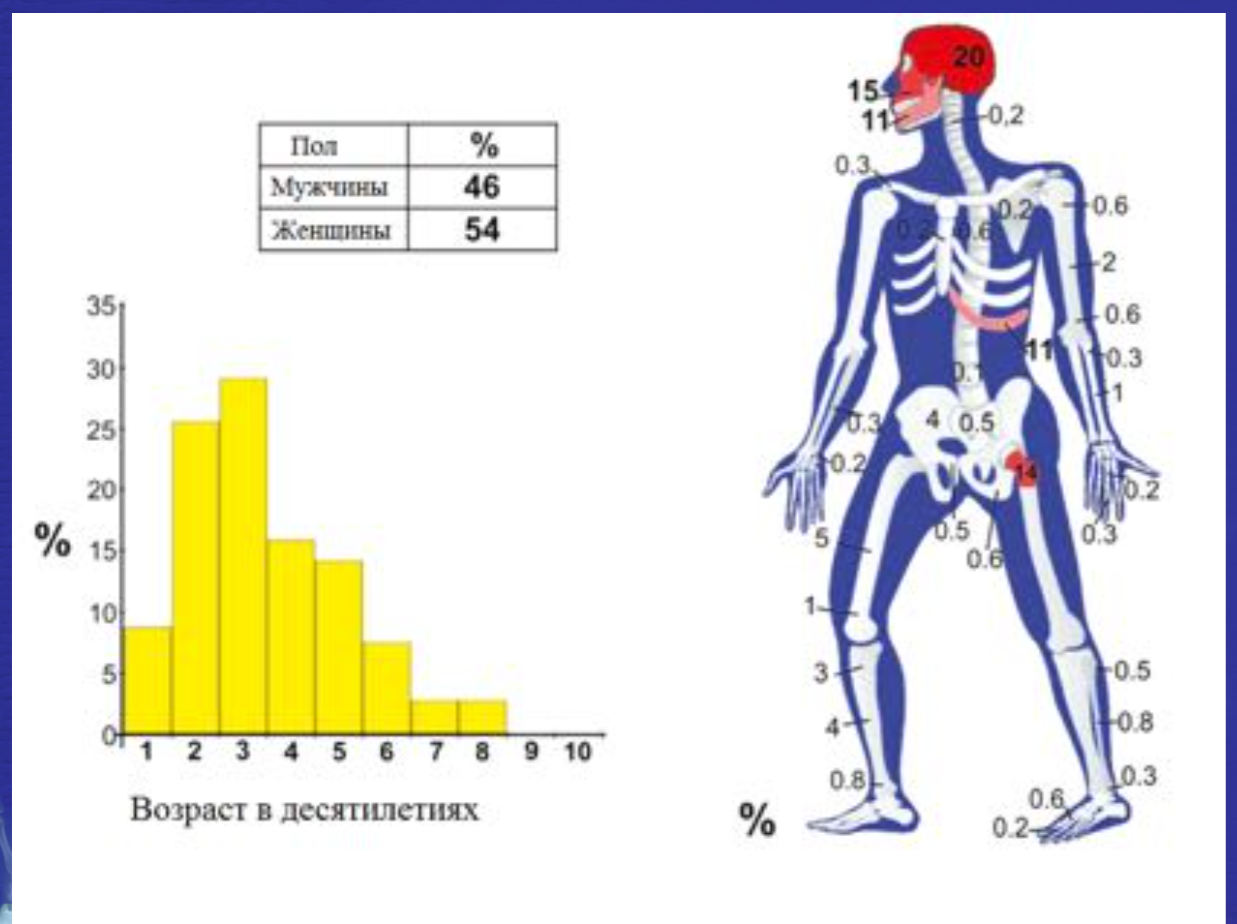
• Возрастные характеристики представлены на следующем слайде
• У 3% пациентов с полиоссальной формой развивается синдром McCune-Albright (пятна цвета «кофе с молоком» + эндокринные нарушения, наиболее часто – гонадотропнозависимое преждевременное половое созревание)
Локализация
Длинные трубчатые кости – проксимальная треть бедра, плечевая кость,большеберцовая кость
• Плоские кости — ребра, челюстно-лицевая область — верхняя и нижняя челюсть
• В трубчатых костях локализуется в метаэпифзах и диафизах
При открытых зонах роста – локализация в эпифизах редкость
• Гистологически состоит из фибробластов, плотног о коллагена, богато васкуляризированного матрикса, присутствуют костные трабекулы, незрелые остеоиды, остеобласты
• Возможны патологические переломы, перпендикулярно длинной оси
Патогномоничным признаком является картина «матового стекла» по данным КТ и рентгенографии, реже может наблюдаться картина литических изменений, в зависимости от степени преобладания фиброзного компонента
• Экспансивный рост
• Четкие контуры
• Высокие цифры плотности, в сравнении с губчатым веществом, но меньше, чем у компактного
• Деформирует, «раздувает » кость
• В трубчатых костях формируется деформация по типу «посоха пастуха»
• Периостальная реакция, мягкотканый компонент не выражены, деструкции кортикальной пластинки не определяется
Могут формироваться массы с экспансивным ростом
• Редко хрящевый компонент
• Высокий сигнал на T2W, симптом «матового стекла» определяется как легко минерализованное образование. КТ картина более специфична и показательна
• На МРТ могут определяться кисты, четко отграниченные, гомогенно высокий сигнал на T2W
• Фестончатый край внутренней поверхности кортикальной пластинки

• Деформирует, раздувает кость кпереди и по бокам • Высокий сигнал на T2W, низкий на T1W
• Периостальной реакции нет
• В отличие от фиброзной дисплазии – экстрамедуллярное, кортикальное образование
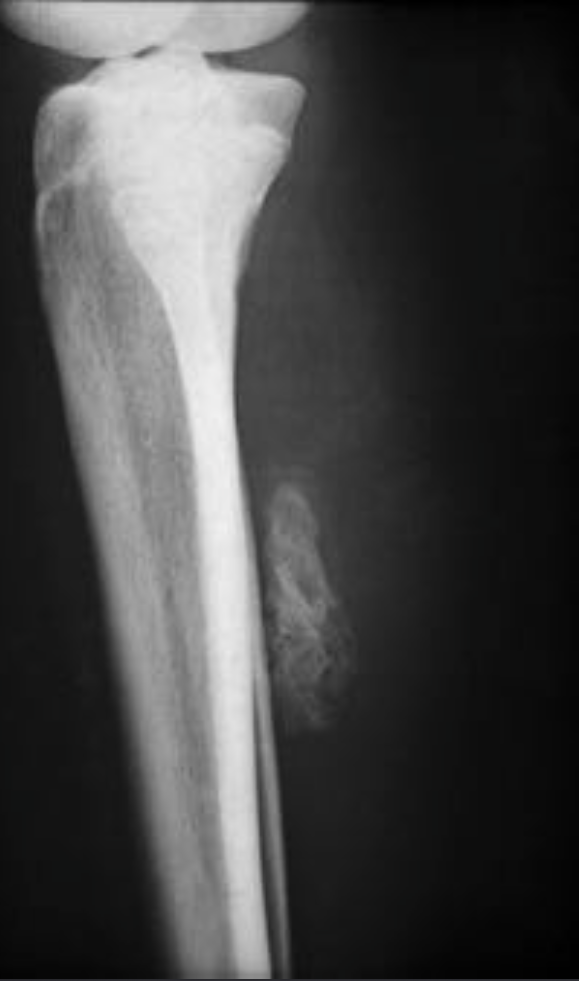
Оссифицирующий миозит (гетеротопическая оссификация).
Редкое, доброкачественное образование
• Локальное, четко-отграниченное, фиброзно-костное
• Локализуется в мышцах или других мягких тканях, сухожилиях
• Преобладают мужчины
• Могут встречаться в любом возрасте, преобладает подростковый или молодой возраст
• Чаще вовлекается нижняя конечность (четырехглавая и ягодичная мышцы)
• На ранней стадии определяется уплотнение мягких тканей
• С 4 по 6 недели – клочкообразная кальцинация по типу «вуали»
• Кортикальная пластинка не вовлекается
Инвазии костного мозга нет
• Периостальной реакции нет, при близком расположении может казаться ложная принадлежность к кости
• К 3-4 месяцу минерализуется, менее выраженная минерализация в центре, часто наблюдается периферическая кальцинация, по типу скорлупы, или может сохраняться глыбчатая кальцинация.
• На МРТ в виде негомогенной массы (высокий сигнал на T2W, stir, низкий на T1W) участки низкого сигнала на T1W, T2W, PDFS за счет кальцинации, для точной визуализации лучше выполнять T2* (GRE)
• Хрящевой ткани не содержит, что хорошо видно по T2* и PDFS
• КТ более информативна

Лангергансноклеточный гистиоцитоз.
Формы:
— эозинофильная гранулема
— Hand–Schuller–Christian заболевание (диссеминированная форма)
— Letterer–Siwe disease заболевание (диссеминированная форма)
Этиология неизвестна. Менее 1% от всех образований костей. Чаще монооссальная форма, чем полиоссальная. Может быть в любом возрасте, чаще встречается у детей. Свод черепа, нижняя челюсть, позвонки, долинные кости нижних конечностей – редко.
Ребра — чаще поражаются у взрослых
«отверстие в отверстии» — плоские кости (свод черепа), склероз по периферии
— «vertebra plana»
— при поражении длинных трубчатых костей- литическое интрамедуллярное поражение в метаэпифизе илидиафизе
— может быть кортикальная деструкция, периостальная реакция
— очень редко уровень жидкости
— низкий сигнал на T1W, высокий на T2W, stir, накапливают КВ
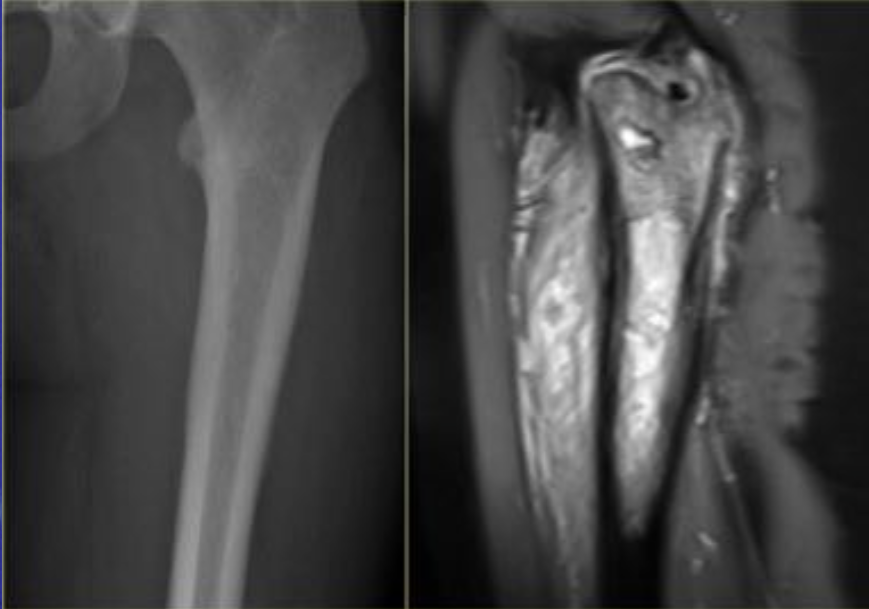

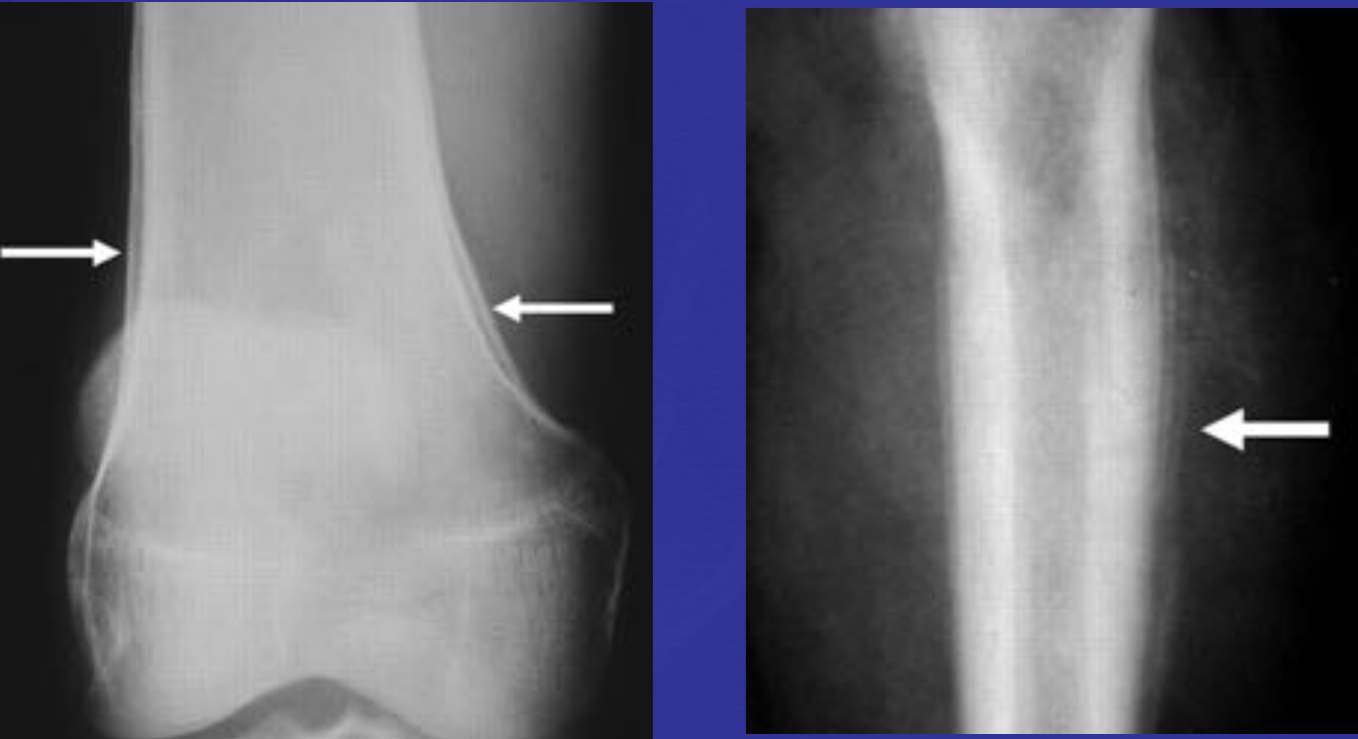
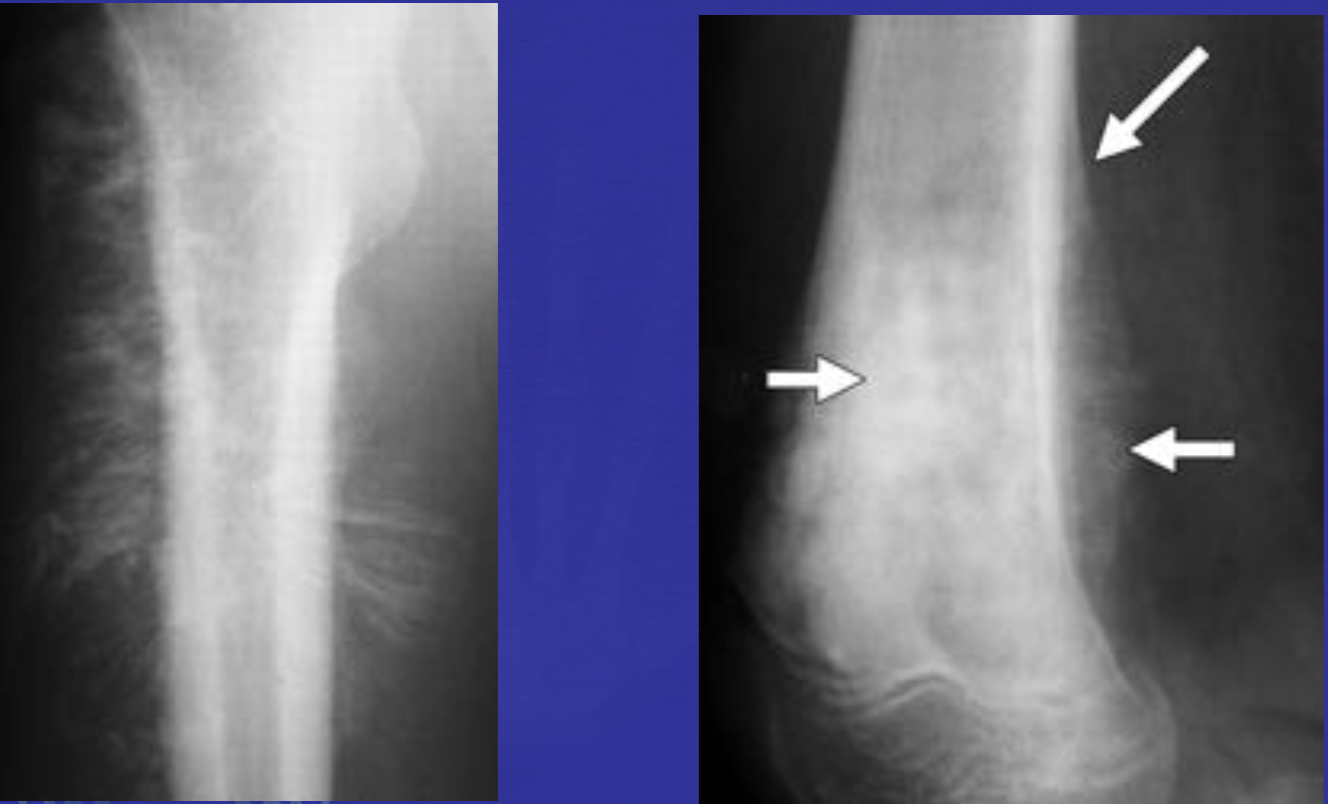
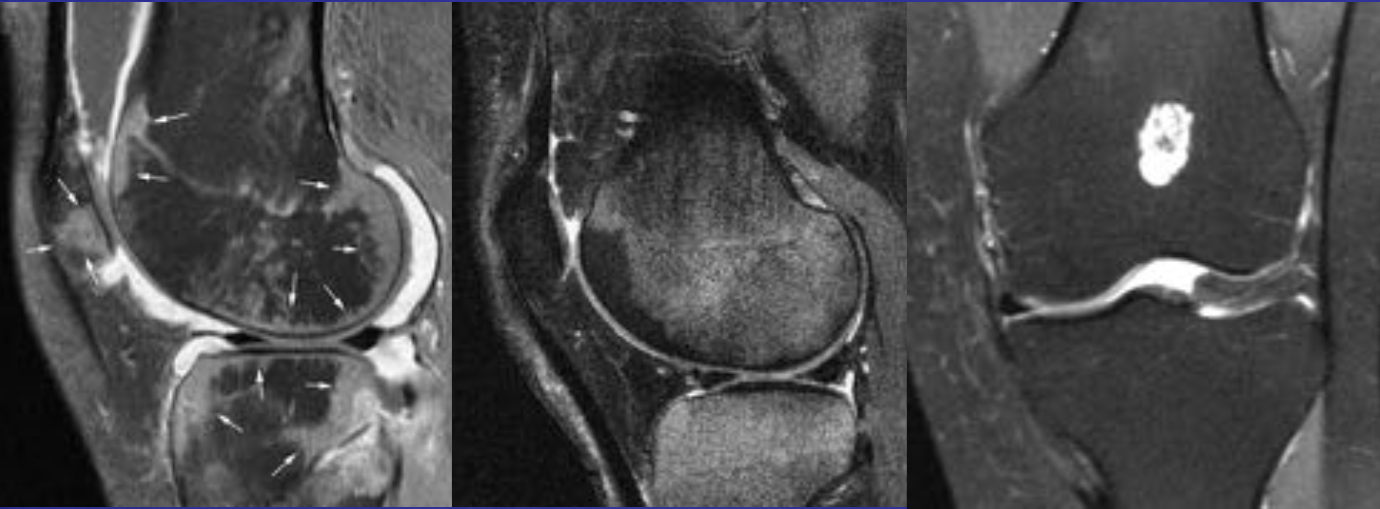
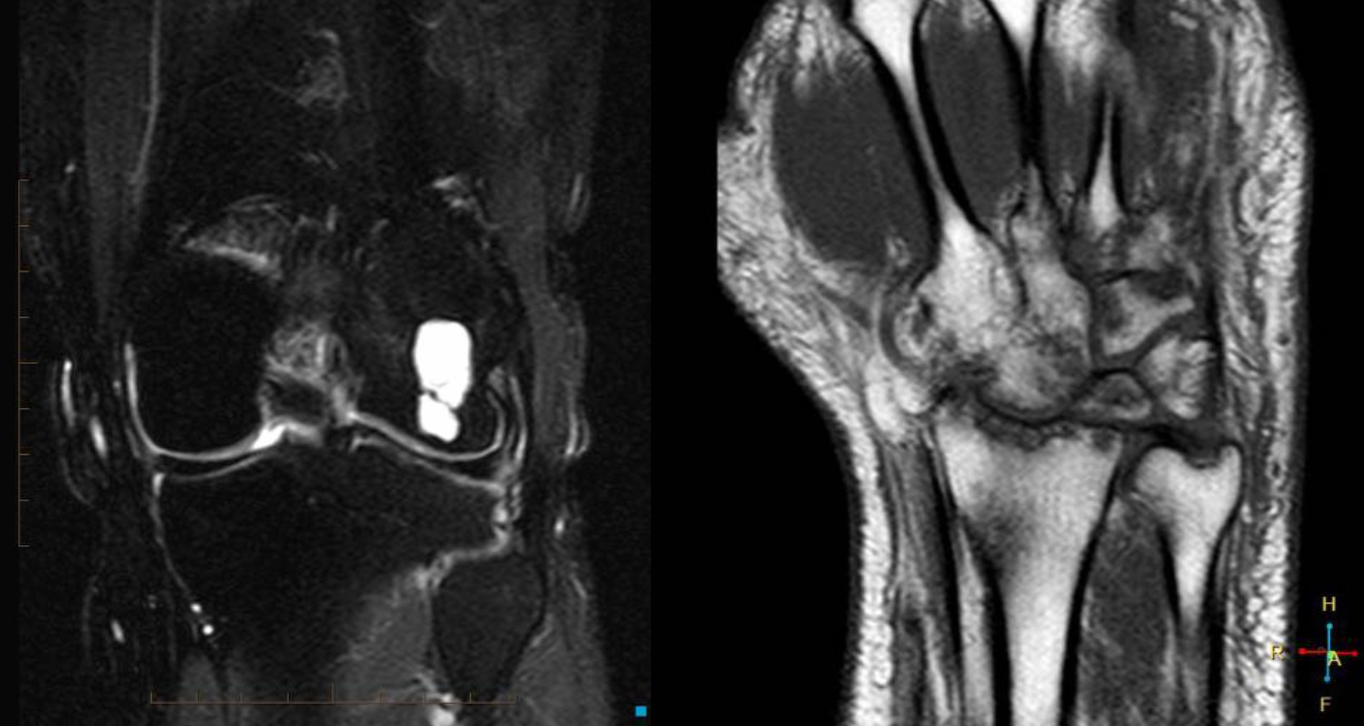

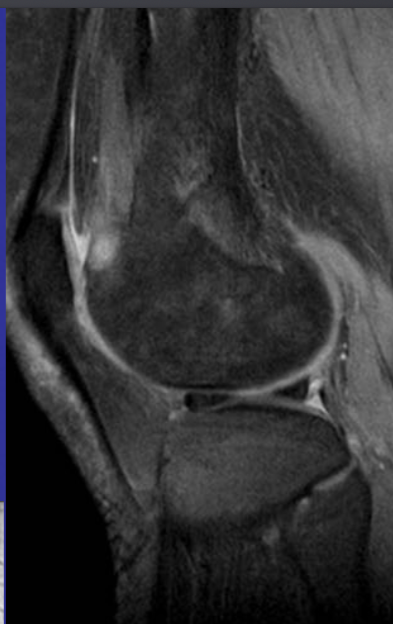
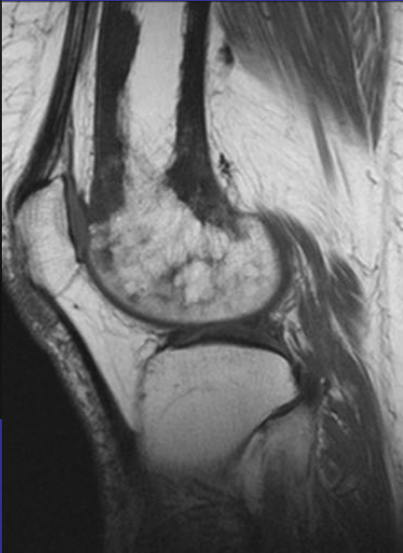
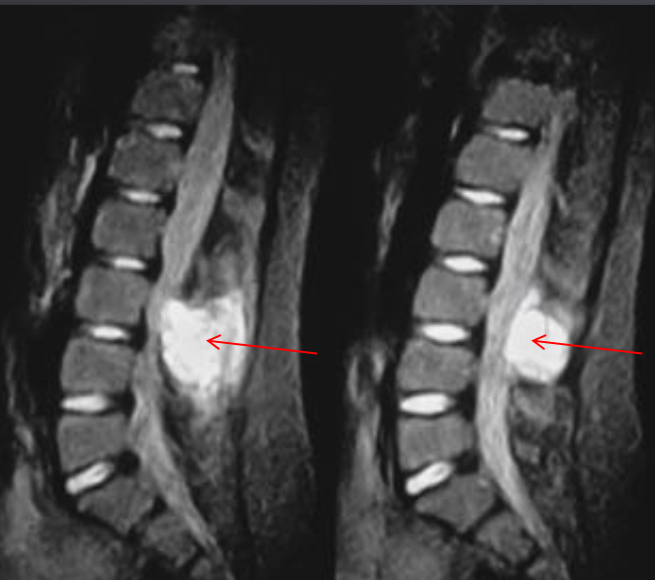 Еще один случай АКК
Еще один случай АКК