Молочнокислые бактерии снижены что значит
Молочнокислые бактерии и здоровье ребенка
Опубликовано в журнале:
«Практика педиатра», 2011 А.И. Хавкин, профессор, член-корреспондент РАЕН, ФГУ «Московский НИИ педиатрии и детской хирургии Росмедтехнологий», д-р мед. наук
К молочнокислым бактериям относятся более 15 родов бактерий, для которых характерна гомо- или гетероферментативная продукция молочной кислоты. Это грамположительные кокки, палочки или коккобациллы, неспорообразующие и не продуцирующие каталазу. Lactobacillus – лишь один из родов, относящихся к группе молочнокислых бактерий.
По сравнению с обычными бактериями молочнокислые бактерии лучше переносят условия пищеварительной системы, такие как кислотность желудочного сока и желчные кислоты. Молочнокислые бактерии, поступающие в организм извне, прилипают к слизистой оболочке кишечника и остаются в этом состоянии почти неделю. То есть колонизация носит временный характер и служит триггер-фактором развития иммунного ответа, препятствующего постоянной колонизации. Хотя экзогенные молочнокислые бактерии становятся компонентом кишечной микробной флоры, они не вытесняют другие лактобациллы. Колонизационная резистентность заключается не только в предотвращении адгезии патогенов к стенке кишечника с последующей колонизацией. Она также означает, что кишечные бактерии не проникают в кровоток и в другие стерильные участки организма.
МАЛЕНЬКИЕ ПОМОЩНИКИ
Употребление молочнокислых бактерий достоверно снижает частоту проникновения Salmonella в исследованные органы, достоверно уменьшает колонизацию Escherichia coli тонкого кишечника. Молочнокислые бактерии являются неинвазивными микроорганизмами, укрепляющими барьерные механизмы в кишечнике.
При включении ферментированного Lactobacillus GG молочного продукта в состав питания снижаются активность гидролитических ферментов, трипсическая активность в содержимом толстой кишки и мочевая экскреция токсичных соединений. Это приводит к снижению риска образования опухолей.
Отмечено, что ферментированные молочные продукты несколько увеличивают содержание воды в стуле, не влияя при этом на частоту дефекаций у здоровых людей и время транзита у пациентов, страдающих запорами.
Lactobacillus GG оказывают иммуномодулирующее воздействие на пролиферативную активность В- и Т-лимфоцитов селезенки, усиливают формирование фагоцитарных рецепторов в нейтрофильных клетках крови у здоровых, подавляя при этом ответную реакцию у гиперчувствительных к молоку при провокации. То есть пробиотические бактерии модулируют неспецифический иммунный ответ, осуществляя иммуностимуляцию у здоровых людей и даун-регуляцию у гиперчувствительных.
Результаты других исследований показали, что дети, получавшие молоко с Lactobacillus GG, имеют низкие показатели кариеса и меньшие количества стрептококков группы mutans в посевах. То есть молоко, содержащее пробиотические молочнокислые бактерии, может оказывать более благоприятное влияние на состояние зубов у детей, чем обычное молоко.
Кроме того, молочнокислые бактерии, принимаемые per os, уменьшают побочные эффекты антибиотиков. В исследовании, проведенном на здоровых добровольцах, молочнокислые бактерии в значительной степени уменьшили диарею, вызванную эритромицином, и несколько уменьшили боли в животе. При этом пациенты получали молочный продукт, ферментированный молочнокислыми бактериями или плацебо-йогурт (не содержавший живых бактерий) утром и вечером, через полчаса после приема антибиотика.
ПРОБИОТИКИ И АЛЛЕРГИЯ
Можно ли предотвратить развитие аллергических заболеваний в раннем младенческом возрасте посредством модуляции кишечной микрофлоры с помощью пробиотических бактерий? Чтобы ответить на этот вопрос, отобрали группу семей, имеющих высокий риск аллергии: наличие атопической экземы, аллергического ринита или астмы у одного или у нескольких членов семьи. 159 матерей были распределены на 2 группы, получавшие по 2 капсулы с молочнокислыми бактериями (1010 КОЕ/г) или плацебо ежедневно в течение 2–4 недель до ожидаемого срока родов. После родов пробиотические бактерии принимала кормящая мать в течение 6 месяцев или их давали младенцу в течение такого же срока. Детей обследовали до достижения ими возраста 2 лет. Сенсибилизацию к распространенным пищевым и респираторным антигенам определяли с помощью кожных аллергических проб и анализа общего и антиген-специфического IgЕ. 132 семьи с атопическими заболеваниями участвовали в исследовании вплоть до его завершения. Атопическая экзема была обнаружена у 46 из 132 детей (35%) в возрасте 2 лет, астма – у 6 детей, аллергический ринит – у 1 ребенка. Атопические заболевания развились почти у каждого второго ребенка в плацебо-группе и лишь у одного из четверых детей, получавших пробиотики. Средняя продолжительность грудного вскармливания была примерно одинаковой у детей с атопическими заболеваниями (7 месяцев) и у детей без них (6,7 месяца). Таким образом, риск аллергии у новорожденных и младенцев можно снизить, поддерживая баланс микрофлоры у матерей во время беременности. Добавление Lactobacillus GG к питанию кормящих матерей усиливает защитный эффект грудного молока.
ПРОДУКТЫ ПОЛЕЗНЫЕ И ЛЕЧЕБНЫЕ
Принято считать, что пища есть пища, а лекарство есть лекарство, и между этими понятиями нет ничего общего. В конце 1980-х годов и в особенности в середине 1990-х возрос интерес к этой неизученной области, в которой пересекаются свойства и воздействия пищи и лекарств. Существуют продукты, полезные для здоровья, и эта польза отнюдь не исчерпывается их питательной ценностью. Такие продукты способны поддерживать наше здоровье, оказывая терапевтический эффект. В России разработаны и выпускаются пробиотические кисломолочные продукты для детского питания Тёма: творог для детей с 6 месяцев, йогурт и кефир для детей с 8 месяцев, обогащенные Lactobacillus GG. Для питания детей старшего возраста, беременных и кормящих мам производятся пробиотические кисломолочные продукты Био Баланс, содержащие Lactobacillus GG, эффективность которых подтверждена многочисленными международными исследованиями. Отмечено, что молоко и, очевидно, другие защитные соединения, имещиеся в пище, улучшают выживаемость молочнокислых бактерий при прохождении через желудок, обеспечивая буферный эффект. Тогда как содержание молочнокислых бактерий в лекарственных средствах (в форме порошка или капсулах) должно быть более высоким (около 1010 КОЕ/день), чем в молочных продуктах (108–109 КОЕ/день). Например, у здоровых детей потребление молока даже с низким содержанием молочнокислых бактерий (108 КОЕ/день) позволяет снизить риск респираторных инфекций и кариеса. Вопрос о том, в какой форме пациент будет принимать пробиотик – с пищей или как лекарственное средство, – должен быть решен в зависимости от индивидуального предпочтения.
Роль молочнокислых бактерий в здоровье человека
Молочнокислые пробиотические бактерии можно широко использовать для профилактики и лечения больных с различными заболеваниями (острыми и хроническими заболеваниями желудочно-кишечного тракта, дыхательных путей, для восстановления кишечного микробиоценоза
Lactic acid probiotic bacteria can be widely used for prevention and treating the patients with different diseases (acute chronic diseases of gastrointestinal tract, respiratory tract, for restoring intestinal microbiocenosis and others).
.jpg)
Первым из исследователей, предположившим, что некоторые бактерии совсем не губительны для человека, а напротив, могут оказывать позитивное влияние на здоровье, был знаменитый русский ученый Илья Ильич Мечников. Еще в самом начале XX в. он провел исследования по возможности восстановления кишечной микрофлоры с помощью молочнокислой палочки. В результате серьезных и кропотливых исследований ученым были изучены свойства бактерии, которую он назвал «болгарской палочкой» (в современной классификации — Lactobacillus bulgaricus), а также разработан рецепт кисломолочного напитка — прообраза современного йогурта. Сам И. И. Мечников, его коллеги и знакомые на протяжении многих лет регулярно употребляли этот напиток, который также называют «мечниковской простоквашей», и на собственном опыте смогли убедиться в его полезных качествах.
В настоящее время известны разнообразные положительные эффекты молочнокислых пробиотических бактерий, подтвержденные многочисленными клиническими исследованиями. Прежде всего необходимо отметить, что эти бактерии играют важную роль в поддержании колонизационной резистентности, то есть оказывают выраженную антагонистическую активность в отношении патогенных микроорганизмов, продуцируя различные органические кислоты, перекись водорода, антибиотики и бактериоцины [5]. Некоторые представители молочнокислых пробиотических бактерий (например, L. acidophilus) вырабатывают высокоактивную перекись водорода, благодаря чему оказывают выраженное вирусоцидное действие в отношении вируса иммунодефицита человека [6].
Несмотря на то, что еще в начале прошлого века И. И. Мечников предположил, что молочнокислые бактерии способны повышать устойчивость организма человека к различным заболеваниям, лишь в последние десятилетия была доказана теория об иммуномодулирующем влиянии этих микроорганизмов. Было установлено, что некоторые штаммы молочнокислых бактерий способны оказывать иммуностимулирующее действие, способствуя выработке в кишечнике цитокинов (в том числе интерлейкинов-1, 6, 10, фактора некроза опухоли альфа), антител, стимулировать синтез интерферона гамма лимфоцитами, а также повышать активность фагоцитов и естественных клеток-киллеров (NK-клеток) [6–9]. Таким образом, была доказана способность пробиотиков усиливать устойчивость организма человека к определенным заболеваниям. Так, молочнокислые пробиотические бактерии эффективны для профилактики широко распространенных зимних инфекций, обусловленных различными респираторными вирусами. Существуют данные, что при употреблении L. bulgaricus OLL1073R-1 в составе йогуртов снижается риск заражения простудными заболеваниями у пожилых людей, так как этот штамм дополняет естественную активность NK-клеток [10]. В исследовании, включавшем более 1000 взрослых добровольцев, было показано снижение продолжительности острых респираторных заболеваний у лиц, в течение 3 месяцев употреблявших ежедневно по 200 мл кисломолочного пробиотического продукта (Actimel), который содержит штамм L. casei DN-114001 [11]. Положительный эффект сохранялся даже спустя месяц после окончания приема. Американскими исследователями была предпринята попытка определить, как влияет употребление молочнокислых пробиотических бактерий на инфекционные заболевания у детей. В группе, получавшей L. casei DN-114001 (Actimel), заболеваемость была достоверно ниже, чем при употреблении плацебо [12]. Похожие данные были получены и российскими учеными [13].
Человеческому организму постоянно приходится адаптироваться в ответ на изменения, связанные с влиянием факторов окружающей среды и образа жизни. Старение, стресс, интенсивные физические тренировки, проживание в мегаполисе и даже холодная погода — все это негативно влияет на организм человека. Последнее подтверждают эпидемиологические данные о том, что число респираторных заболеваний и диарей в зимние месяцы увеличивается. S. Nagata и соавт. провели исследование для оценки эффективности приема кисломолочных продуктов, содержащих L. casei Shirota, при норовирусных гастроэнтеритах в зимний период у пожилых людей (средний возраст пациентов — 84 года). Установлено, что непрерывный прием кисломолочного продукта с L. casei Shirota уменьшает выраженность и длительность проявления симптомов лихорадки, вызванной норовирусным гастроэнтеритом, а также корректирует дисбаланс кишечной микрофлоры, свойственный пожилым людям [14].
Прием молочнокислых пробиотических бактерий эффективен и при диареях. Так, в восьми рандомизированных плацебо-контролируемых исследованиях с общим числом участников 988 человек была изучена эффективность продуктов питания, содержащих L. rhamnosus GG, при острых кишечных инфекциях (ОКИ). Было получено достоверное сокращение сроков проявления клинических симптомов ОКИ в среднем с 3,5 до 2,5 дней, по сравнению с группой пациентов, получавших плацебо [15, 16]. В работах профессора А. В. Горелова и соавт. показана клиническая эффективность L. casei DN-114001 (Actimel) в комплексной терапии ОКИ у детей старше 3 лет — длительность лихорадки, диарейного синдрома и сроки госпитализации у детей, его употреблявших, были достоверно меньше по сравнению с детьми, получавшими плацебо [17].
Еще одним направлением, при котором доказана эффективность молочнокислых пробиотических бактерий, является антибиотик-ассоциированная диарея (ААД), которая возникает при нарушении состава и активности нормальной микрофлоры желудочно-кишечного тракта человека. У взрослых для профилактики ААД, вызванной Clostridium difficile, хорошую эффективность показал прием Actimel, содержащего пробиотический штамм L. сasei DN 114001 [18]. У детей молочнокислые бактерии, принимаемые внутрь, способны предотвращать возникновение диарей или уменьшать побочные эффекты, связанные с приемом антибиотиков (например, амоксициллина) [19]. Выявлено положительное влияние штамма L. сasei DN 114001 и при проведении эрадикационной терапии инфекции H. pylori у детей [20].
Иммуномодулирующие свойства молочнокислых бактерий способны уравновесить дисбаланс в иммунных реакциях, вызывающих аллергические реакции у детей. При употреблении детьми с аллергией кисломолочных продуктов, содержащих L. gasseri CECT5714 и L. coryniformis CECT5711, в течение 3 месяцев выявлено значительное снижение уровня IgE в плазме крови и существенное увеличение CD 4+ /CD 25+ T-регуляторных клеток, секреторного IgA и NK-клеток. Таким образом, употребление молочнокислых пробиотических бактерий способно благотворно влиять на иммунные параметры, участвующие в аллергической реакции [21].
Молочнокислые пробиотические бактерии положительно влияют на уровень холестерина в сыворотке крови — в некоторых исследованиях показано, что при их употреблении происходит снижение общего холестерина и липопротеинов низкой плотности, улучшение функции печени [22, 23].
Наконец, нормализация кишечной микрофлоры способствует нормализации кишечного пассажа. Было показано, что регулярный прием Bifidobacterium animalis DN-173 010 (Активиа) пациентами с синдромом раздраженного кишечника, сопровождающегося запорами, уменьшает время транзита по кишечнику, увеличивает частоту дефекаций и улучшает качество жизни таких пациентов [24–27].
Таким образом, молочнокислые пробиотические бактерии можно широко использовать для профилактики и лечения больных с различными заболеваниями (острыми и хроническими заболеваниями желудочно-кишечного тракта, дыхательных путей, для восстановления кишечного микробиоценоза и др.). Форма приема этих микроорганизмов разнообразна (кисломолочные продукты, лекарственные препараты, биологически активные добавки), причем при выборе необходимо руководствоваться прежде всего тем, что положительное действие на организм человека должно быть клинически доказано не только для самих молочнокислых пробиотических бактерий, но и для готовых продуктов, содержащих эти бактерии.
Литература
С. В. Николаева, кандидат медицинских наук
ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Москва
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Нормальная микробная флора кишечника
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
Клинические особенности дисбактериоза
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз. Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
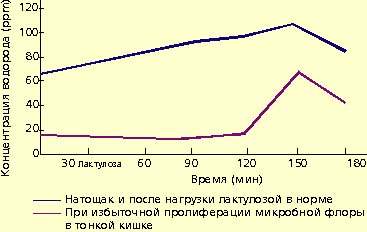 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
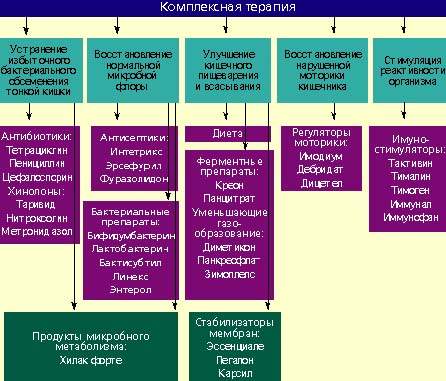 |
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.