в каком растворе фенолфталеин становится малиновым в растворе
В каком растворе фенолфталеин становится малиновым в растворе
Большинству людей известны термины «кислый» или «щелочной» из обычных бытовых веществ, но функция индикаторов pH гораздо более продвинутая. Один такой индикатор, фенолфталеин, обычно бесцветен, но варьируется от розового до пурпурного при воздействии щелочных растворов.
Что такое фенолфталеин?
В 1871 году известный немецкий химик Адольф фон Байер открыл фенолфталеин, слабокислое соединение с химической формулой C20H14O4. Это соединение в основном служит индикатором рН, позволяя химикам легко проверить, является ли вещество кислотой или основанием. В прошлом медицинские работники также использовали фенолфталеин в качестве слабительного, но его резкие побочные эффекты и потенциал в качестве канцерогена (канцерогенного агента) побудили Управление по контролю за продуктами и лекарствами запретить его для этого использования в 1999 году.
Фенолфталеин и шкала рН
Шкала рН колеблется от 0 до 14, при этом кислотные вещества регистрируют менее 7 по шкале, а щелочные вещества регистрируют более 7 по шкале. Значение 7 указывает на нейтральный pH, такой как чистая вода. В обычной практике химики используют лакмусовую бумагу для измерения pH соединения; бумага становится красной при погружении в кислоты и синей при погружении в основания.
Фенолфталеин работает несколько иначе, поскольку он естественно бесцветен, но становится розовым в щелочных растворах. Соединения остаются бесцветными во всем диапазоне кислотных уровней рН, но начинают розоветь при уровне рН 8,2 и становятся ярко-фиолетовыми в более сильных щелочах.
Как фенолфталеин меняет цвет
Изменение цвета этого соединения происходит через процесс, называемый ионизацией. Ионизация происходит, когда молекула приобретает или теряет электроны, давая молекуле отрицательный или положительный электрический заряд. Ионизированные молекулы притягивают другие молекулы с противоположным зарядом и отталкивают те, которые имеют такой же заряд. С фенолфталеином это также влияет на форму молекулы.
Сочетание формы и электрического заряда определяет, как молекула реагирует на свет. Обычно фенолфталеин прозрачен, потому что через него проходят все цвета света. При воздействии щелочных растворов он начинает блокировать синие цвета спектра, который превращается в светло-розоватый. Чем сильнее щелочной раствор, тем больше изменяется молекула фенолфталеина и тем темнее будет розовый оттенок.
В каком растворе фенолфталеин становится малиновым в растворе
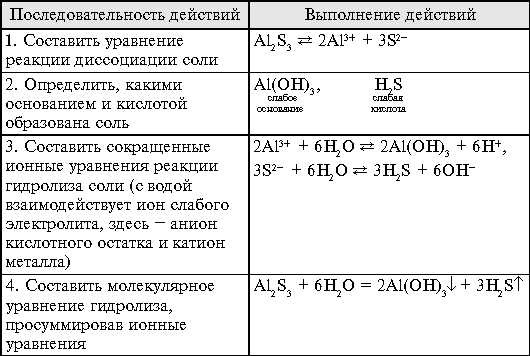
Полный гидролиз
Задания для самоконтроля
1. Какие из перечисленных солей подвергаются гидролизу: хлорид калия, нитрат меди(II), сульфид натрия, хлорид железа(III), сульфат цинка? Напишите уравнения, отвечающие гидролизу.
2. Какими индикаторами можно распознать каждую из предложенных солей? Объясните причину изменения цвета индикаторов, составьте соответствующие уравнения реакций:
а) карбонат натрия, хлорид натрия, сульфат цинка;
б) сульфид натрия, сульфат калия, хлорид алюминия;
в) карбонат калия, хлорид калия, хлорид алюминия;
г) сульфат натрия, сульфит калия, нитрат алюминия.
2. Изменение окраски индикаторов в растворах солей:
а) Na 2CO3 – бесцветный фенолфталеин становится малиновым из-за присутствия ионов ОН – в растворе;
NaCl – не изменяет окраску индикаторов;
ZnSO4 – дает кислую среду, и cиний лакмус становится красным от ионов H + в растворе.
Уравнения реакций гидролиза:
б) Na 2S – щелочная среда раствора, фенолфталеин становится малиновым;
K2SO4 – не изменяет окраску индикаторов;
AlCl3 – дает кислую среду в растворе и окрашивает желтый метилоранж в розовый цвет.
Уравнения реакций гидролиза:
в) K 2CO3 – фенолфталеин становится малиновым, т. е. среда раствора щелочная;
KCl – не изменяет окраску индикаторов;
AlCl3 – дает кислую среду в растворе и окрашивает синий лакмус в красный цвет.
Уравнения реакций гидролиза:
г) Na 2SO4 – не изменяет окраску индикаторов;
К2SO3 – дает щелочную реакцию в растворе и окрашивает фенолфталеин в малиновый цвет;
Al(NO3)3 – дает кислую среду и окрашивает синий лакмус в красный цвет.