в каком случае наступает равновесие в реакции при постоянных давлении и температуре ответ
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Содержание:
В химии есть обратимые и необратимые химические реакции. Они протекают по разному принципу и имеют свои особенности. Равновесие в реакции способно смещаться под воздействием определенных факторов.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами.
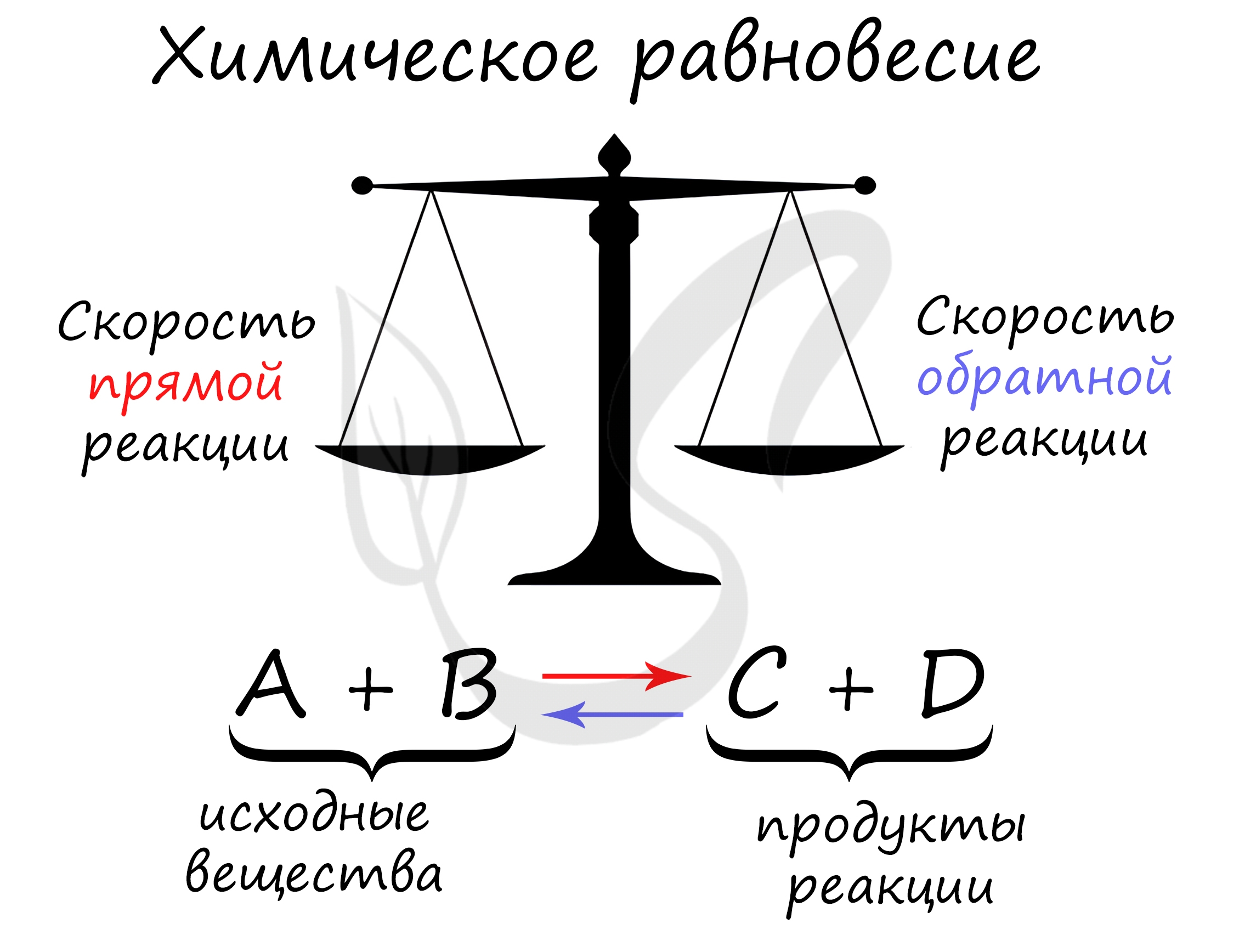
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: [A], [B], [C], [D]. Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= [C] x ×[D] y /[A] a ×[B] b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Смещение химического равновесия под действием различных факторов
О подвижности равновесия говорили ученые еще в XIX веке. В то же время активно проводились исследования, чтобы доказать свои предположения. Анри Ле-Шателье был первым, кто попытался рассказать об этом в своих трудах. Позже его исследования обобщил Карл Браун. Принцип Ле-Шателье говорит о:
Если на систему, находящуюся в равновесии оказывается влияние, то равновесие смещается в ту сторону, которое ослабляет это влияние
Влияние температуры
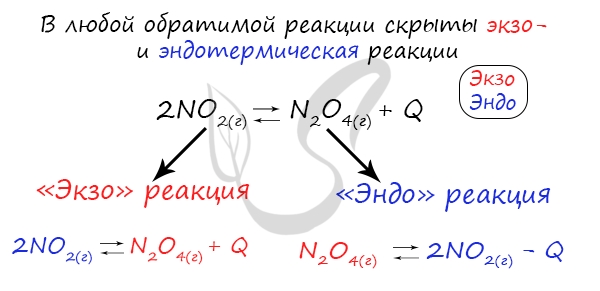
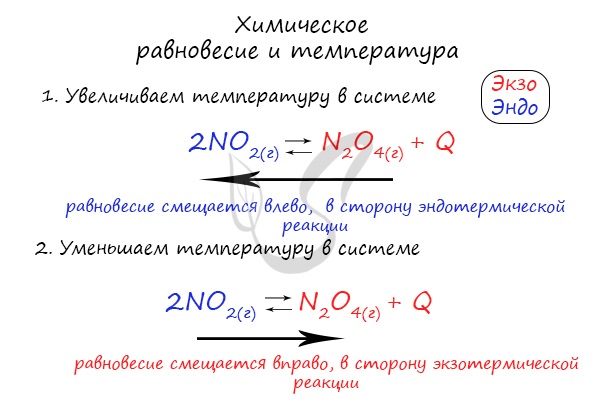
В обратимых реакциях прямая и обратная сторона процесса противоположны по температуре друг другу. В зависимости от температурного коэффициента реакции подразделяются на экзотермические (температура в процессе реакции выделяется). При повышении температуры в такой системе равновесие будет смещаться в сторону обратной реакции.
Эндотермические реакции (которые протекают при нагревании) наоборот, если нагревать такую реакцию, то будет протекать быстрее прямая реакция.
Это значит, если в прямой стороне наблюдается показатель +Q-экзотермический процесс, то в обратной будет –Q – эндотермический процесс. Если увеличить температуру исходных продуктов, то химическое равновесие сместиться в ту сторону, в которой наблюдается пониженная температура.
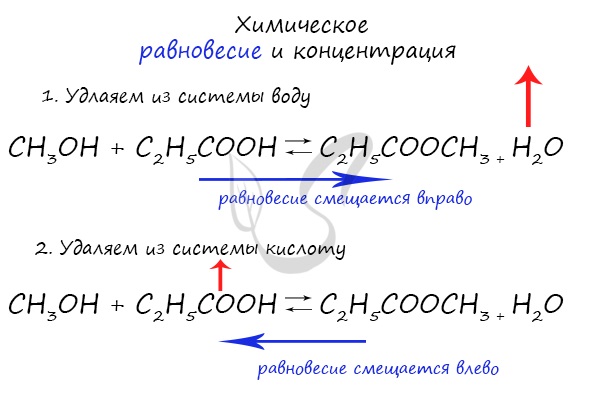
Влияние концентрации
По принципу Ле-Шателье, увеличение концентрации реагентов вызывает смещение равновесие в сторону, где они расходуются, в прямом процессе. А если концентрация веществ понижается, то химическое равновесие снижается в сторону обратных процессов.
Такой же принцип действует и на увеличение концентрации продуктов реакции. Химическое равновесие смещает в ту сторону, где происходит расход реагентов, значит в сторону обратной реакции. Если концентрацию продуктов понизить, то равновесие сместиться в сторону прямого процесса.
Влияние давления
Давление меняет равновесие не во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Важно! На состояние равновесия процессов с твердыми веществами давление не влияет.
При разной концентрации газообразных веществ слева и справа реакции, повышение давления приведет к смещению химического равновесия. Смещается в ту сторону, где количество газообразных веществ уменьшается, а показатели давления повышаются.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки, в виде соединений и комплексов, которые ускоряют процесс образования продуктов. Их добавление никак не влияет на химическое равновесие. В некоторых процесс способствует быстрому уравновешиванию сторон.
Таблица химического равновесия
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В каком случае наступает равновесие в реакции при постоянных давлении и температуре ответ
ЕГЭ по химии и биологии. запись закреплена
Задания на химическое равновесие
Химическое равновесие и принципы его смещения (принцип Ле Шателье)
1. Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
2. При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
3. При увеличении давления равновесие смещается в сторону уменьшения количества газообразных веществ, то есть в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания количеств газообразных веществ, то есть в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе.
За принципы благодарим пособие «Начала химии» Кузьменко Н.Е., Еремин В.В., Попков В.А.
Задания ЕГЭ на химическое равновесие (ранее А21)
Химическое равновесие в системе
Сместится в сторону продуктов реакции при
1. Повышении давления
2. Повышении температуры
3. Понижении давления
4. Использовании катализатора
Химическое равновесие в системе
сместится в сторону образования реагентов при:
1. Увеличении концентрации NO
2. Увеличении концентрации SO2
3. Повышении температуры
4. Увеличении давления
2NO2(г) 
смещению равновесия влево будет способствовать
1. Увеличение давления
2. Увеличение концентрации N2O4
3. Понижение температуры
4. Введение катализатора
равновесие сместится в сторону продуктов реакции при
1. Повышении давления
2. Добавлении катализатора
3. Добавлении железа
сместится в сторону образования продуктов в случае
1. Повышения давления
2. Повышения температуры
3. Увеличения времени протекания процесса
4. Применения катализатора
При повышении давления химическое равновесие сместится в сторону продуктов в системе:
3. N2(г) + 3H2(г) 
Не влияет на смещение равновесия
1. Повышение давления и добавление катализатора
2. Повышение температуры и добавление водорода
3. Понижение температуры и добавление йодоводорода
4. Добавление йода и добавление водорода
Для смещения вправо равновесия в реакции
2NO(г) + O2(г) 
В каком случае наступает равновесие в реакции при постоянных давлении и температуре ответ
Для удобства пользователей и возможности быстрого нахождения решения типовых (и не очень) задач на химическое равновесие
©Для некоммерческого использования. При перепечатке решений обязательна ссылка на источник.
Всем успеха!
Задача 1
Константа равновесия гомогенной системы СО(г) + H2О(г) = СО2(г) + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации [СО]исх= 0,10 моль/л; [H2О]исх = 0,40 моль/л.
Ответ: [CO2]P = [H2]P = 0,08 моль/л; [CO]P = 0,02 моль/л; [H2O]P = 0,32 моль/л.
Решение:
СО(г) + H2О(г) ↔ СО2(г) + Н2(г)
В реакции нет коэффициентов, поэтому константа равновесия = отношению произведения концентраций продуктов к произведению концентраций исх. веществ в состоянии равновесия: <[СО2]P * [Н2]P>/
Осталось показать на примере.
Задача 2 (продолжение)
Пример 5:
Допустим, в закрытом сосуде есть равновесная система: N2 (г) + 3Н2 (г) ↔ 2NН3 (г) + Q (ΔH 0, или +Q (добавление тепла) в исходных веществах. Например, для эндотермической реакции А + Б ↔ В можно записать двумя способами:
1) А + Б ↔ В ΔН>0 ( ΔН всегда относится к прямой реакции!)
2) А + Б +Q ↔ В
Задача 3
При температуре 500 К для реакции СO(газ) + H20(газ) ↔ С02(газ) + H2(газ) Кc= 1.
Исходные концентрации С0,H20,С02 и H2 равны соответственно (моль/л): 0,8; 0,8; 1,4 и 1. Определите направление процесса, протекающего в системе при этих условиях, и концентрации всех веществ после достижения системой сост. равновесия (V=const).
Решение:
СO(г) + H20(г) ↔ С02(г) + H2(г) Кc 500К = 1
исходные концентрации:
[С0]=0,8 моль/л
[H20]=0,8 моль/л
[С02]= 1,4 моль/л
[H2]= 1,0 моль/л
Константа равновесия Кeq = произведение концентраций продуктов, деленное на произведение концентраций исх. в-в:
Кeq = ( [С02] • [H2] ) / ( [С0] • [H20] ) = 1
Допустим, с момента начала реакции и до достижения равновесия [С0] увеличилась на Х моль/л, тогда и [H20] увеличилась на Х моль/л (их соотношение в ур. р-ции 1:1), [С02] и [H2] соответственно уменьшились на Х моль/л.
Задача 4
Напишите выражение константы равновесия для реакции: О2+4НСl⇆2Н2О+2Сl2.
Все вещества газы. Как надо изменить температуру и давление, чтобы увеличить выход хлора? Прямая реакция экзотермическая.
Решение:
Kc=[Н2О]²∙[Сl2]² / ([О2]∙[НСl]^4)
или через парциальные давления: Kр=Р(Н2О)²∙Р(Сl2)² / [Р(О2)∙Р(НСl)^4]
Хлор получается в рез. прямой реакции.
Задача 5
FeCl3+3NH4CNS=Fe(CNS)+3HN4Cl
Добавим в пробирку NH4CNS, раствор приобретает малиновый цвет. В какую сторону сместится равновесие?
Задача 6
Как изменится равновесие в системе при повышении температуры и давления в газовой смеси: PCl5 ⇆ PCl3 + Cl2, ΔH=92,6 кДж/моль?
Решение:
По принципу Ле-Шателье, при нагревании равновесие сместится в ту сторону, где тепло поглощается (чтобы уменьшить воздействие). Прямая реакция идет с поглощением тепла (ΔН >0), поэтому равновесие сместится в сторону прямой реакции.
Задача 7
Для реакции 4NH3+3O2⇆2N2+6H2O(ж) – Q определите в каком направлении сместится равновесие при увеличении концентрации воды.
Задача 9
Для обратимой гетерогенной реакции, выраженной термохимическим уравнением
CF4(г) ⇆ C(графит) + 2F2(г), ΔН>0, определить направление сдвига равновесия, если:
а) увеличивается концентрация газообразного продукта
б) увеличивается давление
в) увеличивается температура
Ответ:
а) влево
б) влево
в) вправо
Решение:
Тут нужно знать правило фаз.
Фаза Ф- это совокупность всех гомогенных частей гетерогенной системы,
отделенная от других частей системы четкими поверхностями раздела
(межфазными границами). Химический состав и свойства остаются постоянными внутри объема, занимаемого фазой. При переходе через межфазную границу состав и свойства меняются скачком. Поскольку газы полностью смешиваются друг с другом, в системе может быть только одна газовая фаза, но много твердых и жидких несмешивающихся фаз.
Правило фаз Гиббса: С + Ф = К + 2
С=К+2-Ф = 3+2-3=2
Задача 12
Составьте выражение для константы равновесия реакции,протекающей в закрытой системе (T=const):
2 NH3(г) + 3 Cl2(г) ⇆ N2(г) + 6 НСl(г)
Укажите в сторону какой реакции сместится при следующий изменениях:
а) концентрация HCl уменьшена в 6 раз;
б) концентрация Сl2 увеличина в 3 раза;
в) концентрация NH3 и N2 увеличина в 2 раза.
Решение:
Kc = [N2] ∙ [НСl]^6 / ([NH3]² ∙ [Cl2]^3)
Δ[NH3] = [NH3 t] – [NH3 o] = 0,5–0=+0,5М
Отношение количеств в-в в реакции 1:3:2.
Тогда Δ[N2] = –Δ[NH3]/2 = –0,5/2 = –0,25 М
[N2 t] = [N2 o] + Δ[N2] = 1,5 +(– 0,25) = 1,25 М
Δ[Н2 t] = –Δ[NH3]∙3/2 = –0,5∙3/2 = –0,75 М
[N2 t] = [N2 o] + Δ[N2] = 2,5 +(– 0,75) = 1,75 М