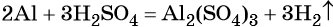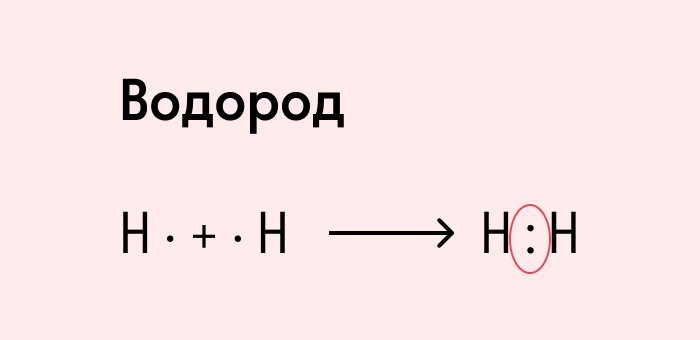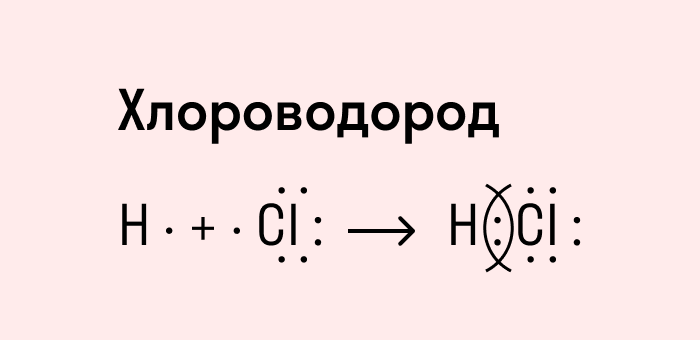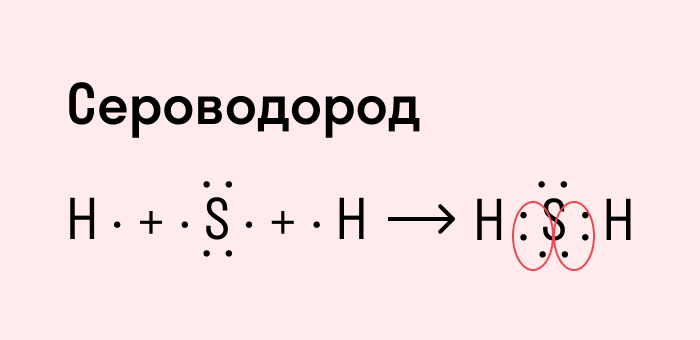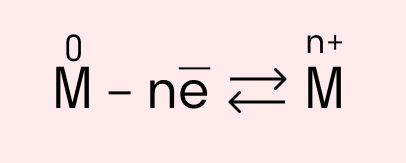в каком случае происходит взаимодействие молекул друг с другом и происходит химическая реакция
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
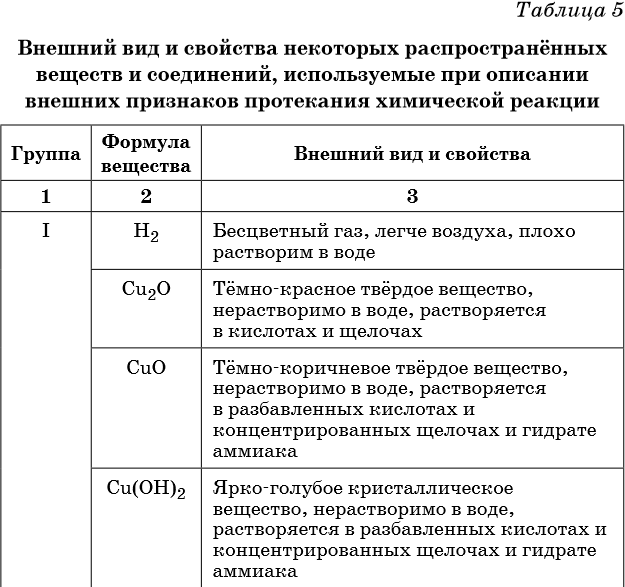
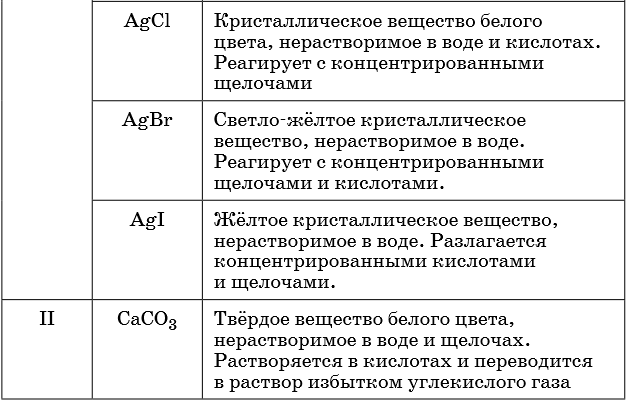
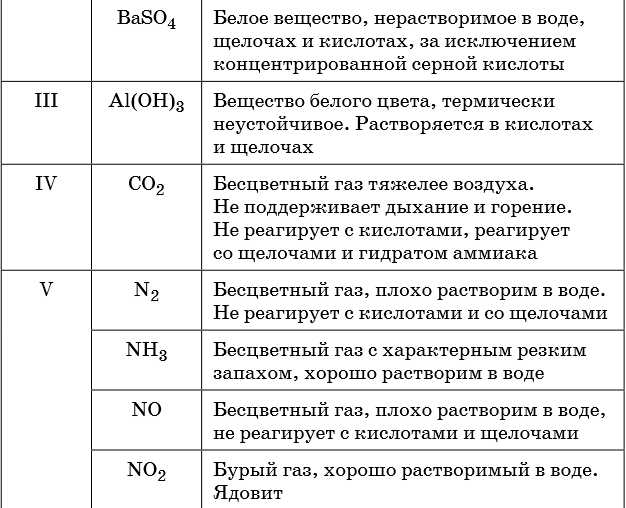
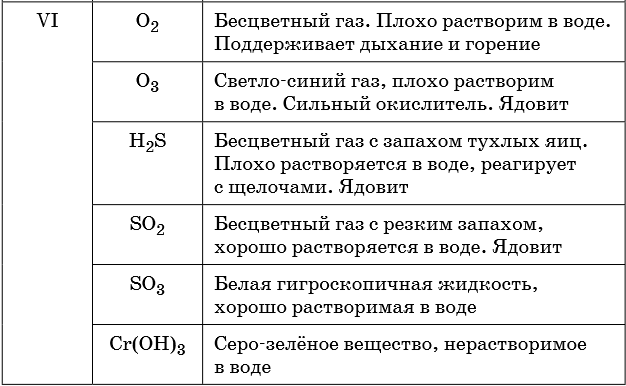
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Химическая связь
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
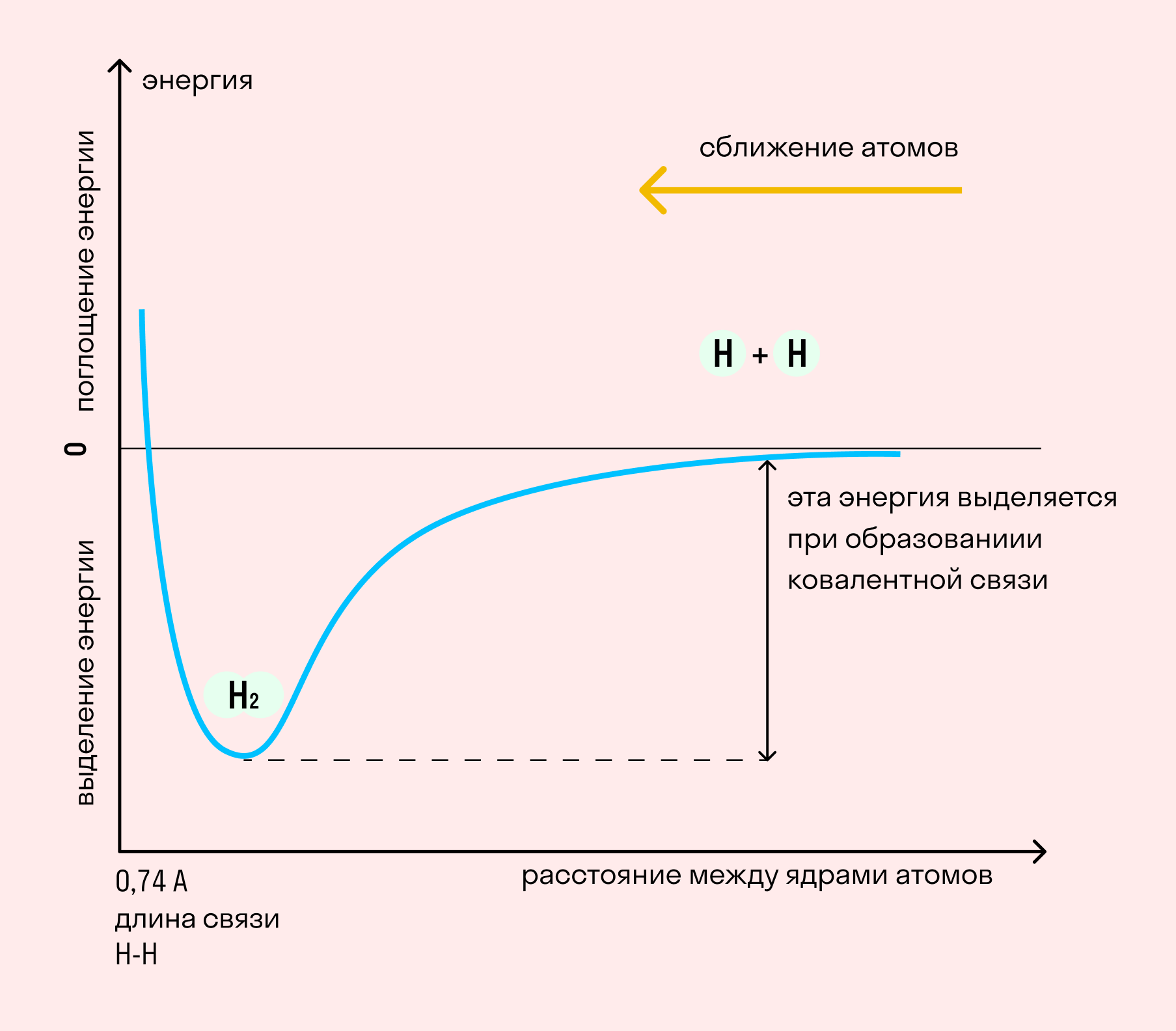
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
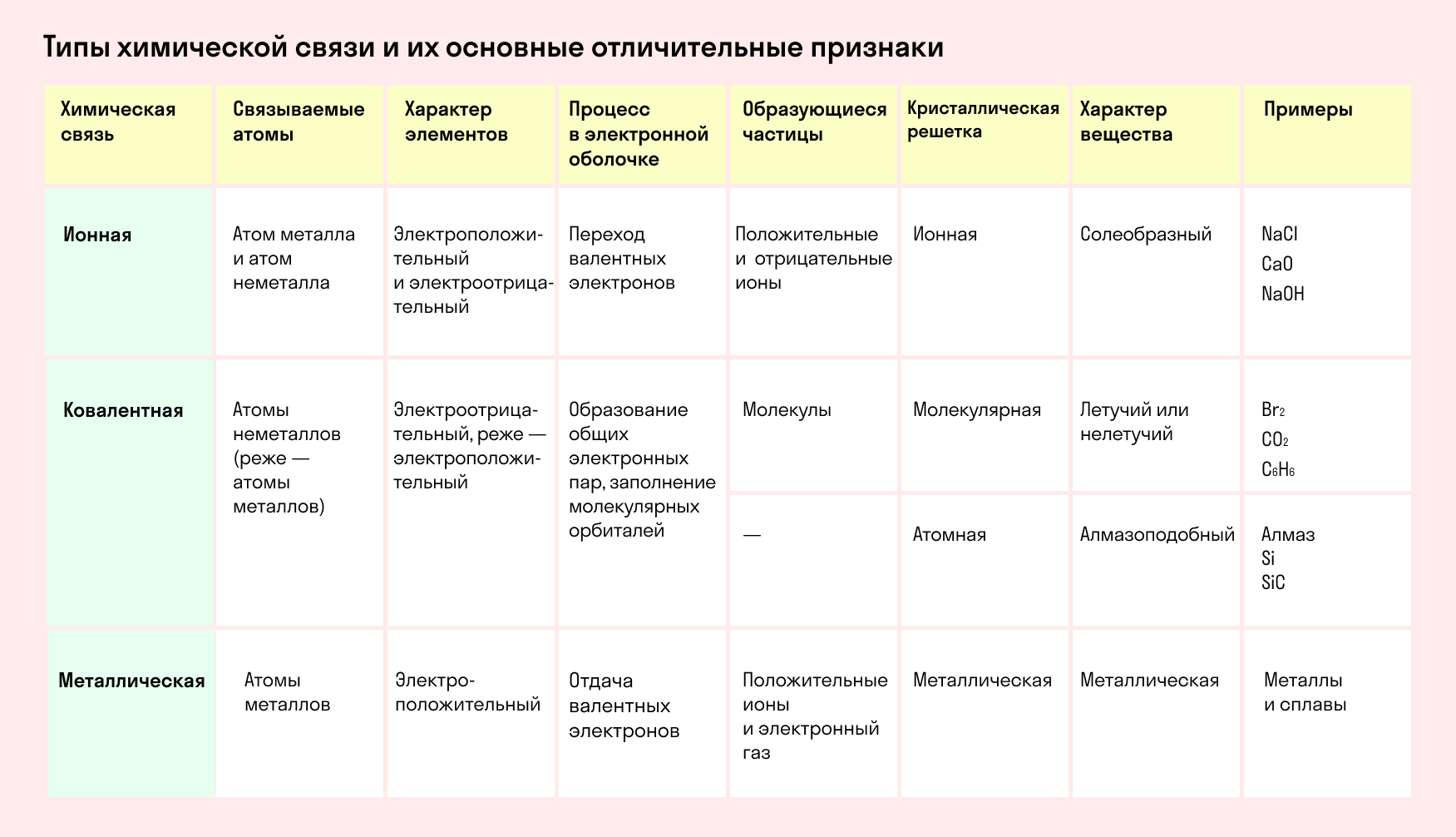
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
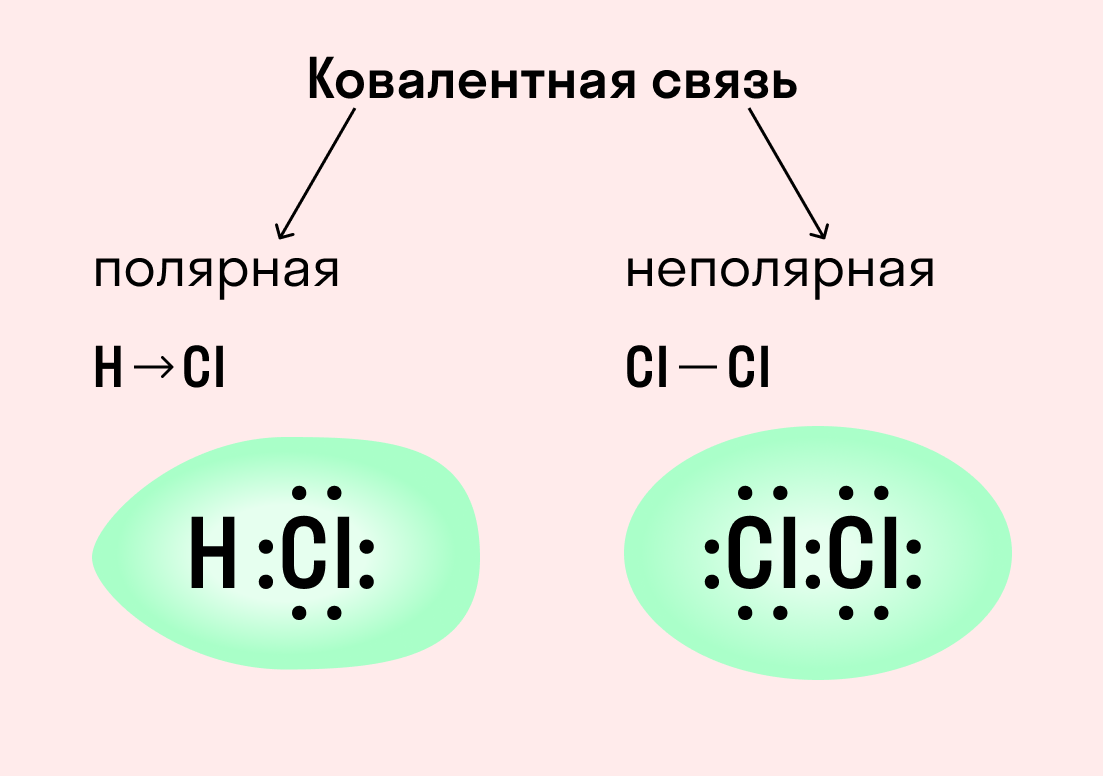
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
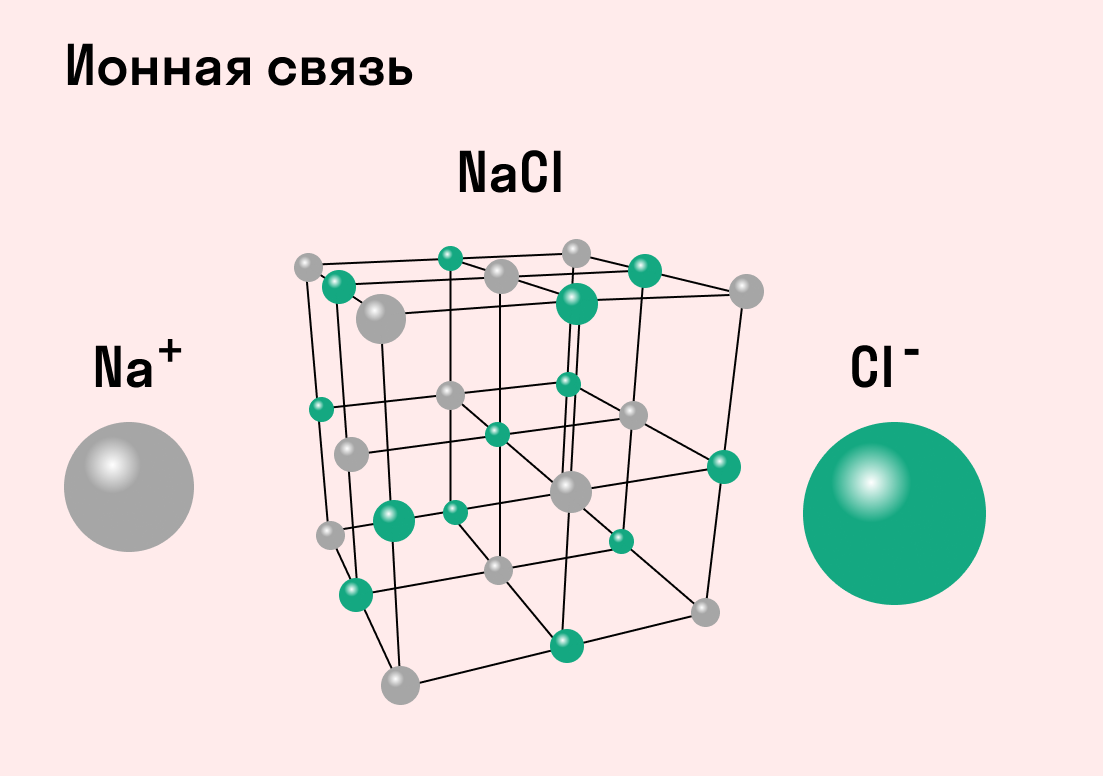
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
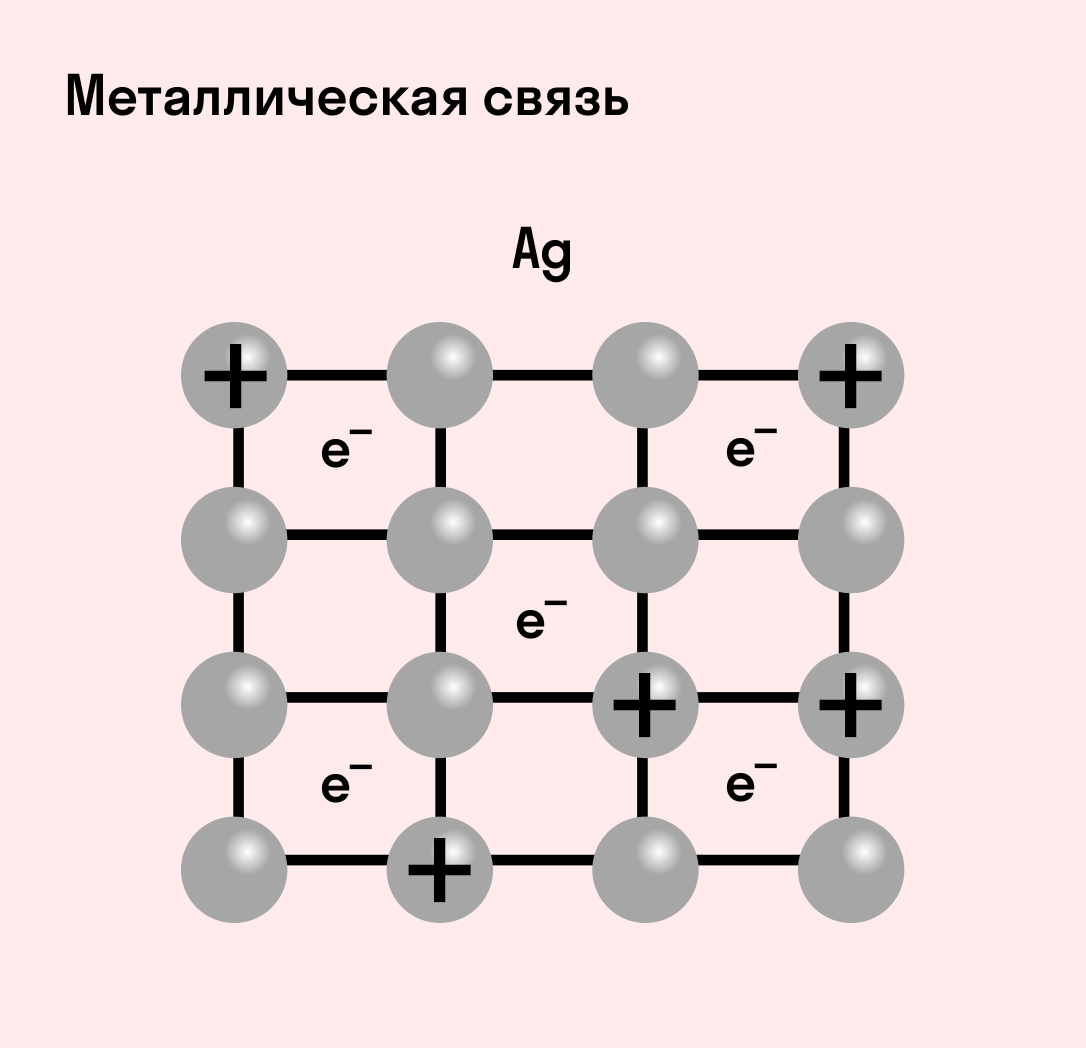
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Типы химической связи и их основные отличительные признаки
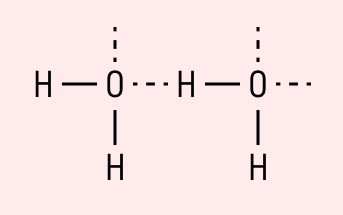
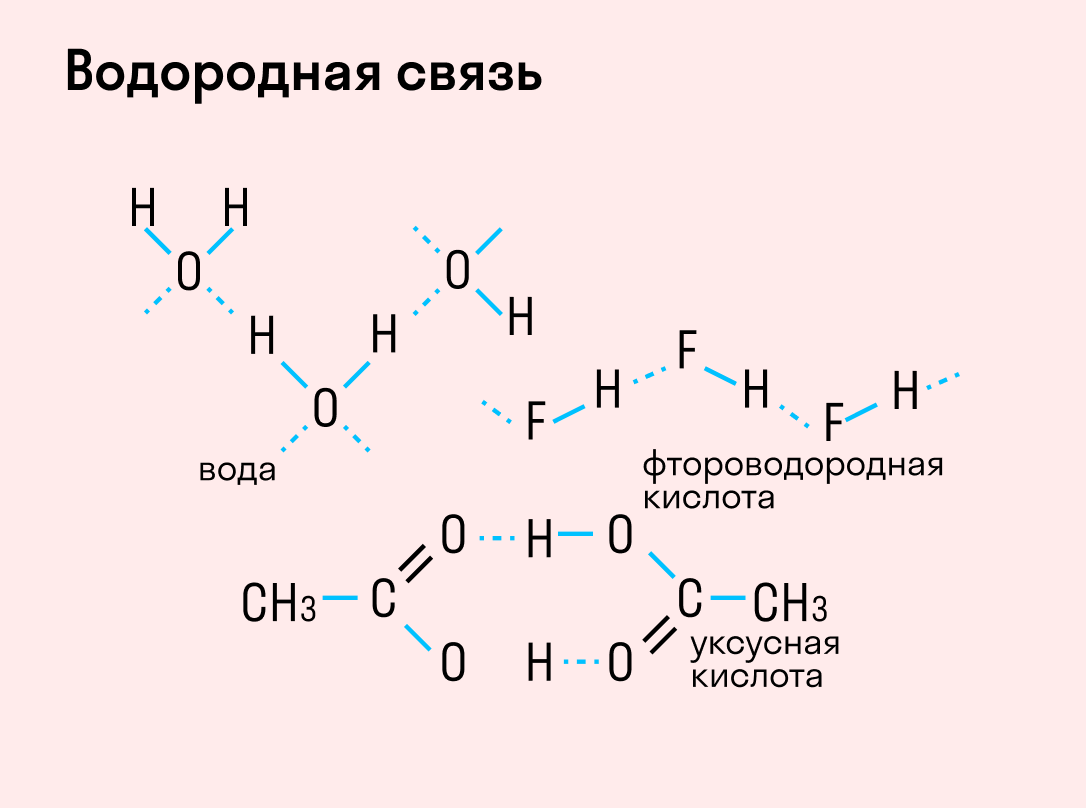
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
В каком случае происходит взаимодействие молекул друг с другом и происходит химическая реакция
MedBioGoogle
Навигация
Основные понятия химической кинетики. Химическая реакция.
Химической реакцией можно считать любое изменение вещества, при котором образуется или разрывается химическая связь между атомами. Химическая реакция характеризуется механизмом ее протекания и глубиной протекания.
Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Этот сложный путь оказывается тем не менее неизмеримо более выгодным,. Так как на одном из семи этапов не требуется встречи более чем двух частиц, и ни на одном из этапов не требуется соударение одноименно заряженных частиц. Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
Исходные, конечные и промежуточные вещества.
Вещества, вступающие в процесс химического превращения, называются исходными веществами. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующегося в других стадиях этого же процесса, называют промежуточными веществами.
Глубина превращения реакции.
Характеризует степень превращения исходных веществ в конечные продукты реакции. Проведенные измерения привели химиков к убеждению, что, во-первых, все мыслимые реакции в какой-то степени происходят, и во вторых, не существует реакций, идущих полностью до конца. Однако, часто удобнее говорить, что одни реакции совсем не идут, другие идут в ограниченной степени, а третьи потребляют исходные вещества полностью.
Гомогенные и гетерогенные реакции.
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией.
Химическая реакция, протекающая на границах раздела фаз, называется гетерогенной химической реакцией.
Примером гомогенных реакции может служить любая реакция в растворе. Примером гетерогенной реакции может служить любая из реакций, идущих не поверхности твердого катализатора (гетерогенная каталитическая реакция).
Скорость химической реакции.
Важнейшей количественной характеристикой процесса химического превращения является скорость процесса. Понятие скорости характеризует количество вещества, вступающего в реакцию в единицу времени. Это определение однако, не совсем однозначно, ак как в реакции принимают участие в качестве исходных и промежуточных веществ и в качестве продуктов реакции также несколько веществ. Поэтому строго можно говорить не о скорости химического процесса вообще, а о скорости по некоторому компоненту. Изменение количества этого компонента принято выражать в числе молей N. Таким образом, для гомофазного химического процесса, идущего веществу называется изменение концентрации этого вещества в единицу времени. Пусть концентрация одного из реагирующих веществ 1 момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции ( ` V ) за промежуток времени t2 – t1 равна
Поскольку концентрация вещества (исходного) в процессе реакции убивает, то
dt мгновенную (истинную) скорость химической реакции:
Скорость химической реакции всегда является величиной положительной, отношение же dC/dt может иметь и положительное и отрицательное значение в зависимости от того представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC/dt 0, но так как скорость должна быть положительной, перед производной ставят минус; во втором случае dc/dt > 0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид
dt разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака
на каждый исчезающий моль N2 расходуется 3 моля H2 и образуется 2 моля аммиака. Соответствующие скорости реакции соотносятся, как 1: 3: 2.
8.6. Измерение скорости реакции
Часто под кинетическими кривыми понимают и другие зависимости изменения какого-либо изменяющегося параметра в ходе химической реакции (изменение рН, электропроводности, показателя преломления, оптической плотности и т.д.). Однако расссчитывать скорость накопления или расходования какого-либо из компонентов реакции, исходя из такой кривой, можно лишь в том случае, если существует и известна однозначная зависимость, связывающая концентрация этого компонента с измеряемым свойством системы.
Порядок реакции и константа скорости реакции
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температура, давление, среда в которой проходит процесс скорость является функцией концентрации реагирующих веществ. Зависимость скорости реакции от концентрации реагирующих вещества описывается основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, имеющихся в данный момент времени, возведенных в некоторые степени. Этот постулат вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Известно, что число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определяться теми же факторами. Итак, можно записать для реакции:
Следует подчеркнуть, что величины n1 и n2 определяются только экспериментальным путем, т.к. для подавляющего большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентом.
Порядок реакции – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым числом. Как было уже указано, порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для формально простых реакций. Например, скорость реакции H2 + I2 = 2HI Согласно опытным данным может быть записана следующим образом: V = k[H2][I2], где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен 1 + 1 = 2. В этом случае стехиометрическое уравнение правильно изображает элементарный акт реакции.
Однако, в большинстве сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам, т.е. закон действия масс для химических реакций выполняется лишь в некоторых частных случаях.
Можно утверждать, что стехиометрическое уравнение реакции устанавливающее пропорции реагентов и продуктов, не определяет механизма протекания этой реакции во времени. Это является причиной, по которой экспериментально найденный порядок не всегда согласуется с уравнением, описывающим реакцию.
Множитель k в уравнении, показывает с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных
1 моль/л, называют константой скорости химического процесса. Она не зависит от концентрации и характеризует лишь влияние природы реагирующих веществ на скорость их взаимодействия друг, с другом, т.е. константа скорости реакции является мерой реакционной способности молекул.
Размерность констант скорости реакции различного порядка легко получить из выражения для скорости реакции.
Константы скорости реакций разных порядков имеют разные размерности и, поэтому их сравнение не имеет смысла. Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, однако это еще не значит, что они являются тримолекулярными. Все же укажем
Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящим к химическим превращениям. Взаимодействие подобного рода носят название элементарного акта химического превращения, т.е. молекулярность реакции, в отличие от порядка реакции имеет вполне определенный физический смысл. Например, реакция: I2 = 2I – мономолекулярная, т.к. в ее основе лежит распад исходного вещества; реакция H2 + I2 = 2HI – бимолекулярная. Реакция 2NO + H2 = N2O + H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, т.к. одновременное столкновение четырех частиц почти невероятно.
В случае сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности реакции в целом, поскольку это понятие имеет отношение применимо только к отдельным стадиям.
Различие между молекулярностью и порядком реакции можно свести к следующему:
1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная;
2) порядок реакции может принимать любые значения: целые, дробные и даже отрицательные, численные значения молекулярности ограничены лишь тремя цифрами 1,2,3.
3) Порядок реакции можно использовать для характеристики любых реакций (как сложных, так и простых), понятие “молекулярность” применимо только к элементарным актам химических превращений.
Количественные, соотношения между скоростью реакции и концентрации реагента.
В реакции первого порядка скорость реакции пропорциональна концентрации одного реагента
Для нахождения С в каждый момент времени t это уравнение необходимо проинтегрировать:
— ¾¾¾ = k c ¾¾¾ = k dt или после интегрирования:
Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли Со/С прореагировавшего вещества. Время t, нужное для того, чтобы прореагировала половина Со, называется периодом полупревращения: подставляя в уравнение t1/2 = t и
K полупревращения t1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций.
Реакция второго порядка
Период полупревращения для реакции второго порядка не остается постоянным, а обратно пропорционален начальной концентрации:
Уравнение скорости реакции третьего порядка.
Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, тем не менее это еще не значит, что они действительно тримолекулярные. Однако оно удобно для вывода кинетического уравнения:
С 2 Со 2 ( а-х) 2 а 2
концентрация, (а-х) – количество вещества оставшегося ко времени t. Если реакция протекает по уравнению: 2А + В ® продукты и если [B] не равна [A], то интегрирование выражения для скорости реакции третьего порядка значительно усложняется
Уравнение скорости реакции нулевого порядка.
Если в уравнении скоростми отсутствуют члены, содержащие концентрацию реагирующих веществ, то скорость такой реакции выражается уравнением нулевого порядка.
Реакция нулевого порядка представляет особый интерес в каталитических процессах, когда катализатор, взятый в определенном количестве, может служить фактором, лимитирующим скорость реакции. Такая ситуация встречается в ферментативной кинетике и будет рассмотрена на следующей лекции.
Определение порядка реакции.
Порядок реакции играет существенную роль при изучении и раскрытии механизма реакции. Он в значительной степени зависит от механизма реакции. Порядок реакции определяется опытным путем и его нельзя предсказать заранее, даже для реакции формально похожих.
а) Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядка) при подстановке в которое экспериментальных данных, получается постоянное значение константы скорости реакции.
б) Существует и графический способ определения порядка реакции. Например, для реакции нулевого порядка скорость реакции не зависит от концентрации. Для реакции первого порядка прямолинейной является зависимость ln C от времени. Для реакции второго порядка линейной будет зависимость 1/С от времени.
в) Используется также определение зависимости от концентрации константы полупревращения и т.д.
Теоретические основы химической кинетики.
В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.
Теория активных соударений была сформулирована С.Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называют энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции.
В качестве абсциссы в этих диаграммах используется так называемая координата реакции. Вообще говоря, она является сложной функцией межатомных расстояний. Но для практических целей и простых молекул можно считать, что она характеризует изменение в межатомных расстояниях, которые происходят при сближении исходных молекул, образующих активированный комплекс, и взаимном удалении продуктов реакции при распаде активированного комплекса. По оси ординат откладывается потенциальная энергия всей системы.
То дополнительное количество энергии, которое нужно добавить к средней энергии молекул исходных веществ, чтобы соударение стало активным, называется энергией активации.
Для того, чтобы простое соударение дало две молекулы йодистого водорода, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис.
Энергия активации этой реакции невелика, но скорость мала. Это связано с довольно жесткими требованиями, предъявляемыми к ориентации реагирующих молекул. Тогда А = РZ, т.е. А характеризует чсло соударений С благоприятной ориентацией и называется предэкспоненциальным множителем.
Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
Менее строгую зависимость константы скорости реакции от температуры в отличие от уравнения Аррениуса дает правило Вант-Гоффа, которое носит эмпирический характер. В 1884 г. Вант-Гофф установил, что при повышении температуры на 10 о С скорость большинства реакций увеличиатся в 2-4 раза. Математически эта зависимость выражается соотношением:
8.17. Теория активированного (переходного) комплекса (переходного состояния
Эта теория – простейший и исторический первый вариант статистической теории химических реакций. Она разработана Э.Вагнером, М.Поляни, Г.Эйрнингом и М.Эвансом в 30-ых годах двадцатого века.
8.18. Вывод основного уравнения теории переходного состояния.
1) Основной постулат теории переходного состояния состоит в том, что исходные вещества всегда находятся в равновесии с переходным комплексом.
В этом случае k химического равновесия переходного комплекса равна:
k * x.p. = ¾¾¾¾ и концентрация
Затем ПК распадается необратимо с образованием продукта С. (характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид: Р = kТ/h, где – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура. Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрации определяется лишь концентрации ПК:
Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
К обычной реакции взаимодействия применим закон действия масс:
V = kv[А][B], символ kv употребляется для константы скорости в отличие от константы Больцмана. Приравняем правые части уравнений и получим:
Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
8.19. Термодинамическая форма основного уравнения теории переходного состояния.
Тогда для константы скорости химической реакции можно записать
или по теории переходного состояния kv равна:
т.е. мы получили термодинамическую форму основного уравнения теории переходного состояния.
8.20. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса.
При сравнении уравнения для ТПС с уравнением Аррениуса видно, что
Таким образом, скорость реакции, согласно теории переходного состояния, зависит от двух факторов.
Учет энтропийного фактора для кинетики реакций во многих отношениях оказался плодотворным и впервые позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул. Т.е. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействие двух атомов две теории дают одинаковые результаты. В случае нелинейных многоатомных молекул теория ПК дает значение скоростей отличных от значений, даваемой теорией соударений. Если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчеты.
Таким образом две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т.д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.