в каком соединении валентность железа равна lll
Валентность железа
Валентность железа.
Валентность железа:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
| Валентность железа в соединениях | |
| II | FeO, Fe(OH)2, FeCl2, FeBr2 |
| III | Fe2O3, Fe(OH)3, FeCl3, Fe2S3 |
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
Валентность железа
Общие сведения о валентности железа
Валентность железа в соединениях
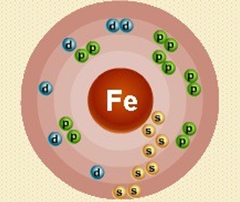
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
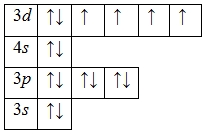
Электронная формула атома железа в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Примеры решения задач
| Задание | Железная окалина Fe3O4массой 10 г была сначала обработана 150 мл соляной кислоты (плотность 1,1 г/мл) с массовой долей хлороводорода 20%, а затем в полученный раствор добавили избыток железа. Определите состав раствора (в % по массе). |
| Решение | Запишем уравнения реакций, которые протекают согласно условию задачи: |
Определим количество вещества хлороводорода (молярная масса равна 36,5 г/моль):
msolution (HCl) = Vsolution (HCl) × ρ;
msolution (HCl) = 150 × 1,1 = 165 г.
msolute (HCl) = ω (HCl) / 100% ×msolution (HCl);
msolute (HCl) = 20 / 100% × 165 = 33г.
n(HCl) = msolute (HCl) / M (HCl);
n (HCl) = 33 / 36,5 = 0,904 моль.
Рассчитаем количество вещества Fe3O4(молярная масса равна 232 г/моль) и вещество, находящееся в избытке:
n (HCl) = 8 × 0,043 = 0,344 моль.
По условию, количество вещества хлороводорода равно 0,904 моль. Следовательно, HCl находится в избытке и будет протекать ещё одна реакция:
Определяем количество моль FeCl2 и FeCl3, образовавшихся в ходе реакции (1) и количество вещества HCl, прореагировавшее с Fe3O4:
Рассчитаем количество вещества HCl, которое не прореагировало в реакции (1), и количество моль FeCl2, образовавшееся в ходе реакции (3):
nremaining (HCl) = 0,904 — 0,344 = 0,53 моль;
Определяем количество вещества FeCl2, образовавшееся во второй реакции, общее количество моль и массу FeCl2 (молярная масса равна 127 г/моль):
nsum (FeCl2) = 0,043 + 0,129 + 0,28 = 0,452 моль;
m (FeCl2)= 0,452 × 127 = 57,404 г.
Определяем количество моль и массу железа (молярная масса равна 56 г/моль) железа, вступившего в реакции (2) и (3):
n3 (Fe) :nremaining (HCl) = 1:2, значит n2 (Fe)= 1/2× nremaining (HCl) = 0,28 моль;
nsum (Fe) = 0,043 + 0,28 = 0,323 моль;
m (Fe)= 0,28 × 56 = 18,088 г.
Вычислим количество моль и массу водорода (молярная масса равна 2г/моль), выделившегося в реакции (3):
Определим массу полученного раствора и массовую долю хлорида железа (II) в нем:
m ’ solution = 165 + 10 + 18,088 – 0,56 = 192,528 г;
ω (FeCl2)=57,404 / 192,528 × 100% = 29,82%.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Соединения железа — свойства, валентность железа в реакциях с веществами
Железо (Fe) — это один из наиболее распространенных химических элементов. Соединения железа массово используются в химической промышленности, народном хозяйстве. Сплавы железа с другими элементами стали основой большинства строительных материалов или деталей автомобилей и другой техники.
Но о применении железа поговорим позже. Сначала обозначим характеристики этого необыкновенного элемента.
Fe — строение, признаки, расположение в таблице Менделеева
Железо (Fe) — элемент 8б группы 4 периода. Порядковый номер в периодической системе — 26. Отметим, что кобальт (Co) и никель (Ni), входящие в 8б группу таблицы Менделеева, включены в семейство железа. Строение электронной оболочки атома Fe таково:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Электронное строение атома данного элемента обусловливает характерные степени окисления: +2 и + 3. Железо также может находиться в степени +6. О некоторых исключениях и интересных веществах, где этот элемент проявляет необычные свойства, поговорим чуть позже.

Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Важно! Этот химический элемент в немалом количестве содержится в горах. Огромные залежи располагаются на Урале, в Сибири и других регионах России. Богаты железными рудами Украина, Прибалтика и т.д.
Физические свойства
Железо — ковкий и довольно прочный металл серебристо-белого цвета . На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется. Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
Теперь перейдем к детальному изучению способностей соединений железа.
Соединения Fe (+2)
Начнем с тех веществ, где железо проявляет наименьшую окислительную степень после нуля — + 2. Данную степень этот химический элемент способен проявлять в различных бинарных соединениях, а также в сложных и комплексных солях.
Оксид железа II — FeO
Получить его возможно, если восстанавливать с помощью водорода оксид железа III. В целом FeO можно считать амфотерным оксидом, но в нем больше преобладают основные свойства. Представляет собой черный порошок, который невозможно растворить в воде. Ценится за свое быстрое окисление и восстановление до изначального вещества.
Гидроксид железа II — Fe(OH)2
Данный гидроксид также имеет основный характер и легко растворяется в кислотах. Это соединение является белым осадком, получаемым при взаимодействиях солей железа и щелочей. Такие реакции должны проходить в бескислородной среде, иначе может образоваться другой гидроксид, о котором будем говорить далее. Fe(OH) 2 способен к активному окислению на воздухе с получением соединений, где Fe находится в степени окисления +3.
Соли данного элемента можно получить путем большого количества реакций. Большинство из них будут иметь светло-зеленоватую окраску в растворах. Превращаются в соли железа III, окисляясь на воздухе. При этом они имеют коричнево-бурую окраску. Также благодаря солям можно получить оксиды и гидроксиды, содержащие Fe.
Соль Мора — FeSO4 *(NH4 )2 SO4 *6H2 O
Это вещество широко распространено в фармацевтике и медицине. Применяется для поставки недостающего железа в организм человека. Также противодействует гниению в дереве и деревянных изделиях. Участвует в обнаружении соединений хрома и ванадия.
Соединения Fe (+3)
Крупная группа веществ, в которой содержится трехвалентное железо. Эти соединения отличаются по своим свойствам по сравнению с предыдущими. Рассмотрим их подробнее.
Оксид железа III — Fe2 O3
Проявляет амфотерные качества, соответственно — реагирует с кислотами и щелочами, образуя при этом средние, комплексные и другие соли. В обычных условиях является кристаллическим порошком коричнево-красного цвета, нерастворимым в воде.
Гидроксид железа III — Fe(OH)3
Растворы солей трехвалентного железа имеют желтый окрас и являются слабыми окислителями. При воздействии восстановителей переходят в те вещества, где железо имеет степень окисления +2.
Важно! Солей данного типа открыто достаточно много, и все они используются в промышленных, медицинских отраслях, а также в повседневной жизни.
Соединения Fe (+2, +3)
В некоторых веществах этот химический элемент имеет целых две степени окисления. Подробнее изучим сами соединения и их свойства.
Турнбулева синь или берлинская лазурь — KFe
Это необычное соединение является осадком темного и чуть синеватого цвета , получаемым в ходе реакции между FeSO4 и красной кровяной солью. Здесь один атом Fe имеет степень окисления +2, а другой — +3. Чтобы обнаружить ионы трехвалентного железа, применяют желтую кровяную соль K4

Соединения Fe (+6)
Химические вещества, где окислительная степень железа равна +6, называются ферратами.
Ферраты являются мощными восстановителями и сходными по всем остальным способностям. Немаловажным является наличие в них бактерицидных способностей. Это обусловливает их ценность в качестве средств, обеззараживающих воду в крупных количествах.
Органические вещества, содержащие Fe
Железо и его свойства крайне важны и полезны в повседневной жизни людей, хозяйственной и промышленной деятельности. Но еще соединения железа выполняют значимые функции в теле человека. Чаще всего биологическую роль выполняют именно органические вещества, содержащие Fe. Пожалуй, самым важным веществом в теле человека, содержащим железо, является гемоглобин. Гемоглобин является белком, который осуществляет транспортировку кислорода по крови и обеспечивает постоянный газообмен. Fe входит в состав многих ферментов и белков нашего тела. Этот элемент также влияет и на наш иммунитет. Не зря при нехватке железа человек чувствует себя уставшим и сонным. При снижении концентрации Fe повышается вероятность заражения инфекционными заболеваниями. Поэтому важно следить за тем, чтобы в рационе было достаточно продуктов, содержащих железо — бобы, крупы, орехи, сухофрукты, морская капуста.
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.
Валентность железа и как элемент влияет на здоровье человека
Роль железа в организме человека трудно оценить, ведь его излишек приведет к неминуемым болезням, а недостаток тоже нежелателен. Такой элемент отвечает за уровень гемоглобина и способен нормализовать работу ферментной системы. Но если брать во внимание химические свойства, то вопрос о валентности железа становится достаточно интересным для любого человека. Чтобы разобраться в ситуации полностью потребуется подробное рассмотрение всех важных нюансов. В статье эта информация будет выложена последовательно, только так каждый человек сможет открыть для себя что-то новое.
Что включает в себя понятие
Свойство химических элементов довольно понятное, ведь все они отличаются постоянством, формула воды, к примеру, содержит 1 атом кислорода и 2 единицы водорода. Другие соединения также устроены, валентностью называют способность атома элемента присоединить к себе конкретное количество атомов других элементов. В таблице Менделеева существуют экземпляры с постоянной валентностью, но некоторые из них могут быть шести валентными, как сера и 4-х, речь идет об углероде. Феррум также несколько выделяется из списка, он бывает 2-х и 3-х валентным. Формула соединений составляется путем последовательности атомов в молекуле. Если выяснить значение одного из элементов, труда не составит разобраться с данными о другой составляющей цепочки.
Важные подробности
Железо можно смело относить к единицам с переменными показателями, значения могут колебаться не только между 2 и 3, но и достигать даже шести. Подобными изучениями занимаются специалисты отрасли неорганической химии, но каждому человеку подобные знания обязательно пригодятся. Если рассматривать механизм кратко и брать во внимание простые частицы, то данный элемент способен причислять 31 позицию из списка, это пункты с 4 по 7 периоды таблицы Менделеева. Поскольку порядковый номер будет постепенно расти, то свойства феррума несколько изменятся. Кроме возрастания атомного радиуса, получится заметить переменную валентность, это обусловлено незавершенностью подуровня. Чаще можно увидеть более устойчивые соединения с показателями 2 и 3, а самыми ненадежными считаются значения от четырех до шести, но они встречаются достаточно редко.
Двухвалентные типы
Подобное железо обладает ярко выраженным черным цветом, это происходит после взаимодействия соединения с водой. Специалисты отмечают хорошую совместимость с соляной и азотной кислотой. Достичь чистого состояния 2-х валентный оксид может после взаимодействия с водородом при температуре в 350 градусов, либо же процесс потребует нагрева до показателей в 1000 градусов и участия углерода. Добыча происходит благодаря определенному алгоритму действий, который выглядит так:
Можно определить показатели природного ископаемого с помощью раствора, реакция с красной солью и щелочью способна рассказать о многом, а именно выявить валентность с показателем в 2. За результат отвечает специфический осадок, который имеет темно-синий оттенок, со вторым элементом в итоге будет наблюдаться серо-зеленый цвет, в обоих случаях результат будет максимально точным. Если оттенок окажется темно-бурый, то железо можно смело считать 3-х валентным. Такой вид ископаемого зачастую получится встретить в порошкообразной структуре.
Рассмотрение подробностей другого типа соединения
Феррум со значением 3 также отличается по цвету, он будет красно-коричневым, из распространенных наименований стоит отметить окись железа, сурик, пигмент красного оттенка, краситель для пищи и крокус. В природе также можно встретить это вещество, оно представлено в виде такого минерала, как гематит. Подобный оксид с водой взаимодействовать не сможет, единственными соединениями будут щелочь и кислоты. Некоторые строительные материалы достаточно удачно окрашивают с помощью этого состава, сюда относятся:
Участие железа в организме каждого человека
Без этой составляющей люди не смогли бы существовать, ведь недостаточное количество феррума приведет к таким губительным последствиям как: