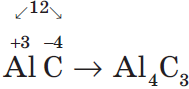в какую сторону увеличивается электроотрицательность
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
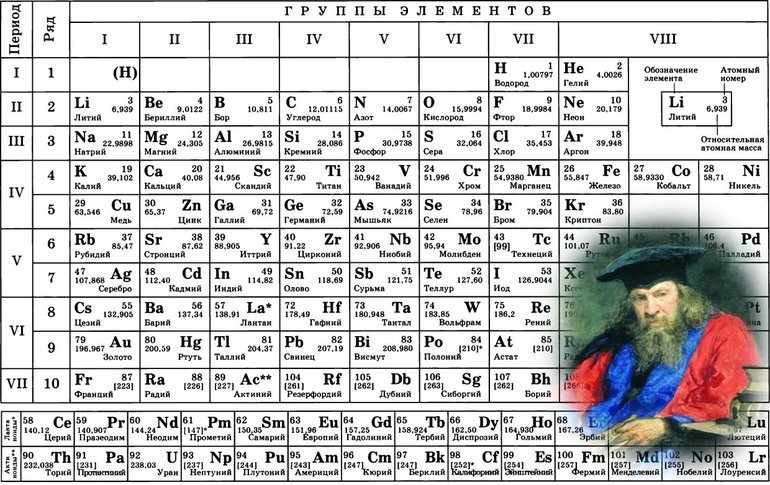
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электроотрицательность
Между атомами в молекуле образуется определенная химическая связь, которую в современном научном мире описывает квантовая механика. Заряженные частицы в атоме взаимодействуют между собой, обеспечивая молекуле определенную устойчивость.
В зависимости от расстояния между атомами, полярности и прочности, химическая связь между атомами может быть:
Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.
Приняв значение электроотрицательности водорода равной 2.1 произвольно и используя известные термодинамические данные, сравнивая электроотрицательность элементов с водородом, Поллинг составил первую шкалу относительных атомных электроотрицательностей.
Необходимо помнить, что электроотрицательность — величина не постоянная, а относительная, и позволяет лишь определить, в сторону какого элемента сдвигается общая электронная пара.
Помимо шкалы Поллинга, что изучают в школьном курсе химии, и которую можно найти на странице 276 учебника «Химия 8 класс» под редакцией В.В.Еремина, в мире существует около двадцати шкал определения электроотрицательности.
Таблица электроотрицательности Поллинга — справочный материал, и не всегда есть под рукой. Однако существуют общие закономерности электроотрицательности, и, зная расположение элемента в Периодической системе Д.И.Менделеева, можно косвенно оценить, в сторону какого из элементов в молекуле будет сдвигаться общая электронная пара.
Электроотрицательность химических элементов, расположенных правее, больше, чем у элементов, расположенных левее в одном периоде. Электроотрицательность элементов, расположенных выше, больше, чем у элементов, расположенных ниже в одной группе. Исходя из этих данных, самый высокий показатель у элементов, расположенных в правом верхнем углу, и самый низкий у элементов внизу слева.
По этим данным был составлен ряд электроотрицательности, в котором химические элементы расположены в порядке убывания ее величины: F, O, N, Cl, Br, S, C, P, H, Si, Mg, Li, Na.
Если таблица Поллинга под рукой, с помощью несложных арифметических действий можно определить тип связи в молекуле. Для этого нужно найти относительную электроотрицательность атомов, входящих в молекулу по таблице, и из большего значения вычесть меньшее, а по результату оценить связь.
Разность значений равна 0,5 или меньше — сила притяжения у атомов практически равна, электронное облако находится примерно посередине расстояния между атомами веществ, а связь является ковалентной неполярной. Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены.
Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд. Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь. Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения.
Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше. Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0. Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная.
Электроотрицательность химических элементов в таблице Менделеева
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Смысл понятия
Электроотрицательность химических элементов представляет собой способность атома вещества притягивать к себе электроны других атомов в сложных соединениях. Впервые это понятие ввел в начале XX столетия американский химик Лайнус Полинг. Простые элементы можно разделить на две большие группы в соответствии с их химическими и физическими свойствами:
Вещества из первой группы могут выступать в роли восстановителя либо окислителя в зависимости от показателя электроотрицательности элемента. Чем он выше, тем активнее вещество проявляет свойства окислителя.
Таким образом, необходимо разобраться с двумя новыми понятиями:
Полингом была составлена специальная шкала электроотрицательности. Максимальной электронегативностию обладает фтор — 4. Минимальный электроотрицательный показатель у франция, и он равен 0,7.
Кроме этого, определить показатель электронегативности любого элемента можно по таблице Менделеева. Для этого необходимо запомнить два правила:
Зная эти правила, можно достаточно просто в любом соединении найти более сильный элемент. Однако химическим элементам нельзя приписывать постоянный показатель ЭО. Эта способность веществ зависит от различных факторов, в том числе от степени окисления и валентности.
Для полного понимания темы предстоит разобраться и с этими понятиями. Степенью валентности называется условный заряд атомов вещества в сложном соединении, определенный на базе предположения, что ионные и ковалентно-полярные соединения состоят исключительно из ионов. Также следует обратить внимание на тот факт, что в соединении суммарная степень окисления атомов равна нулю.
Валентность любого химического элемента определяется числом электронов, принимающих участие в образование химической связи между веществами. В отличие от степени окисления, валентность не имеет знака и не может быть равна нулю. Понятие относительной электроотрицательности (ОЭО) в химии нельзя игнорировать.
Именно с его помощью можно быстрее разобраться с принципами образования химических связей между элементами.
Электроотрицательность, степень окисления и валентность химических элементов
Теория к заданию 3 из ЕГЭ по химии
Электроотрицательность, степень окисления и валентность химических элементов
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО).
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью.
Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Существует шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
$F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs$. Наибольшее значение ЭО имеет фтор.
В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз).
В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т.е. атомы более электроотрицательных элементов.
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т.е. атомы менее электроотрицательных элементов.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
Валентность
Очень важное значение в описании химического строения органических соединений имеет понятие валентности.
Валентность характеризует способность атомов химических элементов к образованию химических связей; она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Валентность атома химического элемента определяется, в первую очередь, числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
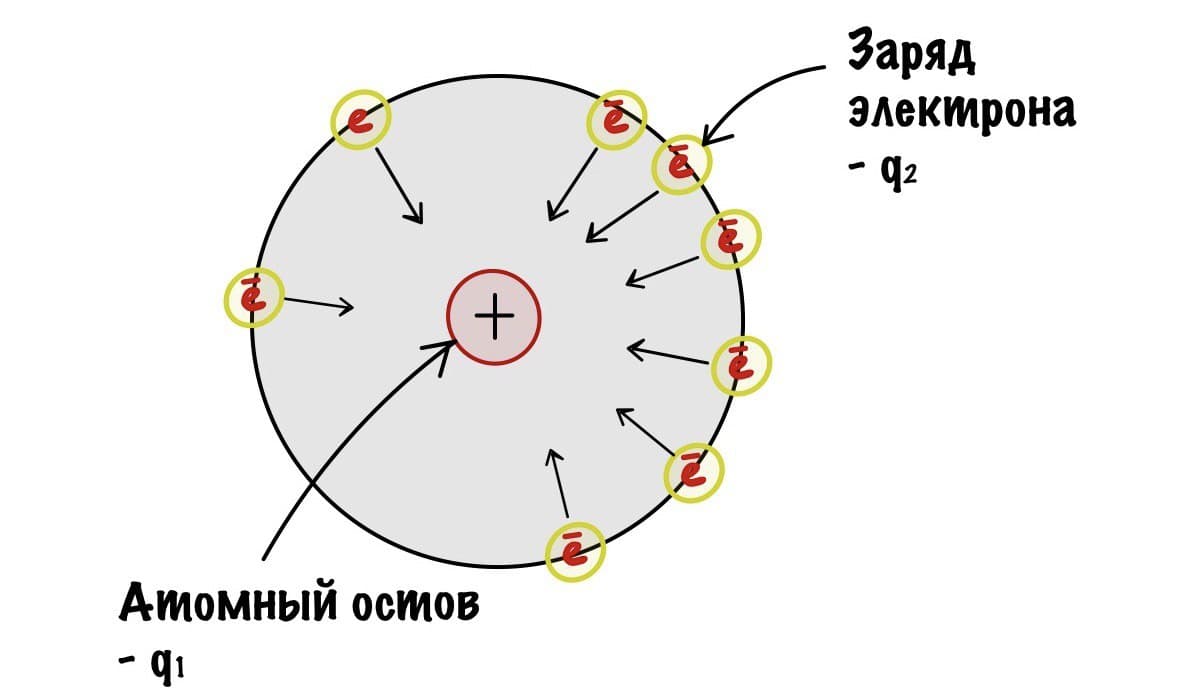
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
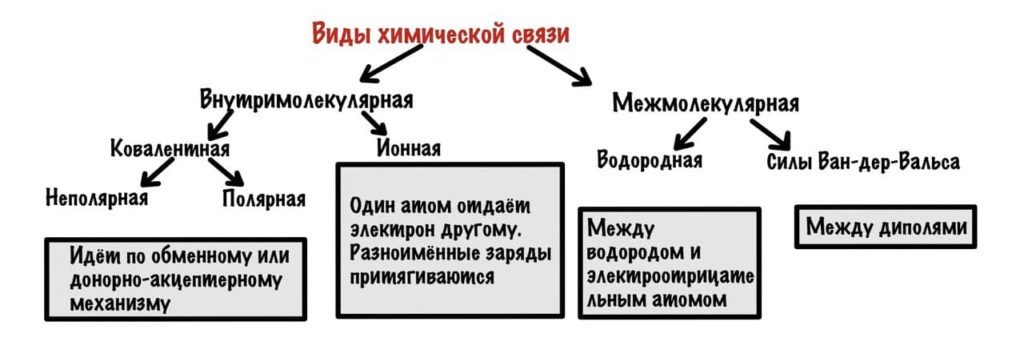
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.