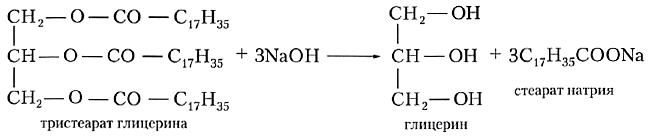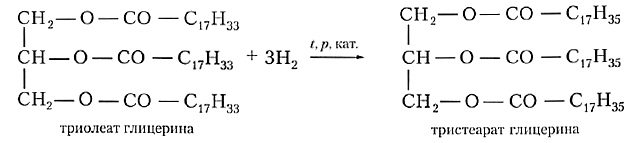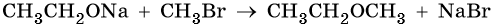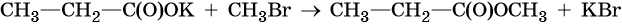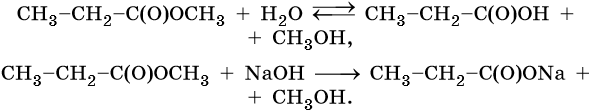в результате какой реакции получаются сложные эфиры
Сложные эфиры.
Сложные эфиры – соединения, у которых атом водорода замещен углеводородным радикалом. Общая формула:
Изомерия сложных эфиров.
Для сложных эфиров характерны следующие виды изомерии: изомерия углеродной цепи, изомерия положения сложноэфирной группировки –СО-О-, межклассовая изомерия:
Физические свойства сложных эфиров.
Сложные эфиры представляют собой летучие, малорастворимые и практически нерастворимые в воде жидкости. Многие имеют приятный запах.
Сложные эфиры имеют более низкую температуру кипения, чем соответствующие кислоты. Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не имеют запаха и нерастворимы в воде, но хорошо растворимы в органических растворителях.
Химические свойства сложных эфиров.
1. Реакция гидролиза (омыления).
Гидролиз ускоряется под действием щелочей, и гидролиз необратим:
3. Реакция восстановления:
4. Реакция образования амидов.
Реакция этерификация сложных эфиров.
Сложные эфиры
Урок 29. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Сложные эфиры»
Сложные эфиры – это функциональные производные карбоновых кислот, в которых гидроксильная группа замещена остатком спирта или фенола.
Так, сложный эфир этилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – этанола. Пропилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – пропанола.
Сложные эфиры содержат сложноэфирную группу. Для сложных эфиров, как и для карбоновых кислот? можно использовать формулу CnH2nO2, которая отражает молекулярный состав.
Назовём следующие сложные эфиры. Первый эфир называется пропилэтаноат, или пропиловый эфир уксусной кислоты. Второй эфир называется этилметаноат, или этиловый эфир муравьиной кислоты.
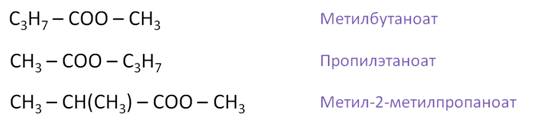
Для сложных эфиров возможно существование структурных изомеров. Например, составим структурные изомеры состава С5Н10О2. Это метилбутаноат, припилэтаноат, метил-2-метилпропаноат.
Кроме того, для сложных эфиров характерна межклассовая изомерия с карбоновыми кислотами.
Сложные эфиры, в составе которых низшие карбоновые кислоты и спирты, − летучие, малорастворимые и практически нерастворимые в воде жидкости. Они хорошо растворимы в органических растворителях.
Многие эфиры имеют приятный запах: запах ананаса имеет бутиловый эфир бутановой кислоты, запах груш – изоамиловый эфир этановой кислоты, абрикосами пахнет пентиловый эфир бутановой кислоты, запах жасмина напоминает бензиловый эфир этановой кислоты, запах хризантенм – бензиловый эфир метановой кислоты.
Получить сложные эфиры можно несколькими способами. Например, в реакции карбоновых кислот и спиртов в присутствии минеральных кислот. Так, в реакции уксусной кислоты с этанолом образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты.
Реакцию образования сложного эфира, как известно, называют реакцией этерификации. Термин «эфир» впервые использовал К. Шееле в конце 18 века.
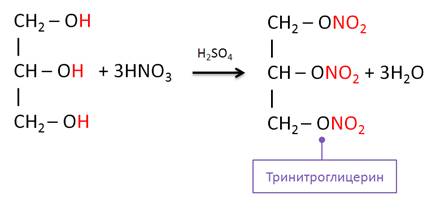
Сложный эфир можно получить и в реакции глицерина и азотной кислоты, в результате данной реакции образуется тринитроглицерин.
Для сложных эфиров характерны реакции горения. Например, составим реакцию горения метилформиата. При горении образуется углекислый газ и вода.
Важная реакция сложных эфиров – это реакция их с водой в присутствии кислоты или щёлочи. Эта реакция называется гидролизом. Гидролиз – реакция обратная реакции этерификации. Так, в результате гидролиза этилэтаноата в присутствии сильной минеральной кислоты, образуется этановая кислота и этанол. Эта реакция является обратимой.
В результате щелочного гидролиза этилэтаноата образуется этаноат натрия и этанол. Этот гидролиз необратим и называется омылением.
Сложные эфиры встречаются в виде эфирных масел, жиров, восков.
Воски – это сложные эфиры высших карбоновых кислот и высших спиртов. Пчелиный воск на 70 % состоит из сложного эфира, главным образом, из пальмитиновой кислоты и миристилового спирта. Из воска изготавливают политуры, смазки, пропиточные составы для бумаги и кожи, они входят в состав косметических кремов и мазей.
Сложные эфиры применяют в парфюмерии при производстве духов, в производстве бытовой химии, сложные эфиры составляют основу эссенций для приготовления фруктовых вод, кондитерских изделий, сложные эфиры применяют как растворители органических веществ, при производстве полимерных материалов, в частности пластификаторов, в лакокрасочной промышленности, в производстве искусственных волокон, при производстве лекарственных средств (валидола, аспирина). Сложные эфиры – основа органического стекла.
Таким образом, сложные эфиры – это функциональные производные карбоновых кислот, у которых гидроксильная группа замещена на остаток спирта. Сложные эфиры широко распространены в природе. Сложные эфиры образуются в реакциях между спиртами и кислородсодержащими кислотами. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей. Сложные эфиры применяются во многих областях промышленности.
Сложные эфиры. Жиры
Сложные эфиры
Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Например:
Общая формула сложных эфиров одноатомных спиртов и монокарбоновых кислот: 
Изомерия
Рассмотрим на примере С5Н10О2:
Номенклатура
Названия сложных эфиров образуются из названий соответствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов:
Физические свойства
Простейшие по составу сложные эфиры карбоновых кислот — бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры — воскообразные вещества (пчелиный воск), все сложные эфиры в воде растворяются плохо.
Химические свойства
Гидролиз — важнейшее химическое свойство сложных эфиров:
Эти реакции противоположны реакциям этерификации. Ионы водорода катализируют как прямую, так и обратную реакции. Для смещения реакции в сторону образования эфира можно «связать» образующуюся воду водоотнимающим средствам (например, конц.H2SO4). В том случае, когда необходимо провести гидролиз эфира, реакцию иногда проводят в присутствии щелочи, которая позволяет «связать» образующуюся кислоту.
Применение
Жиры (триглицериды)
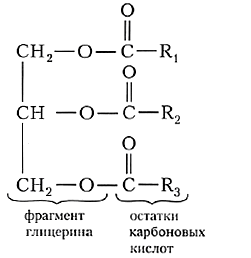
Жиры — это смесь сложных эфиров глицерина и высших карбоновых кислот (ВКК).
Состав жиров установил в 1811 г. французский ученый Э. Шеврель, нагревая жир с водой в щелочной среде. Общая формула жира:
где Rl, R2, R3 — углеводородные радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Французский химик М. Бертло в 1854 г. осуществил обратную реакцию и впервые синтезировал жир:
Наиболее важные ВКК, входящие в состав жиров
Физические свойства
Жиры – вязкие жидкости или твердые вещества, легче воды; в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле и др.)
Классификация
Чем больше в жирах содержание ненасыщенных кислот, тем ниже температура плавления жиров.
Номенклатура
Существуют различные способы составления названий жиров. Согласно тривиальной номенклатуре, глицериды называют, добавляя окончание -ин к названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано. Например, тристеарин — это жир, представляющий собой сложный эфир, молекула которого состоит из остатка глицерина и трех остатков стеариновой кислоты.
Рассмотрим номенклатуру жиров на некоторых примерах:
Химические свойства
I.Гидролиз
В зависимости от условий гидролиз бывает:
— водный (без катализатора, при высоких T и P);
— кислотный (в присутствии кислоты в качестве катализатора);
— ферментативный (происходит в живых организмах);
— щелочной (под действием щелочей).
Например:
Мыла – натриевые или калиевые соли высших карбоновых кислот.
Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
II.Реакции присоединения (для жидких ненасыщенных жиров)
1.Присоединение водорода (гидрирование):
Гидрированный жир используется в производстве маргарина.
2.Присоединение галогенов:
Бромная вода в результате этой реакции обесцвечивается.
III. Реакции окисления и полимеризации (для жидких ненасыщенных жиров)
Жиры, содержащие остатки непредельных кислот (высыхающие масла), под действием кислорода воздуха окисляются и полимеризуются.
Функции жиров в организме
1.Энергетическая (при полном расщеплении 1 г жира до СО2 и Н2О освобождается 38,9 кДж энергии).
2.Структурная (жиры — важный компонент каждой клетки).
3.Защитная (жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы).
Скачать:
Скачать бесплатно реферат на тему: «Жиры» Жиры.docx (260 Загрузок)
Скачать бесплатно реферат на тему: «Применение жиров» Применение-жиров.docx (235 Загрузок)
Скачать бесплатно реферат на тему: «Сложные эфиры» Сложные-эфиры-эстеры.docx (262 Загрузки)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
В результате какой реакции получаются сложные эфиры
Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением
Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:
Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Реакции этерификации обратимы. В присутствии кислот сложные эфиры разлагаются водой — гидролизуются, что можно рассматривать как реакцию, обратную их получению:
В присутствии щелочей гидролиз сложных эфиров необратим, так как образующаяся кислота связывается щёлочью с образованием соли, неспособной вступать в реакцию со спиртом:
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.
| Жиры представляют собой сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот. |
Общую формулу жиров можно представить в следующем виде:
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.
Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:
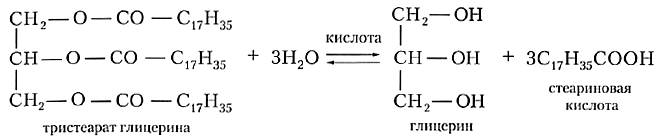
Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом:
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.
Гидролиз жиров в присутствии щелочей называют щелочным гидролизом:
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.
Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания:
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.
Справочная таблица «Сложные эфиры»
Конспект урока по химии «Сложные эфиры. Жиры». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Простые и сложные эфиры
Простые эфиры образуются при межмолекулярной дегидратации спиртов, а также при взаимодействии алкоголятов с галоидными алкилами, например:
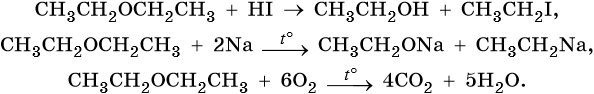
Простые эфиры химически инертны. Их характерные реакции на примере диэтилового эфира:
Пары диэтилового эфира пожаро- и взрывоопасны.
Сложные эфиры образуются в результате реакции этерификации (урок 25). При этом следует отметить, что при одной и той же кислоте скорость этерификации первичных спиртов в два раза выше, чем у вторичных и во много раз превосходит третичные.
Кроме того, сложные эфиры можно получить в результате взаимодействия солей карбоновых кислот с галоидными алкилами:
Для сложных эфиров характерны изомерия углеводородных радикалов кислот и спиртов, составляющих сложный эфир, а также межклассовая изомерия с карбоновыми кислотами. Ниже приведены реакции, иллюстрирующие характерные химические свойства сложных эфиров.
1. Кислый или щелочной гидролиз:
2. Реакция переэтерификации (идет в том случае, если брать избыток спирта и отгонять образующийся более легкокипящий спирт):