как герпес влияет на мозг
Ученые связали вирус герпеса с развитием нейродегенеративных болезней
Герпесвирусы — обширное семейство, насчитывающее почти 90 видов вирусов, поражающих млекопитающих, птиц, рыб, рептилий и земноводных. Человек уязвим лишь для восьми из них. При этом после заражения, например, вирусами простого герпеса I и II типа, избавиться от инфекции в организме уже невозможно. Вирус сохраняется в латентной форме, напоминая о себе в среднем несколько раз в год высыпаниями, преимущественно в районе губ или половых органов. Вирусом простого герпеса I типа, по разным оценкам, заражено до 90% населения планеты.
Ранее вирус простого герпеса I типа уже связывали с болезнью Альцгеймера — у людей с HSV-1 заболевание возникает чаще, а вирусная ДНК определяется в амилоидных бляшках.
Однако достаточно подробных исследований, посвященных связи вирусов герпеса с нейродегенеративными заболеваниями и поиску возможных механизмов, повышающих риски, не проводилось.
Заняться поиском факторов, с помощью которых вирусы делают мозг более предрасположенным к дегенерации нервных клеток, решили специалисты Иллинойсского университета в Чикаго. Свои выводы они изложили в статье в журнале Nature Communications.
Исследователи хотели выяснить, почему HSV-1 может стать смертельным для людей с ослабленным иммунитетом, но не наносит серьезного вреда здоровым людям. Герпесвирусы инфицируют центральную нервную систему и могут приводить к энцефалиту и прочим поражениям мозга. Однако в большинстве случаев организм подавляет первичную инфекцию прежде, чем она успевает нанести ЦНС серьезный ущерб.
В механизме защиты может играть роль белок оптиневрин, предположили ученые. Оптиневрин — рецептор, способный склонить белки вируса к аутофагии.
«Оптиневрин останавливает рост вируса, это происходит путем аутофагии — захвата частиц вируса внутри крошечных везикул, называемых аутофагосомами. Происходящая аутофагия очень избирательна. Это может быть важно для понимания того, как организм борется и с другими вирусами», — говорит доктор Дипак Шукла, один из авторов работы.
Чтобы проверить эту версию, исследователи использовали линию генетически модифицированных мышей, у которых не синтезировался оптиневрин. Их и обычных мышей ученые заразили HSV-1. У мышей без оптиневрина вирус беспрепятственно размножался в мозге, уничтожая нейроны и, в конечном итоге, приводя к смерти грызунов.
Ген, регулирующий выработку оптиневрина, может мутировать и естественным образом, отмечают авторы работы.
«Если у вас есть и мутировавший оптиневрин, и герпес, это катастрофа с точки зрения нейродегенерации», — говорит Шукла.
«Исследование также показывает, что при дефиците оптиневрина нарушается иммунный ответ, — добавляет Чандрашекхар Патил, соавтор исследования. — Оптиневрин необходим для подачи сигнала о притоке соответствующих иммунных клеток в место инфекции. Когда у вас его нет, возникают проблемы».
Поскольку вирус герпеса остается в нервных клетках, исследователи полагают, что он может быть фактором, повышающим риск развития нейродегенеративных заболеваний. Чтобы постоянно бороться с вирусом, иммунной системе приходится запускать воспалительные процессы, и это сказывается на состоянии нейронов не лучшим образом.
Мыши без оптиневрина, зараженные HSV-1, через 30 дней теряли способность распознавать объекты. По словам Шуклы, это может свидетельствовать, что наличие вируса вкупе с мутацией способно ускорить повреждение нейронов привести к когнитивным нарушениям.
По мнению авторов работы, результаты могут касаться всех видов герпесвирусов, поражающих человека. Хотя исследование проводилось на мышах, у ученых нет сомнений, что и в человеческом мозге отсутствие оптиневрина приведет к тем же последствиям — ускоренной дегенерации нервных клеток. Исследователи планируют дополнительно изучить возникающие естественным образом мутации гена, регулирующего выработку оптиневрина — так, известно, что они наблюдаются у людей с глаукомой. Теперь же предстоит выяснить, как они влияют на здоровье при наличии в организме HSV-1 и других вирусов герпеса.
Герпетический энцефалит
Сезонные колебания герпетическому энцефалиту не свойственны. Два пика заболеваемости приходятся на 5-30 лет и возраст старше 50 лет. Более чем в 95% случаев возбудителем герпетического энцефалита служит вирус простого герпеса типа 1.
Что провоцирует / Причины Герпетического энцефалита :
Возбудитель относится к семейству герпеса (Herpes viridae).E это семейство входят также вирусы ветряной оспы, опоясывающего лишая, цитомегаловирусы и возбудитель инфекционного мононуклеоза. Содержит ДНК, размеры вириона 100-160 нм. Вирусный геном упакован в капсид правильной формы, состоящий из 162 капсомеров. Вирус покрыт липидсодержащей оболочкой. Размножается внутриклеточно, образуя внутриядерные включения. Проникновение вируса в некоторые клетки (например, в нейроны) не сопровождается репликацией вируса и гибелью клетки. Наоборот, клетка оказывает угнетающее влияние и вирус переходит в состояние латенции. Через некоторое время может происходить реактивация, что обусловливает переход латентных форм инфекции в манифестные. По антигенной структуре вирусы простого герпеса подразделяются на два типа. Геномы вирусов 1 и 2-го типа на 50% гомологичны. Вирус 1-го типа обусловливает преимущественно поражение респираторных органов. С вирусом простого герпеса 2-го типа связано возникновение генитального герпеса и генерализованная инфекция новорожденных.
Эпидемиология. Герпетический энцефалит составляет 11,5% среди острых энцефалитов. Заболевают чаще дети младшего возраста. Заболеваемость спорадическая, некоторые исследователи указывают на увеличение ее весной. Инфекция может передаваться капельным и контактным путем.
Патогенез (что происходит?) во время Герпетического энцефалита :
Патогенез заболевания герпетическим энцефалитом неоднороден. У детей и молодых людей в форме энцефалита может протекать первичный герпес. При этом вирус герпетического энцефалита, по- видимому, попадает в ЦНС со слизистой носа, транспортируясь по аксонам обонятельных нейронов в обонятельную луковицу. Однако большинство взрослых больных, страдающих герпетическим энцефалитом, либо имеют герпес в анамнезе, либо серопозитивны в отношении вируса простого герпеса типа 1. Приблизительно у 25% больных герпетическим энцефалитом в слизистой ротоглотки и ткани головного мозга обнаруживают разные штаммы вируса. В этих случаях энцефалит обусловлен повторным заражением иным штаммом вируса простого герпеса типа 1 с проникновением возбудителя в ЦНС.
Для объяснения причин энцефалита в тех случаях, когда в слизистой ротоглотки и ткани головного мозга обнаруживают один и тот же штамм вируса, предложено две гипотезы.
Согласно первой, реактивация вируса герпетического энцефалита в тройничном или вегетативных ганглиях сопровождается его распространением в ЦНС по нервам, иннервирующим среднюю черепную ямку. Согласно второй, вирус длительное время покоится в латентном состоянии непосредственно в ЦНС, где и реактивируется. Во всяком случае, с помощью олигонуклеотидных зондов ДНК вируса простого герпеса была обнаружена в ткани головного мозга взрослых людей, умерших не от герпеса.
Симптомы Герпетического энцефалита :
Кроме типичного некротического энцефалита выделяют псевдотуморозную и стволовую форму. Описаны также энцефаломиелиты и генерализованная герпетическая инфекция с преимущественным поражением ЦНС.
Диагностика Герпетического энцефалита :
Лечение Герпетического энцефалита :
Профилактика Герпетического энцефалита :
К каким докторам следует обращаться если у Вас Герпетический энцефалит :
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Вирус простого герпеса нарушил процесс развития нервной ткани
South Park / Comedy Central, 1997-2020
Вирус простого герпеса первого типа нарушает процессы дифференцировки стволовых нервных клеток и формирования коры головного мозга. Такие результаты удалось получить с помощью, в том числе, трехмерной органоидной модели головного мозга человека. Кроме того, ученым удалось показать, что вирус способствует аномальной активации микроглии, которая сопровождается выработкой воспалительных медиаторов. Она также может нарушать процесс развития нервной ткани. Исследование опубликовано в журнале PLoS Pathogens.
Вирус простого герпеса (ВПГ) — один из наиболее распространенных патогенов человека во всем мире. ВПГ первого типа (ВПГ-1) в основном передается при оральном контакте и вызывает герпес на губах и во рту, в то время как ВПГ второго типа передается половым путем и вызывает генитальный герпес. Оба типа вируса способны вызывать пожизненную инфекцию и иногда способны вызывать и тяжелые заболевания, например, энцефалит. Ряд исследований показали, что внутриутробные инфекции ВПГ-1 связаны с риском нарушений развития центральной нервной системы плода, что приводит к долгосрочным неврологическим последствиям, включая когнитивную дисфункцию, неспособность к обучению и деменцию у взрослых. Однако патогенетические звенья этого процесса остаются неясными.
Современное понимание того, как инфекция ВПГ-1 влияет на мозг плода, в значительной степени известно по животным моделям. Однако человеческий мозг содержит намного больше нервных и глиальных клеток, которые формируют сложные морфологические и функциональные связи. Из-за этой сложности полноценно перенести результаты с животных моделей на человека нельзя. Поэтому группа ученых из Уханьского университета под руководством Хаовэнь Цяо (Haowen Qiao) изучила патогенное действие вируса простого герпеса первого типа на нервных клетках разной степени дифференцировки и трехмерных органоидах головного мозга, которые были максимально приближены морфологически и функционально к развивающемуся головному мозгу плода.
Чтобы понять, какие клетки поражает ВПГ-1, ученые попытались заразить вирусом плюрипотентные стволовые клетки, нервные стволовые клетки и зрелые нейроны разным количеством вирусных частиц. Через восемь дней при количественном определении уровня инфицирования клеток (с помощью иммунофлюоресцентного окрашивания антител против антигенов ВПГ-1 на оболочке клетки) выяснилось, что наиболее восприимчивыми к ВПГ-1 оказались нервные стволовые клетки (p
Типы и влияние герпеса на нервную систему
Типы вирусов герпеса
В современном мире люди уже понимают, что «простуда» на губах далеко не единственное «безобидное» проявление герпетической инфекции. Для того, чтобы лучше ориентироваться в проблеме, уточним, сколько видов герпеса существует. Восемь серотипов известны науке на сегодняшний день. Это вирусы простого герпеса (ВПГ) 1-го и 2-го типа, вирус Varicella Zoster (вызывает ветряную оспу и опоясывающий лишай), цитомегаловирус (ЦМВ), вирус Эпштейна–Барра (ЭБВ), вирусы герпеса человека 6-го, 7-го и 8-го типов. 1
Ветряная оспа. Вызывается вирусом герпеса типа 3, передается воздушно-капельным путем. Симптомы «ветрянки»: умеренная лихорадка и интоксикация, высыпания на коже и слизистых оболочках в виде папул. Заболевание чрезвычайно заразно. К ветряной оспе восприимчивость практически абсолютная, что обусловливает высокую заболеваемость в детстве, после чего остается прочный иммунитет. Несмотря на приобретенный иммунитет, вирус пожизненно присутствует в организме в латентном состоянии в нервных узлах. При ослаблении организма даже через много лет может возникнуть его активация в виде опоясывающего лишая. При типичной лёгкой форме общее состояние инфицированных удовлетворительное, тогда как при среднетяжёлом состоянии температура поднимается до 38.5-39ºС, обильная сыпь. Период высыпания составляет 4-5 дней, иногда и дольше. При тяжёлой форме общее состояние больного значительно нарушено. При сильном жаре до 39,5-40ºС резко выражены симптомы интоксикации – головная боль, слабость, раздражительность, нарушения сна, отсутствие аппетита, возможны рвота, жидкий стул.
Инфекционный мононуклеоз вызывается вирусом Эпштейна – Барр, он же вирус герпеса 4-го типа. Заболевание в основном поражает детей, может стать как причиной, так и следствием снижения иммунитета. Хроническая инфекция, вызванная вирусом Эпштейна-Барр, характеризуется длительным рецидивирующим течением и наличием клинических и лабораторных признаков вирусной активности. Заболевание может проявляться множеством симптомов от слабости и утомляемости, болей в теле до сыпи и кашля, головокружения, депрессии и астении. На пике инфекции повышается температура. Вирус Эпштейна-Барр может привести к развитию следующих заболеваний:
– болезнь Филатова (инфекционный мононуклеоз);
– болезнь Ходжкина (лимфогранулематоз);
– поражение головного и спинного мозга (рассеянный склероз) и других.
Простой герпес у взрослых (ПГ). Причиной недуга становится заражение ВПГ– 1 или ВПГ- 2. Болезнь проявляется зудящей сыпью в виде сгруппированных или одиночных пузырьков размером от одного до нескольких миллиметров на коже и/или слизистых оболочках, сопровождается отеком, покраснением. При тяжелом течении инфекция может поражать внутренние органы. Заболевание приобретает хронический характер и может рецидивировать. Эти вирусы остаются в организме навсегда, иногда сосуществуя с другими представителями группы.
Попав на слизистую оболочку или в верхние дыхательные пути, вирус активно размножается. Инфицирование происходит при контакте биологических жидкостей, содержащих вирус, со слизистыми, например во время интимных контактов, при поцелуях либо заносится грязными руками. Возможен перенос вируса из герпетического очага в другие места, например, из полости рта на конъюнктиву глаза, в области гениталий, на любые участки тела через микроповреждения кожи. Есть небольшая вероятность передачи вируса по воздуху со слюной.
Тяжелые последствия инфицирования ВПГ
Наряду с распространенными проявлениями инфекции на губах, во рту, носу, на лице, ягодицах и половых органах, герпес может поражать внутренние органы, мозговые оболочки, нервы, вызывая такие тяжелые состояния как менингит, энцефалит, неврит, менингоэнцефалорадикулит, стать причиной бронхита, пневмонии, поражения лимфокомпетентных органов: печени, селезенки, поджелудочной железы и даже сепсиса. Одними из критериев инфекционного энцефалита – воспаления головного мозга – являются нарушение психического или ментального статуса больного, лихорадка, судороги, неврологическая симптоматика, изменения на ЭКГ.
Как герпес влияет на нервную систему
Каждый вид вируса герпеса ассоциирован с определенными поражениями нервной системы: ВПГ-1 с менингоэнцефалитом, Варицелла-Зостер – чаще всего вызывает неосложненный герпетический менингит, он очень тропен к мозжечку, поэтому у детей могут возникать постветряночные осложнения (церебеллит). Вирусы Herpesviridae реализуют свою деятельность в клетках эпителия и нервных клетках. С током крови и лимфы ВПГ разносится по всему организму. За короткий промежуток (около трех часов) вирус проникает в нервные узлы, где пребывает в латентном состоянии. ВПГ-1, в основном поражающий слизистую оболочку ротовой полости, носоглотки, губ, находится постоянно в эндотелии сосудов, сосудистых нервных пучках, чувствительных ганглиях тройничного нерва и других черепно-мозговых нервов. ВПГ-2, вызывающий преимущественно поражение гениталий, промежности, анальной области, нижних конечностей, ягодиц, «живет» в ганглиях пояснично-крестцового отдела позвоночника. ВПГ-1 может распространяться по зрительному, обонятельному нерву и в дальнейшем проникать в центральную нервную систему. В нервных узлах вирус становится недосягаемым для клеток, отвечающих за защиту организма от агрессоров. Так как вирус способен распространяться из инфицированной клетки в соседние, минуя межклеточное пространство, он избегает контакта с противовирусными антителами. В стадии обострения вирус покидает разрушенную им клетку и переходит в кровь, где становится доступным для фагоцитов. Помимо влияния на нервную систему герпесвирусные инфекции вызывают дисбаланс системы интерферонов, угнетают клеточные и фагоцитарные реакции организма. Есть мнение, что герпес опосредовано оказывает негативное влияние на состояние сердечно-сосудистой системы, провоцируя образование бляшек и тромбов за счет повреждения сосудистых стенок и выработки большего количества холестерина.
Психоэмоциональное состояние при рецидивах герпеса
Роль иммунитета в возникновения рецидивов ВПГ
Системное заболевание
В последнее время наблюдается учащение герпес ассоциированных заболеваний. Стоит отметить, что это не только кожный недуг, – герпетическая инфекция – это системное заболевание организма. Радикулиты, связанные с герпетическим поражением нервных структур поясничного и крестцового отделов позвоночника, могут обостряться после простуд и/или переохлаждения. Боль может отдавать в ноги, зону ягодиц, промежности. Вирусная этиология подтверждается тем, что помимо сильных длительных болей в области поясницы, крестца, ягодиц у больных появляются характерные герпетические высыпания. ВПГ может стать одной из причин паралича лицевого нерва, воспаления тройничного нерва. По мнению специалистов переохлаждение активизирует вирус, находящийся в спящем состоянии в ганглиях тройничного нерва. iv
Каким бывает лечение
Задачи, с которыми необходимо справиться посредством терапии: подавление размножения вируса, уменьшение симптомов и болей, сокращение периода болезни, а также предотвращение развития осложнений. Так как герпес – это рецидивирующее заболевание, то в список задач входит сокращение рецидивов и увеличение промежутков между ними. Одним из препаратов, которые могут быть рекомендованы, является ВИФЕРОН Суппозитории. По инструкции для взрослых при герпетической инфекции применяется дозировка 1 000 000 МЕ (500 000МЕ беременным) по схеме 1 свеча 2 раза в сутки через 12 часов ежедневно в течение 10 суток и более при рецидивирующей инфекции; по клиническим показаниям терапия может быть продолжена. В качестве местной терапии применяют ВИФЕРОН Мазь и ВИФЕРОН Гель.
Небольшое количество Мази аккуратно втирают на область поражения кожи три-четыре раза в сутки Продолжительность терапии от пяти дней до недели. Небольшую полоску геля наносят ватной палочкой или шпателем на предварительно подсушенную пораженную поверхность три-пять раз в день в течение пяти-шести дней. При необходимости курс можно продолжать до прекращения клинических проявлений. Лечение рекомендуется начинать сразу при появлении первых симптомов на коже и слизистых (боль, зуд, покалывание, отек и покраснение кожи). Если заболевание рецидивирующее, то предпочтительнее начинать лечение до появления симптомов или в самом начале (у женщин рецидивы могут быть связаны с менструальным циклом). Пациентам предписан щадящий режим, не рекомендуются водные процедуры. Для облегчения симптомов назначают антигистаминные, жаропонижающее и антисептические препараты для обработки очагов поражения кожи. После перенесенного заболевания можно провести курс дезинтоксикации.
Протоколы лечения Министерства здравоохранения РФ
Применение интерферона альфа отражено в следующих клинических рекомендациях, одобренных, в том числе, Министерством здравоохранения Российской Федерации (протоколах лечения):
– Оказание медицинской помощи детям больным инфекционным мононуклеозом v
– Оказание медицинской помощи детям больным ветряной оспой vi
– Оказание медицинской помощи детям больным цитомегаловирусной инфекцией vii
– Ветряная оспа у взрослых viii
– Простой герпес у взрослых ix
– Опоясывающий лишай (herpes zoster) у взрослых x
– Инфекционный мононуклеоз у взрослых xi
– В ряде других заболеваний, в том числе, вирусных, грибковых xii
Справочно-информационный материал
Автор статьи
Врач общей практики
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
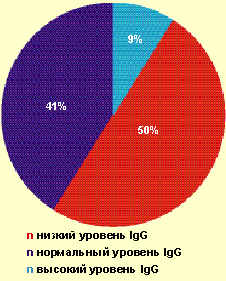 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
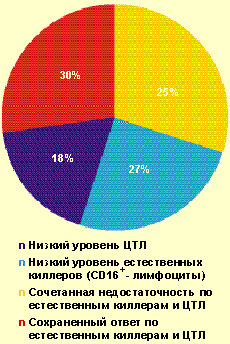 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва