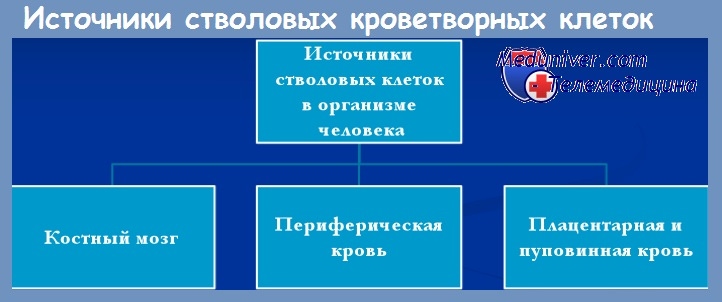
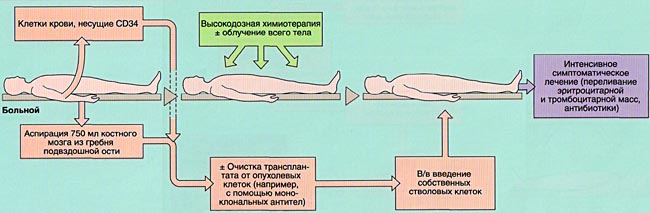
когда требуется пересадка костного мозга
Когда требуется пересадка костного мозга
Целью пересадки костного мозга является замена поврежденных или отсутствующих гематопоэтических клеток получателя, клетками донора в норме. Непрерывное возобновление миелоидного и лимфоидного клеточных рядов обеспечивается клетками костного мозга, ряда полипотентного штамма. Следовательно, по существу, пересадка костного мозга это перевивка клеток штамм.
При выборе донора отдавать предпочтение, в первую очередь, однояйцевым близнецам, одинаковых с точки зрения тканевой совместимости. Но так как подобная возможность представляется исключительно редко, наиболее частые пересадки используют костный мозг брата или сестры, при условии их идентичности с получателем по наиболее важному комплексу гистосовместимости (идентичный HLA — А и В, также смешанный отрицательный лимфоцитный тест). К отбору костного мозга от нероднящихся лиц, даже при соответственной гистосовместимости, прибегать лишь в случаях крайней необходимости.
В случае пересадки от однояйцевого близнеца или при комбинированном иммуном недостатке, получателя не следует подвергать подготовке. Во всех остальных случаях проводить иммуносупрессорную терапию в целях развития переносимости получателя к перевиваемым ему клеткам. У больных с апластической анемией для индуцирования такой переносимости применять циклофосфамид в количестве 50 мг/кг веса тела, в течение последовательных 4 дней. По истечении 36 часов от последней дозы, пересадить костный мозг.
При злокачественных заболеваниях, в частности острой лейкемии, подготовка получателя преследует также цель устранения злокачественных клеток.
Предпочтение отдается сочетанию общего облучения дозой 900—1000 рад. и циклофосфамида. Избегать переливания крови вообще, а от будущего донора костного мозга — в частности, для предотвращения иммунизации получателя к антигенам гистосовместимости, находящимся на лейкоцитах и тромбоцитах.
Техника пересадки костного мозга относительно несложна. Костный мозг отбирать в условиях общей анестезии путем ряда пункций в грудину и подвздошную кость. Отбирать 300—500 мл костномозговой массы, что у получателя должно соответствовать 10 8 —10 9 ядерных клеток/кг веса тела. После фильтрации костномозговая масса вводится больному капельным внутривенным путем. По иной технике внутривенное введение костного мозга проводится непосредственно после отбора, с помощью специального шприца (Mathe и сотр.).
Больной должен получать их до момента, когда он станет способным вырабатывать большее количество гранулоцитов, чем получаемое путем переливания. В целях предупреждения инфекции подобных больных определять в больницу и помещать в асептическую изоляционную палату.
Когда в результате действия трансплантата больной преодолевает стадию костномозговой аплазии, следующей угрозой является воздействие, вырабатываемых перевитыми полипотентными клетками-штамм, лимфатических клеток на ткани и органы получателя. Эта реакция трансплантата против получателя весьма тяжелая, она развивается у примерно 70% больных, получивших костный мозг от братьев или сестер с одинаковыми первостепенными гистосовместимыми системами.
В таких случаях поражены кожа, печень, кишечник, повышается температура, уменьшается вес тела, развиваются понос и желтуха. При тяжелой форме смертность составляет 85%. Лечения метотрексатом, эндоксаном и преднизоном мало эффективны.
Бактериальная, вирусная и грибковая инфекции составляют наиболее частую причину смертельного ихсода за счет агранулоцитоза, иммуной недостаточности и реакции трансплантата против получателя. Легочные инфекции, обусловливаемые цитомегалическим вирусом или Pneumocistis carinii считаются наиболее опасными.
Показания к пересадке костного мозга касаются, в первую очередь, апластической анемии, независимо от этиологии. В таких случаях преследовать повторное заселение костного мозга больного нормальными клетками-штамм.
Недавно отмечен прогресс в отношении выживания больных, страдающих апластической анемией после пересадки, именно в тех случаях, когда пересадка делается до получения больным переливаня крови или клеточных концентратов. В этой группе выживаемость составила более 70 % больных. У большинства погибших была доказана функциональность пересаженных клеток; смертные исходы были отнесены за счет инфекции или реакции трансплантата против получателя. Пересадка костного мозга предоставила лишний аргумент по вопросу патогенеза за счет дефекта клеток-штамм при апластической анемии.
При врожденной иммуной недостаточности (иммуный недостаток в сочетании с синдромом di George) предложена пересадка костного мозга для заселения вновь центральных лимфатических органов клетками-предшественниками нормальных лимфоцитов. Больные не нуждаются в иммуносупрессии, при этом число необходимых клеток-штамм значительно меньше. Возможно назначение концентратов клеток-штамм малыми повторными дозами.
К сожалению выживают лишь больные, получившие костный мозг от однояйцевого близнеца; в остальных случаях реакция трансплантата против получателя, полностью лишенного иммуной защиты, крайне тяжелая.
В отношении страдающих острой лейкемией для которых донором является однояйцевой близнец, вопрос о назначении пересадки костного мозга может быть принят во внимание с появлением болезни. Неудачные случаи отнесены за счет возвратного лейкемического процесса примерно спустя 7 недель после облучения и пересадки. В нескольких случаях удалось обнаружить злокачественное преобразование клеток донора.
Добавление химиотерапии, до облучения, и иммунотерапии лимфоцитами донора и инактивированными лейкемическими аутологическими клетками после пересадки, улучшило результаты. Отдельные больные, леченные этим способом, продолжают жить более 4 лет. Результаты слабее, когда донор костного мозга не однояйцевой близнец. Однако из 100 больных, леченных бригадой Е.Д. Томаса, 13 живут уже более 3 лет на стадии полной ремиссии, без какого-либо поддерживающего лечения.
Одинаковый способ применяли страдающим твердой опухолью (нейтробластома, лимфома), однако подобных случаев мало и результаты нечеткие. Следует особо отметить случаи аутологической пересадки костного мозга страдающим подобными опухолями. Отбор костного мозга у данного больного и его хранение при температуре —80° или —180° делают терапию более активной. Костномозговая аплазия, обусловленная терапией устраняется применением законсервированных аутологических костномозговых клеток.
Опыт радиобиологической клиники Больницы Фундень насчитывает 22 случая остеосаркомы, леченных крупными дозами циклофосфамида (9,5—11,1 г. в течение 10—11 дней). Асептическое изолирование и применение костного мозга от однояйцевого близнеца, в случаях тяжелой костномозговой аплазии и инфекционного синдрома, привели к ремиссии аплазии и сделали возможным подход к радиотерапевтическому и/или хирургическому лечению больного. Пересадка аутологического костного мозга может оказаться полезной и при бластическом припадке в условиях хронической гранулоцитной лейкемии.
При этом костномозговые клетки, законсервированные в хронический период болезни, впрыскиваются при появлении костномозговой аплазии после усиленных химио- и радиотерапии.
При случайной острой лучевой болезни пересадка костного мозга составляет единственную возможность для выживания пострадавшего. Летальная доза облучения у человека составляет более 600 рад. — когда облучение носит общий характер. Назначать однозначные костномозговые клетки спустя 6—10 дней после общего летального облучения. Возможно осуществление постоянного трансплантата, со всеми соответствующими последствиями, или временную пересадку до восстановления структур, способствующих возобновлению собственного кроветворения.
В случае облучения, при котором определенная часть костного мозга остается неповрежденной, можно расчитывать на повторное обсеменение отмершего костного мозга клетками-штамм, выходящими из оставшейся нормальной территории.
Когда же доза облучения превышает 1000 рад. степень поражения костномозговой стромы делает невозможной колонизацию гомологичными клетками-штамм.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Когда нужна пересадка костного мозга?
Пересадка костного мозга — это метод лечения, который используется при различных заболеваниях крови, преимущественно онкологического характера. Его актуальность постоянно растет, поскольку, согласно данным ВОЗ, только лейкемией и лимфомой заболевают до 600 тыс. человек ежегодно. На сегодняшний день количество трансплантаций, выполненных в мире, приближается к 2 млн.
Что такое костный мозг?
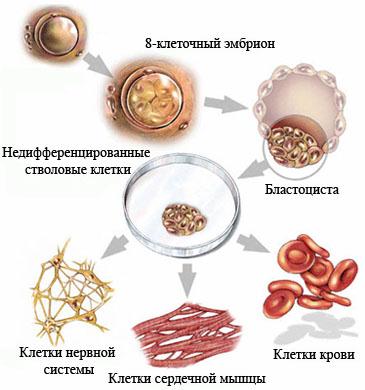
Он представляет собой мягкую губчатую ткань внутри костей. В костном мозге из стволовых клеток производится большая часть клеток крови. На самом раннем этапе развития стволовые клетки называются плюрипотентными — они способны превратиться в любую другую клетку нашего организма. Суть пересадки костного мозга как раз и состоит в том, чтобы у человека появились новые, здоровые плюрипотентные стволовые клетки взамен поврежденных.
Что такое пересадка костного мозга?
Первая успешная трансплантация такого рода была проведена еще в 1968 году. С тех пор процедура многократно совершенствовалась. Сегодня в ней выделяют три этапа:
Зачем нужна трансплантация?
Костный мозг пациента может быть поврежден из-за воздействия многих факторов. Наиболее частым из них становится онкологическое заболевание, которое поражает стволовые клетки, в результате чего они теряют способность дифференцироваться и превращаться в зрелые, функционально полноценные клетки крови.
Иногда ткани костного мозга могут необратимо повреждаться под действием длительной химиотерапии или интенсивного лучевого лечения других типов злокачественных опухолей. Соответственно, пересадка может использоваться для:
Важно понимать, что операция по пересадке костного мозга — крайне сложная медицинская манипуляция. Применять ее следует только при наличии строгих показаний. В каждом отдельном случае риски и преимущества такого лечения должны быть тщательно взвешены в ходе обсуждения с лечащим врачом и специалистами по трансплантации.
При каких заболеваниях показана такая пересадка?
Чаще всего процедуру проводят при следующих патологиях:
Типы трансплантации костного мозга
Классифицируют такие процедуры по типу донора и выделяют следующие виды манипуляций:
Центр трансплантации костного мозга клиники «Анадолу»
На базе нашего медицинского центра с 2010 года функционирует специализированный центр пересадки костного мозга. В среднем врачи «Анадолу» проводят 250 пересадок в год у пациентов от 16 лет и старше.
В состав центра входят амбулатория, клиническое отделение трансплантации костного мозга и три лаборатории: генетического типирования, гемофореза, криоконсервации и обработки стволовых клеток. Наши специалисты — высококвалифицированные трансплантологи и гематологи, владеющие всеми современными методиками пересадки костного мозга. В своей работе они неукоснительно следуют международным протоколам лечения онкологических заболеваний крови и соблюдают все меры предосторожности и безопасности.
Отделение трансплантации костного мозга «Анадолу» работает не только с международным, но и турецким банком костного мозга, который позволяет максимально быстро — всего за несколько недель — подобрать подходящего донора. В мировом регистре этот процесс может занимать несколько месяцев.
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 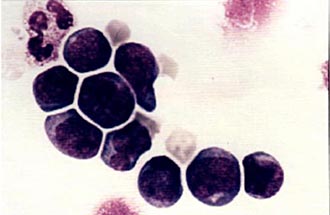 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
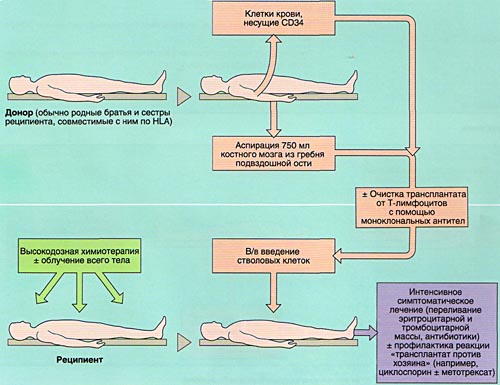
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
ЧТО СЛЕДУЕТ ЗНАТЬ О ПЕРЕСАДКЕ КОСТНОГО МОЗГА
В народе когда говорят «пересадка костного мозга», подразумевают пересадку стволовых клеток. В этом смысле костный мозг понимается как источник стволовых клеток. У взрослых источником стволовых клеток может выступать кровь. Также стволовые клетки извлекаются из пуповинной крови.

При каких заболеваниях требуется пересадка костного мозга?
— Первую группу составляют заболевания крови. На первом месте стоит лейкемия. При лейкемии, которая не поддается лечению, или рецидивирующей лейкемии, особенно при таких заболеваниях, как острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз трансплантация костного мозга имеет важное значение. Хотя при диагнозе «острый лимфобластный лейкоз» пересадка может быть первым методом лечения. Заболевания, при которых костный мозг вообще не вырабатывает клетки крови, таких как апластическая анемия, трансплантация костного мозга является единственным методом лечения. Этот вид заболевания может быть врожденным, а также может развиться со временем. Некоторые вирусы, химические вещества и лекарства могут привести к апластической анемии. При врожденных заболеваниях крови пересадка костного мозга также занимает важное место. В лечении талассемии, известной как средиземноморская анемия, серповидно-клеточной анемии и при некоторых других редких заболеваниях крови пересадка костного мозга применяется как единственный метод лечения.
Следом за болезнями крови идут онкологические заболевания. Наблюдаемая у детей неходжкинская лимфома возглавляет этот перечень, следом идут болезни, не поддающиеся лечению другим образом или рецидивирующие, лимфома Ходжкина в случае рецидива. Для пациентов с такими диагнозами трансплантация костного мозга является единственным шансом на спасение.
Кто может быть донором костного мозга?
— В донорстве костного мозга может использоваться пуповинная кровь, сохранившаяся в плаценте и пупочной вене после рождения ребенка.

Существует ли опасность для донора?
— Вокруг трансплантации костного мозга существует много заблуждений относительно вреда для донора. Также как и при пересадке печени или почек, подобная ошибочная информация приводит к тому, что люди не хотят выступать донорами. Однако процедура трансплантации не несет в себе никакого вреда. Тем не менее, дети возрастом до 2 лет и те, кто старше 60 лет, не рассматриваются в качестве донора костного мозга. Перед забором стволовых клеток проводятся анализы крови, при которых изучаются ее показатели. Для оценки общего состояния пациента, проводятся медицинские обследования, в ходе которых исследуется печень, почки и кровь.
Аллогенная трансплантация проводится в операционной. Забор стволовых клеток осуществляется с помощью специальной иглы, которая вводится непосредственно в тазовую кость, где располагается основной резервуар костного мозга. Затем контейнер содержащей стволовые клетки доставляется в лабораторию для отбора стволовых клеток. Отбор стволовых клеток проводится на аппарате афереза. После этого оценивается количество живых клеток, на основании чего определяется, подходит ли отобранное количество для рецепиента. Если количество достаточное, то начинается подготовка к трансплантации. Количество костного мозга после забора у донора восстонавляется в течении 2-х недель.
Как осуществляется пересадка?

Что ожидает пациентов после трансплантации?
— В случае если у пациента онкологическое заболевание крови, для подавления деффектных клеток больному проводят курс лечения ХТ благодоря, которой разрушаются не только раковые клетки пациента, но и здоровые клетки костного мозга. Только после такого рода лечения, становиться возможным пересадка здорового донорского костного мозга. После начинается период иммунносупрессивной терапии, направленная на подавление иммунной системы пациента, которая может считать пересаженные клетки чужеродными.
Однако, это делает человека беззащитным перед инфекциями из внешнего мира. Поэтому основные усилия направлены на то, чтобы пациент ничем не заразился.
На 14-й дней после трансплантации определяется, воспроизводятся пересаженные клетки или нет. Однако, до достижения определенного количества клеток крови в течение 30-40 дней пациент содержится в стерильной среде. Если количество клеток увеличилось, то процедура трансплантации считается успешной. За этот период происходит увеличение числа кровяных клеток, вырабатываются эритроциты, лейкоциты и тромбоциты, а также если никакой инфекции не обнаружено, пациент может использовать общую среду с другими пациентами в больнице и переводится из бокса в отделение. Пациент находиться в клинике в течение 45-60 дней. После лечения, если состояние пациента удовлетворительное, больной выписывается. Следует так же отметить, что в течении года после выписки, пациенту необходимо находиться под потоянным контролем врача для обеспечения защиты от инфекций и контроля его восстановления.
Очень повезло, что у меня есть братья!
История 16 летней девочки из Аданы Х.Ф. с диагнозом лейкемия, которая выздоровела благодаря пересадке костного мозга от старшего брата.
Проф.Док. Бюлент Антмен знает эту пациентку в течение четырех лет. Отец на пенсии, мать домохозяйка, в семье 9 детей, Х.Ф. родилась шестой. Рассказывая о том, как началась ее болезнь, она говорит следующее: «В то время я училась в шестом классе. Был экзамен. У меня кружилась голова, тошнило. Я не смогла ответить на вопросы, хотела все выбросить из головы и уйти домой. Ушла из школы, с трудом добралась до дома. В аптеке купили лекарство от тошноты. Не помогало, пошли в больницу, оттуда отправили на обследование в Медицинский факультет университета Acibadem. Лечащим врачом стал доктор Бюлент Антмен…»

Доктор принял решение для первой попытки пересадки взять клетки у старшего брата, если будет отторжение, тогда у сестры. Первая попытка оказалась успешной.
Х.Ф. безостановочно рассказывает о своих планах после выздоровления: «Хочу пойти в школу. Поступлю в лицей. Я вижу своих друзей и волей-неволей расстраиваюсь. Вначале переживала из-за волос, но теперь не думаю об этом, как бы то ни было заново отрастут. Эта болезнь меня многому научила. Вместо того, чтобы жаловаться, пытаюсь смотреть на ситуацию с хорошей стороны. Хочу выучиться и получить профессию».