женщина может оплодотворить себя костным мозгом
Мы близки к тому, чтобы делать детей из стволовых клеток. Чем это грозит?
В 2007 году группа исследователей сообщила о поразительном открытии: они создали подобные сперматозоидам клетки из стволовых клеток, полученных из костного мозга человека. Однако два года спустя исследование было удалено из-за обвинений в плагиате. И вот, тринадцать лет спустя, способность создавать функциональную человеческую сперму из стволовых клеток остается задачей многих ученых во всем мире. Ведь это могло бы раз и навсегда решить проблему людей, у которых не получается зачать ребенка. И получить при этом надежду на дальнейшую эволюцию. И судя по результатам исследований, получить сперматозоиды из стволовых клеток гораздо реальнее, чем попасть в черную дыру.
С помощью костного мозга человечество оказалось на пороге репродуктивной эволюции
Можно ли создать половые клетки из стволовых клеток
Ученые пытались выяснить, как создать функционирующие человеческие гаметы — яйцеклетки и сперму — из стволовых клеток в течение 20 или 30 лет, говорит Витторио Себастьяно, биолог из Стэнфордского университета, чьи исследования сосредоточены на репродуктивной биологии. Это поможет людям, борющимся с бесплодием, иметь детей, а ученые смогут раскрыть секреты человеческого развития. С 2007 года они добились значительного прогресса в этом направлении, создав здоровых детенышей мышей из гамет, генерируемых стволовыми клетками, и даже незрелые яйцеклетки человека. Но впереди еще долгий путь, прежде чем ученые смогут превратить костный мозг в человеческих младенцев.
Мы действительно пытаемся найти способы эффективно и надежно генерировать половые клетки, которые в краткосрочной перспективе можно использовать для зачатия детей, — говорит Себастьяно.
Чем это отличается от ЭКО
Когда в 1978 году родился первый ребенок, зачатый с помощью экстракорпорального оплодотворения (ЭКО), это стало большим шагом вперед в репродуктивной науке и предвестником исследований стволовых клеток, проводимых сегодня. Но ЭКО не подходит для каждого человека или пары, пытающейся завести ребенка. Например, его нельзя сделать тем, кто родился без гамет или получил агрессивное лечение рака в молодом возрасте. Новый научный метод предоставит этим людям новый шанс на рождение своих детей.
Следующий важный шаг был сделан в 2000-х годах, когда были созданы индуцированные плюрипотентные стволовые клетки (ИПСК). Эти клетки получают из клеток крови или кожи и перепрограммируют, чтобы превратить их в эмбриональные клетки, которые смогут развиваться в организме. С тех пор исследователи пытались выяснить, как превратить эти эмбрионоподобные клетки в функциональные сперматозоиды и яйцеклетки.
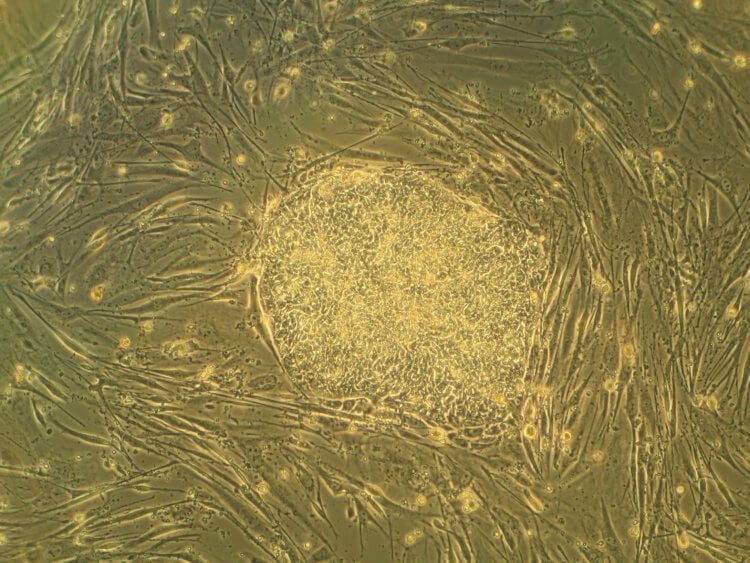
Колония индуцированных плюрипотентных стволовых клеток, используемых для лечения редкого генетического заболевания — анемии Фанкони.
По словам Себастьяно, эта работа отчасти осложнялась тем, что ученые не могли полностью понять, что происходит с человеческим эмбрионом во время нормального развития. Ученые разбирают этот процесс на мышах, потому что грызунов легко изучать в лаборатории. Но этические ограничения и технические факторы (например, доступ к эмбрионам в нужный момент) затрудняют изучение этого явления на людях.
Искусственно выращенные яйцеклетки
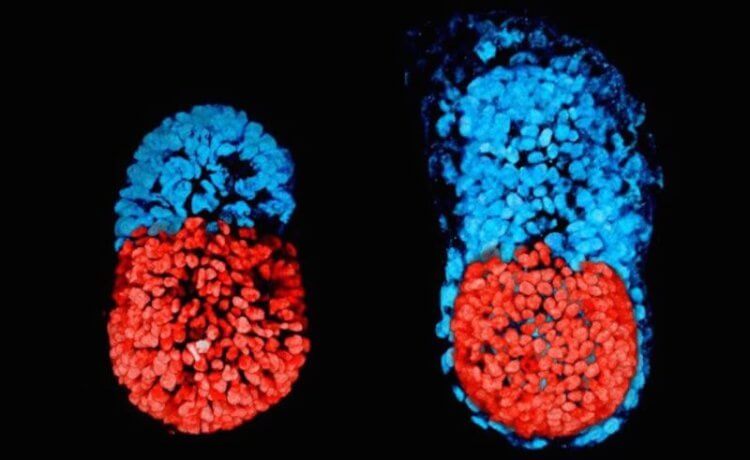
Несмотря на препятствия, ученые добились значительного прогресса за последние 10 лет. В 2012 году группа исследователей в Японии создала оплодотворенные яйца мышей из стволовых клеток и использовала эти яйца для выведения здоровых мышей. Таким образом ученые показали, что можно заставить эти клетки стать полностью функциональными яйцеклетками или спермой.
Группа ученых смогла превратить стволовые эмбриональные клетки мыши в клетки, функционирующие как сперматозоиды.
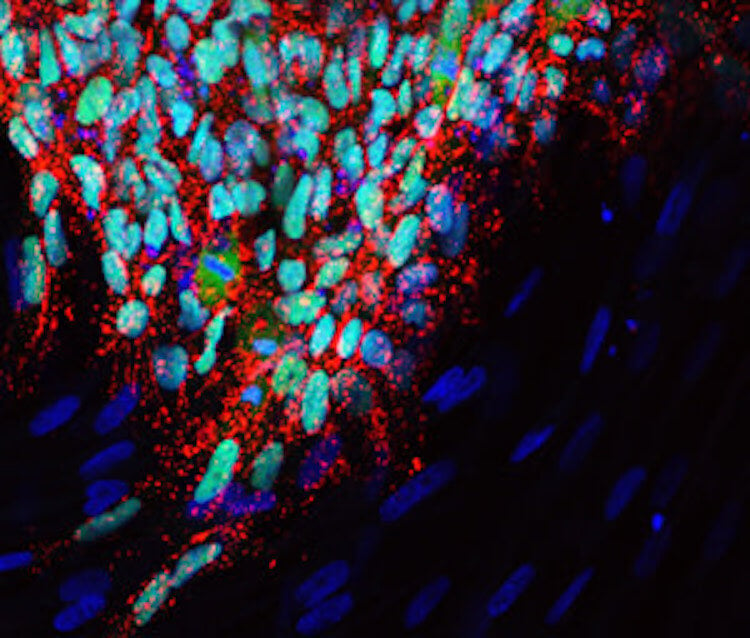
В 2018 году та же группа японских ученых совершила еще один крупный прорыв. Используя клетки крови человека и технику плюрипотентных стволовых клеток, им удалось произвести человеческую яйцеклетку.
По словам ученых, аналогичные попытки предпринимаются и для создания спермы. На протяжении многих лет проводилось несколько экспериментов создать спермоподобные клетки, в том числе во время исследования костного мозга в 2007 году. Вероятно, в ближайшие несколько лет мы сможем генерировать полностью функциональные сперматозоиды и яйцеклетки. Однако вопрос будет в том, как ученые проверят качество этих гамет.
Первый в истории науки эмбрион, созданный без готовых яйцеклеток и сперматозоидов. Достичь этого получилось благодаря выращиванию эмбриона из стволовых клеток прямо в чашке Петри на микроскопическом 3D-каркасе из геля.
Чем опасно выращивание детей из стволовых клеток?
Единственный способ полностью оценить качество и функциональность спермы или яйцеклетки — это использовать их, то есть попытаться оплодотворить другую гамету и произвести на свет ребенка. Вот почему к этой работе нужно подходить с особой осторожностью. Как только ученые разработают методы, которые, по их мнению, производят зрелые человеческие яйцеклетки и сперму, следующим шагом будет тестирование этих наработок на приматах. Таким образом исследователи могут проследить всю жизнь отдельных животных, выращенных с помощью этого метода, чтобы увидеть, не возникнут ли какие-либо неожиданные проблемы, говорит Себастьяно.
Если вам интересны такие исследования, подпишитесь на нас в Яндекс.Дзен, чтобы не пропускать новые материалы!
Биолог не сомневается, что однажды эти стволовые клетки могут помочь людям, борющимся с бесплодием, произвести на свет здоровых детей. Конечно, есть также важные этические соображения, которые необходимо тщательно учитывать. Он отмечает, что этот метод может повлиять на человеческую жизнь на уровне поколений. И многие люди также обеспокоены другими последствиями в будущем, такими как способность создавать «дизайнерских младенцев» или производить потомство из волос, украденных у ничего не подозревающих знаменитостей. Необходимо начать прорабатывать медицинские и юридические вопросы, связанные с этим методом, сейчас, прежде чем он станет жизнеспособным.
Очевидно, существует необходимость в создании детей данный способом, но поскольку мы действительно имеем дело с очень уникальным типом клеток… нам нужно быть осторожными.
Возраст как причина снижения репродуктивного потенциала. Пути преодоления бесплодия у женщин старшей возрастной группы. Донорство ооцитов
ВОЗРАСТНОЕ СНИЖЕНИЕ РЕПРОДУКТИВНОЙ ФУНКЦИИ НЕИЗБЕЖНО. СКОРОСТЬ ЭТОГО СНИЖЕНИЯ ОПРЕДЕЛЯЕТСЯ СОЧЕТАНИЕМ ГЕНЕТИЧЕСКИХ ФАКТОРОВ И ВЛИЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ. ДАННАЯ ОСОБЕННОСТЬ ЖЕНСКОГО ОРГАНИЗМА ДАЕТ ВОЗМОЖНОСТЬ ЗАЧАТИЯ В ТОМ ВОЗРАСТЕ, КОГДА МОЛОДАЯ ЗДОРОВАЯ ЖЕНЩИНА МОЖЕТ ПОЛНОЦЕННО ЗАБОТИТЬСЯ О СВОИХ ДЕТЯХ. ОКОНЧАТЕЛЬНОМУ УГАСАНИЮ РЕПРОДУКТИВНОЙ ФУНКЦИИ ПРЕДШЕСТВУЕТ ПОЗДНИЙ РЕПРОДУКТИВНЫЙ ПЕРИОД, В КОТОРОМ СПОСОБНОСТЬ К ЗАЧАТИЮ УЖЕ КРАЙНЕ НИЗКА.
В позднем репродуктивном периоде у женщины еще присутствуют менструации, но способность к зачатию резко снижается. Гормональная функция яичников прекращается в возрасте менопаузы, то есть обычно ближе к 50 годам. На практике после 40 лет получить беременность с собственными ооцитами даже при ЭКО достаточно сложно.
КОГДА НАЧИНАЕТСЯ ПОЗДНИЙ РЕПРОДУКТИВНЫЙ ПЕРИОД?
В настоящее время он сдвинут уже к 35–38 годам. Такое увеличение возраста объясняется современными социальными реалиями, в которых женщина откладывает рождение детей на возраст после 30 лет из-за необходимости обучения, получения профессии, карьеры и создания материальной базы для будущих детей. Но мало кто из женщин знает, что инволютивные процессы, снижающие вероятность спонтанной беременности, начинаются уже после 30 лет и после 35 лет значительно ускоряются.
КОГДА ЗАКАНЧИВАЕТСЯ РЕПРОДУКТИВНЫЙ ВОЗРАСТ?
По определению ВОЗ, репродуктивный возраст определен до 49 лет. Это значит, что у большинства женщин к 49 годам теряется способность к спонтанной беременности. Но на самом деле данная способность у большинства женщин теряется значительно раньше. И это данные средние по популяции, не учитывающие синдром преждевременного истощения яичников и оперативные вмешательства на яичниках. Зная это, врачам необходимо вовремя ориентировать пациенток на вспомогательные репродуктивные технологии, а не тратить время на восстановление естественной фертильности.
Существует представление, что женщина способна к зачатию до тех пор, пока у нее присутствует менструация и определяются фолликулы. Но в подавляющем большинстве случаев это не так. Каковы же основные патогенетические механизмы снижения фертильности у женщин старшего возраста? Их всего два: снижение количества яйцеклеток и снижение качества яйцеклеток, причем вторая причина мешает зачатию значительно больше, чем первая, а врачи часто учитывают только количество яйцеклеток, ориентируясь на количество фолликулов на УЗИ. Известно, что с возрастом все меньше фолликулов инициируются к росту в каждом цикле. Так, по данным M. Faddy и R. Gosden, в возрасте 20–25 лет ежедневно происходит рост 50 примордиальных фолликулов, в 34–35 лет – 17 фолликулов, а в 44–45 лет – не более трех, да и скорость атрезии фолликулов после 36 лет возрастает вдвое, что, конечно, приводит к истощению фолликулярного резерва. Но, казалось бы, для беременности достаточно одной яйцеклетки, тогда почему же она не наступает даже при наличии трех и более яйцеклеток? Именно потому, что для беременности необходима одна генетически и морфологически полноценная яйцеклетка, способная к оплодотворению. А вот именно таких яйцеклеток после 35 лет становится катастрофически мало и с каждым годом все меньше. Поэтому, чтобы получить полноценную яйцеклетку после 40 лет, приходится переработать большое количество материала. Иногда удается попасть на такую яйцеклетку с первой попытки ЭКО, и тогда мы получаем беременность с первого раза. Но зачастую приходится повторять попытки именно по причине плохого качества получаемых эмбрионов.
ЧТО ПРОИСХОДИТ С ЯЙЦЕКЛЕТКАМИ С ВОЗРАСТОМ?
Результаты цитогенетического анализа ооцитов, полученных у пациенток различных возрастных групп, показывают планомерное увеличение их дегенеративных форм у женщин старше 35 лет. По данным Боярского К. Ю. и Гайдукова С. Н., в ооцитах обнаруживаются деформация и лизис структурных элементов, фрагментация и вакуолизация ядра и другие визуальные признаки клеточной дегенерации. В геноме эмбрионов, полученных из ооцитов женщин старшей возрастной группы, значительно увеличивается частота хромосомных аномалий. Чаще всего встречаются анеуплоидии из-за нерасхождения хромосом или запаздывания хромосомы при анафазном движении. Анеуплоидии могут проявляться моносомией или трисомией по какой-либо паре хромосом. Наиболее часто встречающиеся трисомии – это синдром Дауна (21 пара), синдром Эдвардса (18 пара) и синдром Патау (13 пара), а моносомии – это синдром Шерешевского-Тернера (Х-хромосома). Но их частота очень условна, так как эти патологии чаще диагностируются у доношенных плодов именно потому, что возможно донашивание беременности и рождение ребенка с данными патологиями. Трисомии же по остальным парам приводят к полной нежизнеспособности эмбрионов и, соответственно, к прерыванию беременности на более ранних сроках и поэтому остаются недиагностированными и неучтенными. Именно благодаря им частота невынашивания у женщин старшей возрастной группы значительно выше, чем у молодых женщин. Данные, учитывающие распространенность хромосомных аномалий не только у новорожденных, но и у абортусов, позволяют сделать вывод, что у женщин старше 42 лет до трети всех зачатий имеют отклонения в генетике эмбрионов. Более же грубые нарушения в генетике яйцеклетки приводят к тому, что она не оплодотворяется и беременность попросту не наступает.
ПОКАЗАНИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ ДОНОРСКИХ ООЦИТОВ ПОДРАЗДЕЛЯЮТ НА АБСОЛЮТНЫЕ И ОТНОСИТЕЛЬНЫЕ
КАК ПРЕОДОЛЕТЬ ДОСТАТОЧНО СЕРЬЕЗНЫЙ БАРЬЕР ГЕНЕТИКИ НА ПУТИ К БЕРЕМЕННОСТИ?
Пути здесь два. Первый – это повторять процедуры ЭКО до тех пор, пока не удастся получить жизнеспособный эмбрион. Этот способ достаточно сложен и с финансовой точки зрения, и с точки зрения гормональной нагрузки на организм женщины. Одним из путей решения этих проблем может быть применение ЭКО в естественном цикле. Данный вид ЭКО используется, если у женщины в процессе стимуляции не удается вырастить больше одного ооцита. При нем не применяются стимулирующие препараты, пунктируется только один фолликул, выросший у женщины самостоятельно. Это позволяет уменьшить гормональную нагрузку на организм женщины в ходе многочисленных стимуляций, а также удешевить каждую попытку ЭКО. Но существенным недостатком данного метода является высокая частота преждевременной овуляции фолликула, когда на протяжении нескольких месяцев не удается произвести пункцию фолликула по причине его овуляции до пункции. На практике же получить беременность даже ежемесячными процедурами ЭКО у женщин старшей возрастной группы достаточно сложно, а зачастую и невозможно. На сегодняшний день не существует способов улучшить качество ооцитов у женщины и заставить работать ее яичники лучше, поэтому возникает необходимость брать яйцеклетки у женщин, у которых они хорошего качества и достаточного количества.
В связи с этим более выгодным видится второй путь – это использование донорских ооцитов. Безусловно, решение об использовании донорского материала должна принимать исключительно супружеская пара. Врач обязан разъяснить, что данный ребенок не будет генетически родным для женщины, а будет генетически родным только мужчине. Переходить к использованию донорского материала необходимо, исключительно если все остальные способы получения беременности в данной паре исчерпаны. Очевидной причиной более высокой эффективности программ ЭКО с использованием донорских ооцитов является то, что в них используются яйцеклетки молодых женщин, имеющие лучшее качество, в которых значительно реже встречаются хромосомные аберрации. Это доказывает, что для наступления беременности важнее качество ооцитов, а не соматический и гинекологический статус пациенток (не учитывая, конечно, грубую соматическую или гинекологическую патологию, препятствующую наступлению и вынашиванию беременности).
В настоящее время к донорским ооцитам обращаются до 20% пациенток, выполняющих ЭКО. Такому увеличению частоты использования донорского материала в последнее время поспособствовало значительное усовершенствование методов криоконсервации эмбрионов, позволяющее обеспечить 95% выживаемости эмбрионов после разморозки. Применяемая в настоящее время витрификация эмбрионов позволяет замораживать, хранить и размораживать эмбрионы без потери их качества и жизнеспособности. Поэтому в большинстве донорских программ используются именно замороженные эмбрионы. Это более удобно, не требует синхронизации циклов биологической матери и донора ооцитов и позволяет максимально адекватно подготовить эндометрий реципиента к переносу эмбрионов.
Обследование донора ооцитов проводится практически в том же объеме, что и при стандартной подготовке к программе ЭКО, дополнительно необходимо заключение психиатра и генетическое обследование. Донором ооцитов может быть соматически, психически и гинекологически здоровая женщина 19–35 лет.
Согласно существующему законодательству использование донорских ооцитов возможно только при полном информированном согласии обоих супругов и донора ооцитов. Обязательно оформление соответствующих нормативных документов. Финансовые вопросы регламентируются либо пациентами самостоятельно (например, в случае привлечения в качестве донора ооциов родственников или знакомых пары), либо специализированными юридическими агентствами. Медицинскому персоналу следует воздержаться от финансовой стороны вопроса.
В заключение хотелось бы сказать, что получение беременности у женщин старшего репродуктивного возраста – достаточно сложная, трудоемкая и длительная работа. Учитывая длительность и малую результативность этих усилий, зачастую пациентка отчаивается получить беременность и отказывается от дальнейшего лечения. В эти моменты возможно и даже желательно использовать помощь психологов, которая позволяет женщине наименее болезненно пережить все этапы необходимого лечения.
Стволовые клетки костного мозга необходимы для наступления беременности
Согласно исследованию ученых Йельского университета, костный мозг может играть определяющую роль в способности женщины забеременеть. В экспериментах на мышах авторы работы установили, что после оплодотворения яйцеклетки стволовые клетки костного мозга перемещаются через кровоток в матку, где помогают преобразовать слизистую оболочку матки, чтобы к ней мог присоединиться эмбрион. Если этого присоединения (имплантации) не происходит, эмбрион гибнет на ранней стадии развития.
«Мы всегда знали, что для беременности необходимы две вещи, — говорит доктор Хью Тейлор (Hugh Taylor), старший автор исследования. — У вас должны быть яичники, чтобы производить яйцеклетки, а также у вас должна быть матка, чтобы получить эмбрион. Но знание о важной роли костного мозга стало изменением парадигмы». Его коллега Решеф Таль (Reshef Tal) объясняет: «Некоторые из этих мезенхимальных стволовых клеток, происходящих из костного мозга, перемещаются в матку и становятся децидуальными клетками, которые являются клетками, необходимыми для процесса имплантации и поддержания беременности».
Благодаря этим клетком внутренняя слизистая оболочка матки (эндометрий) превращается в так называемую децидуальную, или отпадающую оболочку, которая развивается в области имплантации эмбриона, а затем распространяется на всю внутреннюю поверхность матки. Особые части этой оболочки входят в состав плаценты и образуют оболочку зародыша.
В нынешнем исследовании у мышей с дефектом гена Hoxa11, который проявляется в нарушении развития эндометрия, пересадка костного мозга от здорового донора повышала шансы на благополучную беременность, способствуя достаточному развитию децидуальной оболочки. Этот эксперимент стал возможен благодаря прорыву, который Таль и Тейлор совершили несколько лет назад, когда сумели провести пересадку костного мозга самкам мышей, сохранив у них здоровые яйцеклетки (обычно перед трансплантацией донорского костного мозга уничтожают все клетки имеющегося костного мозга при помощи радиации или химиотерапии). Ученым удалось найти препарат, уничтожающий костный мозг, но не наносящий вреда яйцеклеткам.
Таль, Тейлор и их коллеги намерены перенести свои исследования на людей и попытаться при помощи стволовых клеток костного мозга лечить случаи невозможности имплантации эмбриона. «Когда у пациента поврежден эндометрий, что приводит к бесплодию или повторной потере беременности, слишком часто мы не можем это исправить. Костный мозг можно считать еще одним важным репродуктивным органом. Это открытие дает новые возможности для лечения заболевания, которое раньше было неизлечимо», — считает Таль. Хотя перед началом клинических испытаний необходимо еще провести дополнительные исследования, авторы работы рассчитывают, что их метод в конце концов поможет пациентам.
Исследование опубликовано в журнале PLoS Biology.
Однополое оплодотворение, возможно, не за горами: ученые получили сперму из женских клеток
Генетики совершили научный прорыв, научившись получать сперматозоиды из женских эмбрионов. В перспективе благодаря этому лесбийские пары смогут заводить собственных биологических детей, пишет The Daily Telegraph.
Британские специалисты, которые ранее научились превращать взятые у мужчин клетки костного мозга в сперматозоиды, теперь повторили аналогичный эксперимент со стволовыми клетками женщин. (Полный текст на сайте InoPressa.ru).
Открытие совершила группа из Университета Ньюкасла, которая теперь добивается права создать сперматозоиды из клеток костного мозга, взятых у женщин. Если это удастся, их метод станет более практичным, чем при использовании эмбриональных клеток.
В результате у лесбийских пар однажды появится возможность обзавестись детьми, которые будут иметь гены обеих женщин – сперму, полученную из костного мозга одной из них, можно будет использовать для оплодотворения яйцеклетки партнерши.
Мужчины и женщины отличаются друг от друга благодаря так называемым половым хромосомам. И у тех, и у других есть X-хромосома. Но лишь у мужчин имеется Y-хромосома, которая содержит всего несколько генов, но играет важнейшую роль в выработке мужских половых клеток. В связи с этим ученые критически относились к идее о том, что из стволовых клеток женщин можно получать сперматозоиды.
В апреле прошлого года на первых полосах газет оказалось имя Карима Наирнии, профессора биологии из Университета Ньюкасла. Ученому удалось получить примитивные сперматозоиды из стволовых клеток взрослого мужчины. Теперь же он смог повторить эксперимент, получив сперму из стволовых клеток женских эмбрионов. Отчет о данной работе пока не опубликован.
Следующим шагом станет попытка заставить эти примитивные клетки пройти мейоз, чтобы получить достаточное количество генетического материала для оплодотворения. Профессор Наирния продемонстрировал потенциал своего метода в 2006 году, когда с помощью спермы, полученной из эмбриональных стволовых клеток самца мыши, удалось зачать семь детенышей – шестеро из них успешно выросли, хотя и испытывали определенные проблемы.
Теперь ученый с оптимизмом смотрит на получение в лабораторных условиях спермы из женских клеток. «Я считаю, что для науки это в принципе возможно», – заявил профессор журналу New Scientist. Он рассказал, что намерен попросить у университета разрешение на использование женских клеток костного мозга, из которых попытается получить женскую сперму.
В то же время доктор Робин Лоуэлл-Бэдж, эксперт по стволовым клеткам и определению пола из лондонского Национального института медицинских исследований, сомневается, что эксперимент удастся: «Помешает наличие двух X-хромосом. Более того, необходимо, чтобы гены из Y-хромосомы прошли мейоз. То есть перед ними как минимум два непреодолимых препятствия».
Бразильская группа ученых во главе с доктором Ириной Керкис из Института Бутантан в Сан-Пауло утверждает, что ей удалось получить из эмбриональных стволовых клеток самца мыши одновременно сперматозоиды и яйцеклетки – отчет об этом опубликован в журнале Cloning and Stem Cells.
Исследователи пока не продемонстрировали, можно ли оплодотворить полученные таким образом яйцеклетки, чтобы произвести на свет жизнеспособное потомство. Тем не менее, они задумываются о возможности воспроизводства человека с помощью клеток представителей одного пола.
Если все эти эксперименты принесут плоды, то у мужчин-гомосексуалистов также появится возможность предоставлять свои клетки кожи для получения яйцеклетки, затем оплодотворять ее спермой партнера и помещать в утробу суррогатной матери. «Полагаю, это возможно, – говорит доктор Керкис. – Но не знаю, как люди посмотрят на такое с точки зрения этики».
В настоящее время британский парламент обсуждает поправки к закону 1990 года об оплодотворении и эмбриологии человека. От правительства требуют включить в закон разрешение в будущем использовать яйцеклетки и сперматозоиды, выращенные в лаборатории из стволовых клеток.
Как бы то ни было, формулировка, содержащаяся в поправках, разрешит использовать лишь сперму, полученную от мужчин, а яйцеклетки – от женщин.
Когда нужна пересадка костного мозга?
Пересадка костного мозга — это метод лечения, который используется при различных заболеваниях крови, преимущественно онкологического характера. Его актуальность постоянно растет, поскольку, согласно данным ВОЗ, только лейкемией и лимфомой заболевают до 600 тыс. человек ежегодно. На сегодняшний день количество трансплантаций, выполненных в мире, приближается к 2 млн.
Что такое костный мозг?
Он представляет собой мягкую губчатую ткань внутри костей. В костном мозге из стволовых клеток производится большая часть клеток крови. На самом раннем этапе развития стволовые клетки называются плюрипотентными — они способны превратиться в любую другую клетку нашего организма. Суть пересадки костного мозга как раз и состоит в том, чтобы у человека появились новые, здоровые плюрипотентные стволовые клетки взамен поврежденных.
Что такое пересадка костного мозга?
Первая успешная трансплантация такого рода была проведена еще в 1968 году. С тех пор процедура многократно совершенствовалась. Сегодня в ней выделяют три этапа:
Зачем нужна трансплантация?
Костный мозг пациента может быть поврежден из-за воздействия многих факторов. Наиболее частым из них становится онкологическое заболевание, которое поражает стволовые клетки, в результате чего они теряют способность дифференцироваться и превращаться в зрелые, функционально полноценные клетки крови.
Иногда ткани костного мозга могут необратимо повреждаться под действием длительной химиотерапии или интенсивного лучевого лечения других типов злокачественных опухолей. Соответственно, пересадка может использоваться для:
Важно понимать, что операция по пересадке костного мозга — крайне сложная медицинская манипуляция. Применять ее следует только при наличии строгих показаний. В каждом отдельном случае риски и преимущества такого лечения должны быть тщательно взвешены в ходе обсуждения с лечащим врачом и специалистами по трансплантации.
При каких заболеваниях показана такая пересадка?
Чаще всего процедуру проводят при следующих патологиях:
Типы трансплантации костного мозга
Классифицируют такие процедуры по типу донора и выделяют следующие виды манипуляций:
Центр трансплантации костного мозга клиники «Анадолу»
На базе нашего медицинского центра с 2010 года функционирует специализированный центр пересадки костного мозга. В среднем врачи «Анадолу» проводят 250 пересадок в год у пациентов от 16 лет и старше.
В состав центра входят амбулатория, клиническое отделение трансплантации костного мозга и три лаборатории: генетического типирования, гемофореза, криоконсервации и обработки стволовых клеток. Наши специалисты — высококвалифицированные трансплантологи и гематологи, владеющие всеми современными методиками пересадки костного мозга. В своей работе они неукоснительно следуют международным протоколам лечения онкологических заболеваний крови и соблюдают все меры предосторожности и безопасности.
Отделение трансплантации костного мозга «Анадолу» работает не только с международным, но и турецким банком костного мозга, который позволяет максимально быстро — всего за несколько недель — подобрать подходящего донора. В мировом регистре этот процесс может занимать несколько месяцев.